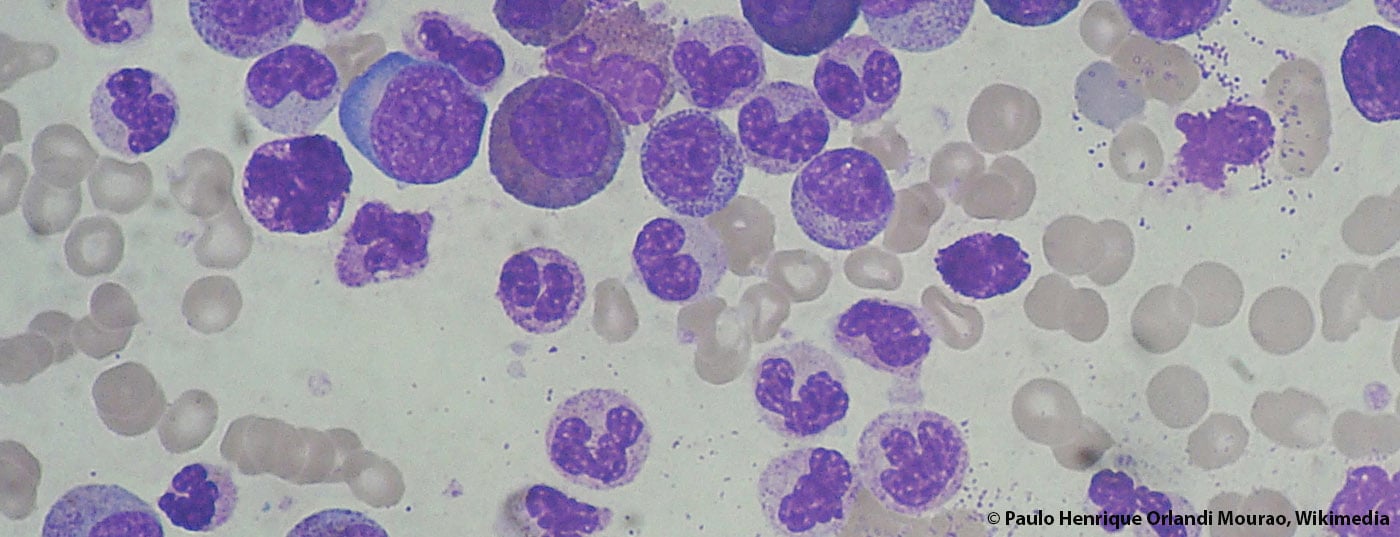
En los últimos años han ocurrido muchas cosas en el campo de la leucemia mieloide crónica (LMC). Las tasas de respuesta y supervivencia han aumentado considerablemente, e incluso se dice que algunos pacientes se han curado. Un suplemento de la revista Annals of Hematology publicado recientemente sobre el tema de la LMC ofrece una amplia panorámica de la situación del diagnóstico y la terapia en 2015.
Según diversos registros europeos, la incidencia de la leucemia mieloide crónica (LMC) se ha mantenido estable en los últimos años. La tasa anual es de 0,7-1,0/100.000. Por término medio, la edad del primer diagnóstico es de 57-60 años. Se desconocen los datos exactos de prevalencia – se suponen cifras en torno a 10-12/100.000 habitantes, aunque se observa un aumento constante debido a la gran mejora de las tasas de supervivencia. Esto plantea grandes retos para los sistemas sanitarios; después de todo, los costes de la terapia con inhibidores de la tirosina cinasa (ITC) son elevados. En este sentido, es interesante ver cómo se desarrollará el mercado de los genéricos. La patente del imatinib expira el próximo año.
El tratamiento ha mejorado mucho
El campo terapéutico en el área de la LMC se está desarrollando rápidamente. Las tasas de supervivencia han aumentado considerablemente en los últimos años y el objetivo del tratamiento está pasando cada vez más de la paliación a la curación. Los pacientes que responden a los TKI tienen ahora una supervivencia global casi tan buena como la población sana. En algunos casos, la respuesta es tan pronunciada que incluso es posible finalizar la terapia. Esto hace que sea aún más importante desarrollar conceptos y estudios para la remisión sin tratamiento.
¿Qué opciones tiene hoy en la primera, segunda y tercera líneas?
Es indiscutible que el imatinib ha revolucionado el tratamiento de la LMC. Sin embargo, actualmente se está debatiendo si la dosis habitual de 400 mg es adecuada para que todos los pacientes logren un resultado óptimo. Por ello, varios estudios investigaron el beneficio potencial del tratamiento con imatinib modificado o el uso de un TKI de segunda generación en el contexto de primera línea. Algunos enfoques que aún pueden describirse como experimentales con terapia de dosis altas (800 mg) o adaptadas a la dosis de imatinib o también la combinación con interferón mostraron una mejor respuesta citogenética y molecular que con la variante estándar – sin embargo, hasta ahora sin beneficio en la supervivencia libre de progresión (SLP) o la supervivencia global (SG). Además, se aprobaron el dasatinib y el nilotinib en primera línea, lo que amplió las opciones en el tratamiento de la LMC recién diagnosticada. Estos dos agentes inducen una respuesta molecular muy rápida y sostenida.
También es muy probable que los TKI de segunda generación dasatinib, nilotinib y bosutinib sean eficaces en segunda línea. Su eficacia global es comparable, por lo que los médicos deben tener en cuenta principalmente el perfil de mutación BCR-ABL1 y los antecedentes de la enfermedad a la hora de tomar decisiones sobre el tratamiento: Si no hay ninguna mutación o una mutación que responda bien a estos agentes, debe tomarse una decisión basada en los antecedentes de la enfermedad. Por otro lado, si está presente una de las pocas mutaciones de BCR-ABL1 que no responde bien a ninguno de los agentes, debe seleccionarse el TKI que haya demostrado actividad clínica contra la mutación específica. Para los pacientes con mutaciones T315I o tras el fracaso de nilotinib o dasatinib, el TKI de tercera generación ponatinib es una opción, aunque su dosis óptima aún se está estudiando.
En conjunto, se pudo demostrar que la evaluación de la respuesta molecular y citogenética ya permite una estratificación pronóstica del riesgo de las pacientes después de tres meses bajo tratamiento. Así pues, la respuesta temprana a los TKI está relacionada de forma crucial con el resultado a largo plazo. Esto se ha demostrado tanto para el imatinib como para los TKI de segunda generación y lo mismo para el tratamiento de segunda línea en varios estudios. Si un paciente sometido a un TKI concreto muestra un fracaso temprano del tratamiento, cabe suponer un resultado desfavorable, lo que a su vez hace que un cambio oportuno del tratamiento sea aún más importante.
Considere todas las opciones de tratamiento
Las ventajas y desventajas de la terapia a largo plazo con TKI deben compararse en cualquier caso con las del trasplante alogénico de células madre (HSCT). Aunque sigue siendo una opción como terapia de segunda y tercera línea en la primera fase crónica de la LMC, la tasa de trasplantes ha descendido significativamente desde la introducción de los TKI (para la indicación como terapia de rescate en la enfermedad avanzada, las tasas han descendido de forma menos acusada).
Algunos autores en este número de Anales de Hematología critican la consideración primordial del riesgo de enfermedad (definido como el fracaso de la terapia con TKI) en la decisión de realizar o no un trasplante: sugieren un enfoque más equilibrado que incluya el riesgo de trasplante y los aspectos económicos además del riesgo de enfermedad. El TCMH debe integrarse en el algoritmo de tratamiento desde el momento del diagnóstico inicial. Poco después del primer fracaso del tratamiento con TKI, debe evaluarse el HSCT si los pacientes afectados tienen un alto riesgo de enfermedad pero un bajo riesgo de trasplante. Por el contrario, en pacientes con enfermedad muy avanzada y alto riesgo de trasplante, el TCMH debe utilizarse de forma restrictiva y posiblemente sólo en el marco de un ensayo.
Efectos secundarios bajo TKI
Por un lado, la mayoría de los pacientes se benefician considerablemente de los TKI; por otro, los efectos secundarios han salido más a la luz precisamente por la supervivencia a largo plazo que se ha conseguido ahora. Quienes tienen que ser tratados con tales agentes durante toda su vida no sólo están interesados en la eficacia, sino también en la tolerancia.
En general, los TKI tienen un perfil de seguridad relativamente bueno en la práctica clínica, ya que aunque se producen muchos efectos secundarios de leves a moderados, éstos suelen limitarse al inicio de la terapia y pueden controlarse bien después o incluso resolverse espontáneamente. En la actualidad, sin embargo, las cuestiones sobre la seguridad a largo plazo siguen abiertas, especialmente en lo que respecta a las nuevas generaciones de TKI. Por ejemplo, recientemente se ha demostrado que en algunos casos estos nuevos agentes ejercen efectos negativos e irreversibles sobre órganos como el corazón y los pulmones, especialmente en presencia de comorbilidades. La selección del TKI adecuado requiere, por tanto, un examen minucioso de los parámetros de la enfermedad, el paciente y el fármaco.
Fuente: Anales de Hematología 2015; 94(2).
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(5): 22-24