El carcinoma basocelular (CCB) es el cáncer más frecuente en el mundo. Diversos factores y características tumorales influyen en el riesgo de recidiva, por lo que el CBC se divide en CBC de alto y bajo riesgo. El objetivo del tratamiento es la extirpación completa del tumor con un resultado cosméticamente satisfactorio. El patrón oro terapéutico sigue siendo la escisión quirúrgica. Sin embargo, las terapias tópicas (por ejemplo, el imiquimod), la terapia fotodinámica y la radioterapia también se han abierto camino en el CBC de bajo riesgo. Para los CCB muy grandes, invasivos y metastásicos, existe ahora también una terapia sistémica con vismodegib, aprobada en Suiza desde 2013.
En EE.UU., el riesgo de por vida de que un varón caucásico desarrolle un carcinoma basocelular (CBC) es de alrededor del 30% [1]. En Suiza, se detectó una incidencia de 200/100.000 habitantes en el grupo de edad de 70-79 años en los cantones de Neuchatel y Vaud en 2003 [2]. De hecho, es probable que la cifra sea mayor, ya que el CCO no es notificable y, por tanto, el registro está incompleto. Además, los CCB se extirpan a menudo en la práctica con procedimientos que no permiten la confirmación histológica.
Definición de carcinoma basocelular
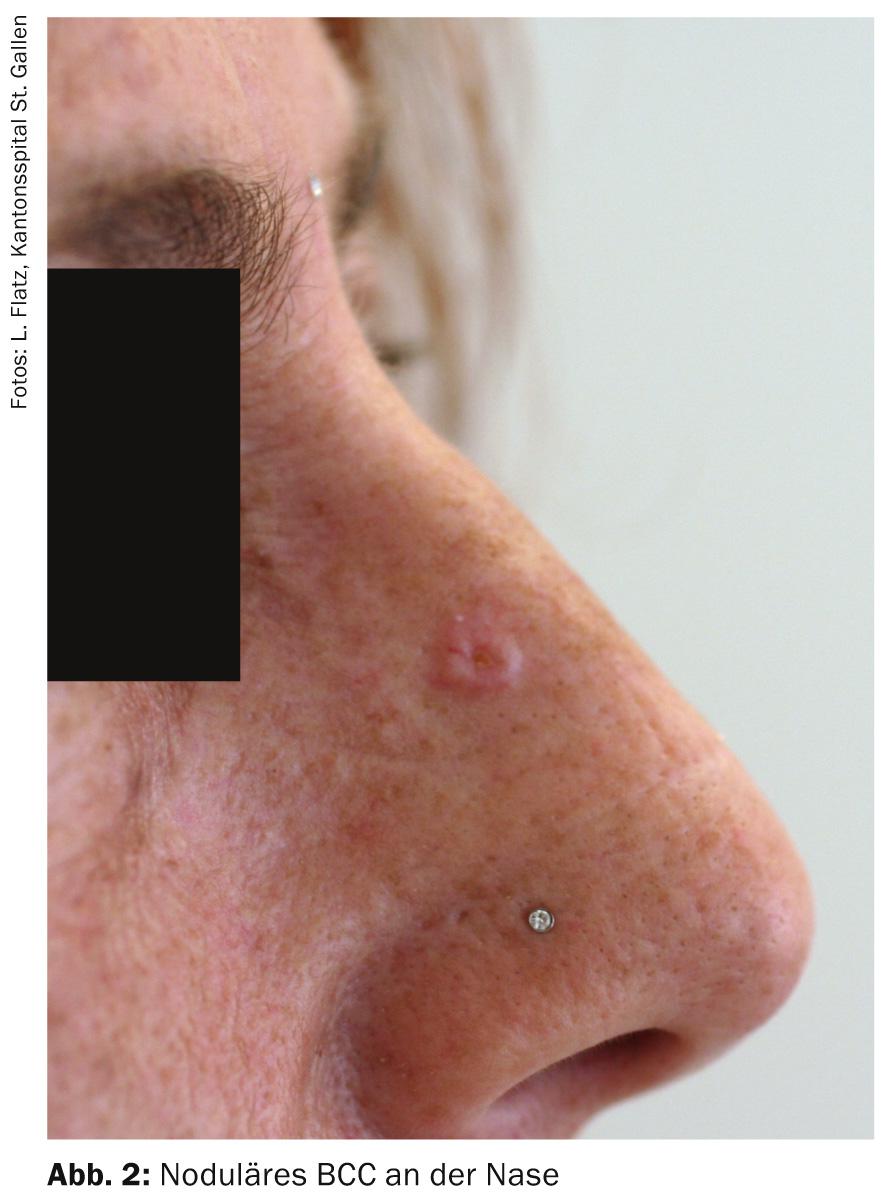
El CCB suele ser un tumor de la piel de crecimiento muy lento. El crecimiento es a menudo tridimensional y en casi todos los casos sólo causa una destrucción local del tejido. Debido a la tasa extremadamente baja de metástasis (<0,003-0,1%), también se denomina tumor semimaligno [3]. Probablemente se origina a partir de células precursoras de diferentes niveles del folículo piloso, más comúnmente la vaina de la raíz del pelo. Se supone que existe un origen monoclonal, lo que también se refleja en el hecho de que pueden crecer distintos tipos de CBC a pesar de tener la misma localización. El CCB casi siempre se encuentra en zonas del cuerpo expuestas al sol. En aproximadamente el 80% de los pacientes, el CBC se produce entre la comisura de la boca y la base inferior de la oreja (la denominada “zona de la máscara”), de las cuales la nariz es la más frecuente con un 30% (Fig. 1 y 2). El orden de las localizaciones más frecuentes es nariz > tronco > tercio inferior de la cara > capilicio y resto de la piel.
Riesgo y causas
El paciente típico con CBC es caucásico, mayor de 60 años y varón. Se ven afectados predominantemente los tipos de piel clara (I y II según Fitzpatrick) [4]. La incidencia del CBC está aumentando, más rápidamente en las mujeres que en los hombres; se cree que los factores relacionados con el estilo de vida son la causa de ello.
La luz ultravioleta, especialmente la exposición al sol durante años, se considera la principal causa del CBC. En el caso del CBC, las exposiciones intensivas y cortas a los rayos UVB en el rango de 290-320 nm parecen tener la mayor influencia. Por ello, las fuentes artificiales de irradiación (solariums, fototerapia, etc.) también pueden ser estresantes. Se calcula que la inmunosupresión multiplica por 10 el riesgo de desarrollar CBC [5]. Las radiaciones ionizantes, por ejemplo la radioterapia y especialmente la irradiación frecuente, también favorecen el desarrollo del CBC. La exposición al arsénico también puede provocar CBC a largo plazo.
También existen enfermedades hereditarias muy poco frecuentes que se asocian a un aumento del CCB. Uno de ellos es el síndrome de Gorlin-Goltz (“Síndrome del carcinoma basocelular nevoide”, NBCCS). Se trata de una enfermedad hereditaria autosómica dominante en la que el receptor parcheado está mutado. Patched forma parte de la vía Hedgehog(Hh) y suprime Smoothened (SMO). Si se omite la inhibición de la SMO, se produce una sobreexpresión de la vía Hh. Dicha sobreexpresión también se encuentra en el CCB de pacientes que no presentan CCNB y, por lo tanto, casi siempre se considera un requisito previo para el desarrollo del CCB [6].
Subtipos de carcinoma basocelular
Se han descrito más de 26 tipos diferentes de CBC. Las más comunes son las siguientes:
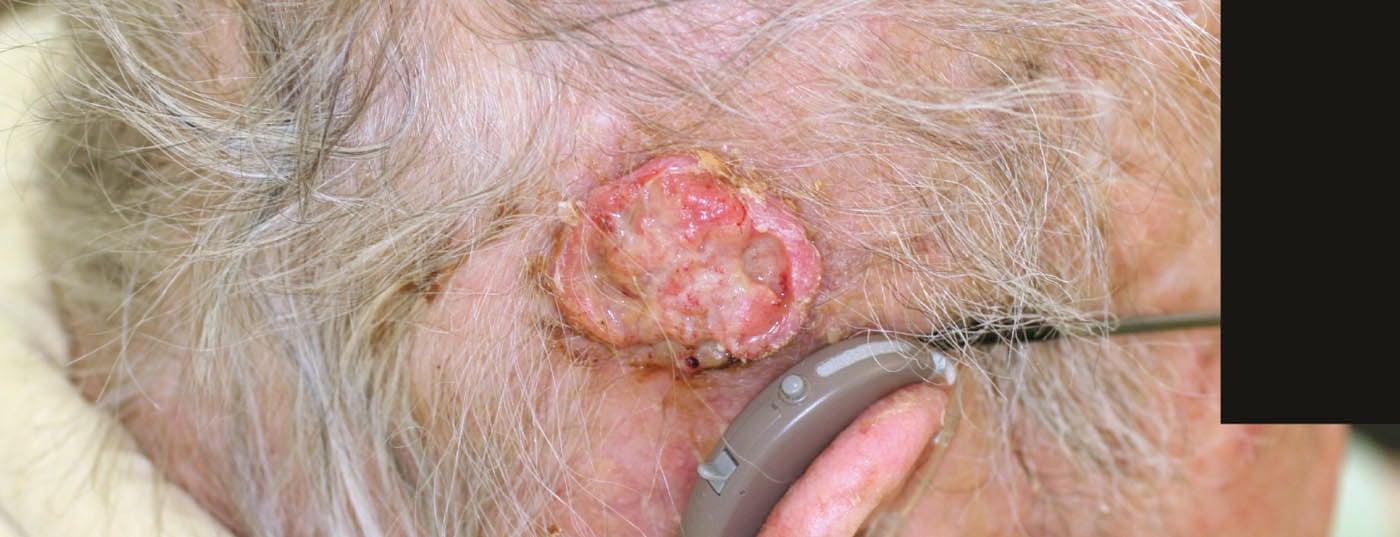
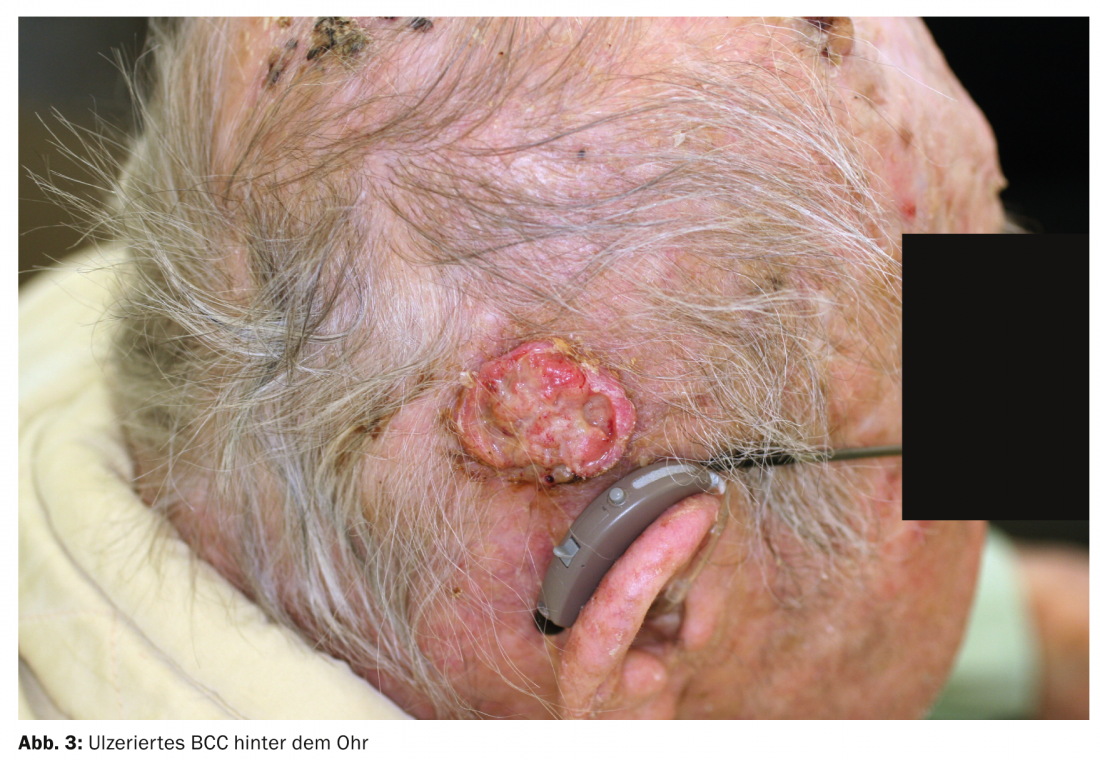
- CBC nodular (CBC sólido, nBCC): Este subtipo más común representa alrededor del 50% de todos los CCB. Lo característico del tumor clínicamente bien circunscrito, en forma de cúpula, es un borde abalorioso y elevado intercalado con telangiectasias. A menudo es visible una depresión central; si ésta está ulcerada, se denomina basalioma exulceroso (Fig. 3) . El diagnóstico diferencial incluye la hiperplasia de las glándulas sebáceas, los tumores anexiales, los nevos dérmicos o los queratoacantomas. Los focos profundos pueden extenderse al cartílago o al hueso y provocar una mayor morbilidad debido a daños a veces considerables (por ejemplo, destrucción del ojo).
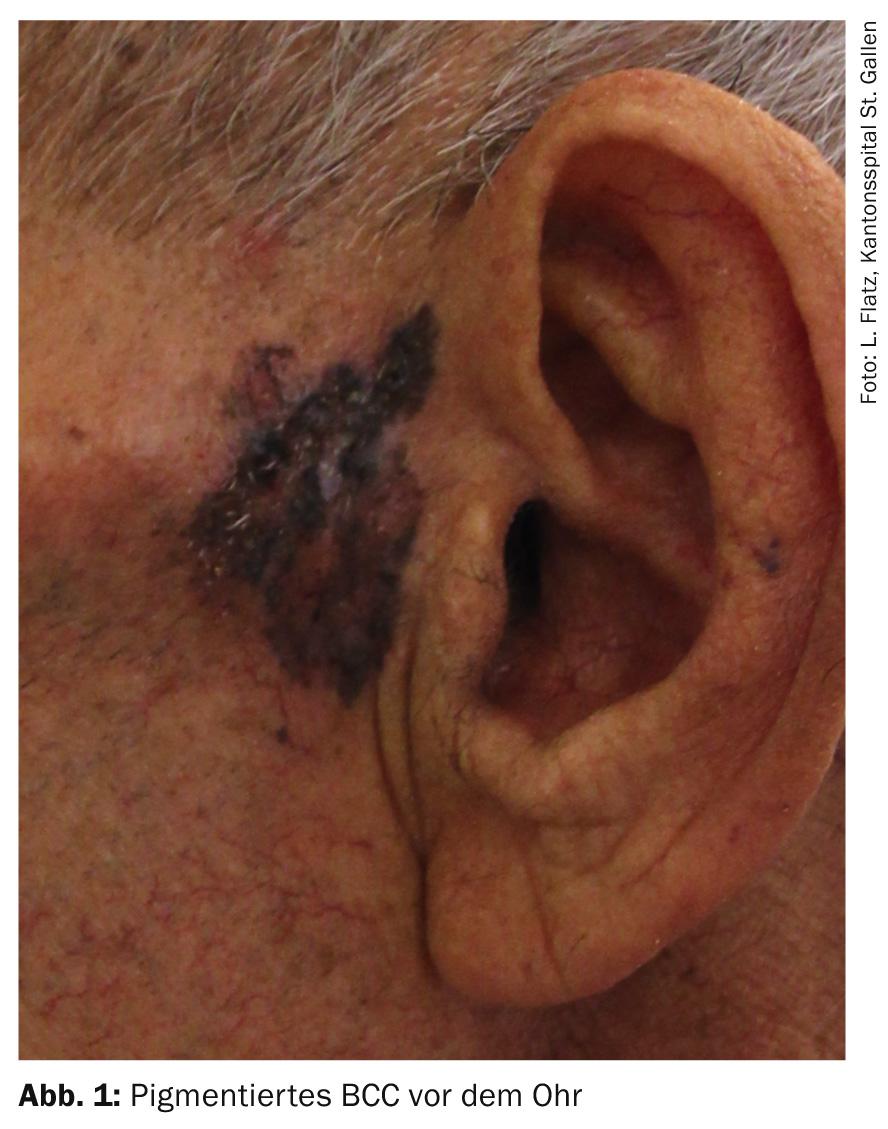
- CBC pigmentado: Este subtipo de CBC nodular puede confundirse con el melanoma ulceroso, por un lado, y con los hemangiomas, los nevos melanocíticos o las queratosis seborreicas, por otro (si son pequeños), debido a su aspecto oscuro. Las telangiectasias suelen estar enmascaradas por el pigmento, lo que dificulta el diagnóstico clínico.
- CBC esclerodermiforme (CBCs): Superficialmente, el CBCs se presenta como una placa atrófica, ligeramente indentada, por lo que puede confundirse con una morfea. Subcutáneamente, el sBCC se extiende por una gran superficie en grupos tumorales ramificados, cuyos bordes no son clínicamente reconocibles. Desde el punto de vista quirúrgico, debe optarse por una distancia de resección mayor e, idealmente, por una “cirugía micrográfica de Mohs” o una operación en dos fases (“Slow-Mohs”).
- CBC superficial (suBCC): El SuBCC se caracteriza por una propagación muy superficial y multicéntrica. A menudo hay zonas de piel sana entre los nidos tumorales. Normalmente, no hay ulceración. La clínica puede parecerse a la del eccema numular. Debido a la escasa profundidad de penetración, los suBCC suelen ser bien tratables con terapia tópica (por ejemplo, imiquimod).
- CBC met atípico: El CBC metatípico es una forma mixta de CBC y carcinoma de células escamosas, pero sólo puede identificarse histológicamente. Clínicamente, el CCB metatípico es similar al CCBn. Sin embargo, lo que sí es significativo es un crecimiento más agresivo.
- CBC metastásico: La metástasis es extremadamente rara en el CBC. Se da sobre todo en CBC grandes y profundamente ulcerados y es tanto linfogénica como hematógena, preferentemente en pulmón y hueso.
Diagnóstico, grados de riesgo y opciones de tratamiento
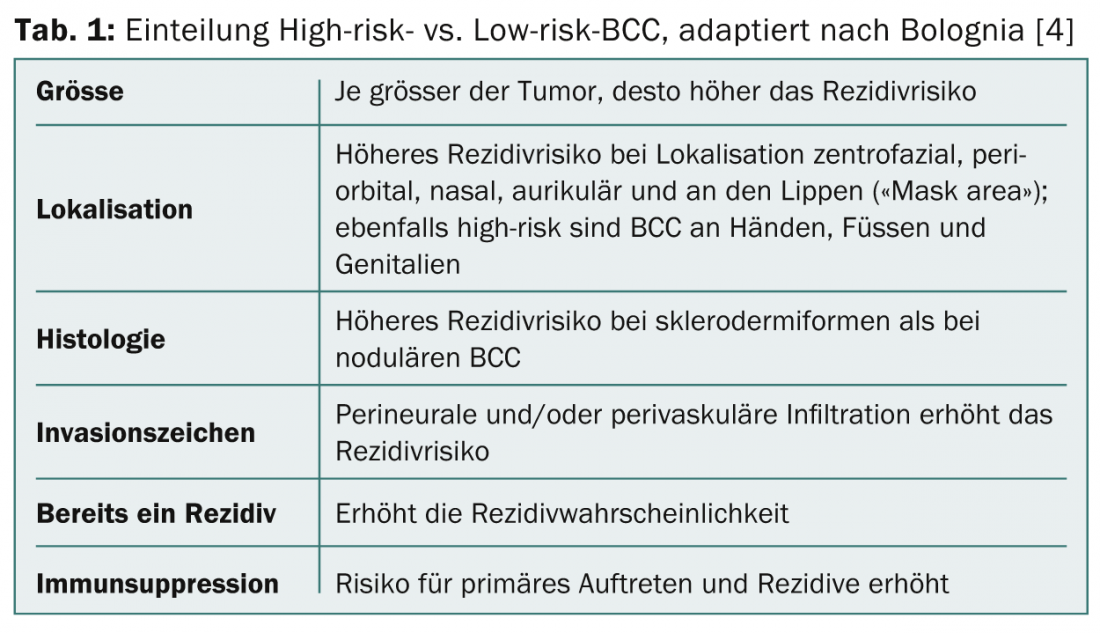
Si se sospecha un CCB (antecedentes, localización, progresión), debe tomarse una muestra de biopsia, ya que es la única forma de confirmar los diagnósticos, identificar el tipo de CCB y evaluar la profundidad del tumor. Diversos factores y características tumorales influyen en el riesgo de recidiva (Tab. 1) . Mediante la evaluación de estos factores, los tumores se dividen en CBC de alto riesgo y CBC de bajo riesgo.
Actualmente existen varias opciones de tratamiento quirúrgico y no quirúrgico (Fig. 4). El tratamiento tiene dos objetivos principales: la extirpación completa del tumor y un resultado cosméticamente aceptable. Tanto para el CBC de bajo como de alto riesgo, la escisión quirúrgica con control histológico de los márgenes de incisión es el tratamiento de elección. Para el CBC de bajo riesgo, existen buenas alternativas, pero el mejor resultado a largo plazo también se consigue con la escisión quirúrgica.
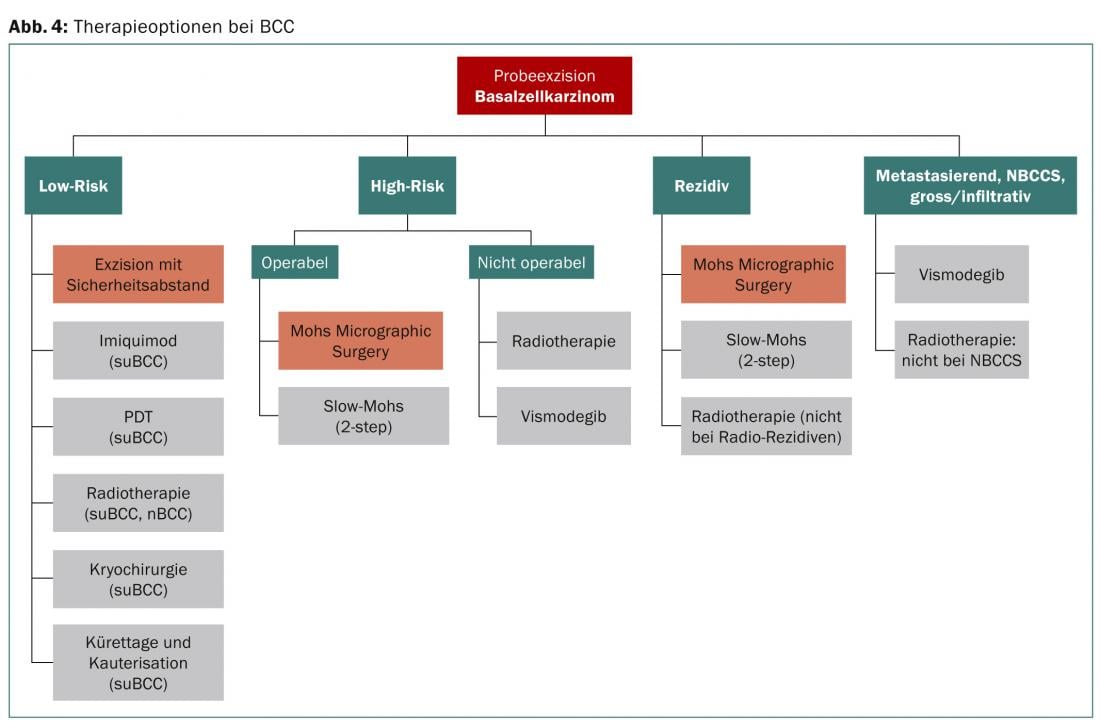
Métodos de terapia quirúrgica
Escisión quirúrgica con un margen de seguridad: La regla de oro para el tratamiento del CBC de bajo riesgo es la escisión con un margen de seguridad. Su tamaño depende del tipo de tumor y de la localización (Tab. 2). En el caso de un CBC bien circunscrito <20 mm, se supone que la probabilidad de tumor residual es del 15% a una distancia de 3 mm y del 5% a una distancia de 4-5 mm [7,8].

Cirugía micrográfica de Mohs (CMM): Este procedimiento, desarrollado por el Dr. La técnica desarrollada por Mohs permite la preparación intraoperatoria y la evaluación de secciones congeladas. De este modo, se pueden detectar células tumorales residuales en los bordes de la incisión y ablacionarlas inmediatamente. El cirujano puede realizar la ablación en cualquier dimensión hasta que no se detecten más células tumorales. Las tasas de remisión a 5 años del 99% para el CBC primario y del 95% para la recidiva tras la escisión convierten a este método en el patrón oro para el CBC de alto riesgo [8]. El método requiere una formación especializada del cirujano y un alto nivel de experiencia. Alternativamente, la sección congelada puede ser evaluada por un patólogo.
Cirugía en dos tiempos (Mohs lento): En la cirugía en dos fases, primero se realiza una escisión primaria con un margen de seguridad sin cierre, tras lo cual el espécimen es evaluado por los patólogos. Si el tumor se ha extirpado por completo, el cuidado definitivo de la herida se lleva a cabo en la operación de seguimiento, por ejemplo mediante cierre directo o flapplastia. Si la escisión no fue in toto, se realiza una nueva resección con control histológico. En general, la MMS es preferible porque los márgenes de la incisión permanecen próximos al extremo del tumor y se eliminan los márgenes de seguridad más amplios, lo que se traduce en un resultado estético más agradable. En el caso de la cirugía en dos fases, los intervalos deben ser más generosos. Para el CBC de alto riesgo, se recomienda hasta 1 cm, pero a menudo esto no resulta práctico, especialmente en la zona de la máscara en la cara (por ejemplo, en el párpado inferior). En este caso, el cirujano debe sopesar individualmente los beneficios y los riesgos.
CBC no extirpado in toto: En dos estudios con CBC no extirpado in toto confirmado histológicamente, el post-resecado mostró que las células tumorales residuales del CBC seguían siendo detectables sólo en aproximadamente la mitad. Las razones aún no están claras, posiblemente se desarrolle un medio destructivo celular en el postoperatorio que destruya las células tumorales restantes. El mejor método de tratamiento para las recidivas es la MMS, alternativamente se realiza una escisión en dos fases con un margen de seguridad generoso (se sugiere 5-10 mm). En algunos casos, los tumores in situ o las células residuales superficiales pueden tratarse de forma adyuvante con imiquimod o terapia fotodinámica, pero aún no existen datos a largo plazo al respecto.
Métodos de terapia ablativa y destructiva sin histología
Curetaje y cauterización: Estos procedimientos tienen cabida en el tratamiento de las lesiones periféricas de bajo riesgo. Sin embargo, los procedimientos combinados con imiquimod y terapia fotodinámica (TFD) dieron mejores resultados. El curetaje y la cauterización no parecen ser adecuados para el tratamiento de las recidivas; la ausencia de tumores a los 5 años es sólo del 60% en un estudio [9].
Crioterapia/criocirugía: una opción terapéutica rápida y sencilla para el CBC de bajo riesgo. Se han observado tasas de remisión del 85-95% en ensayos controlados aleatorizados [10]. Los efectos secundarios incluyen dolor, eritema y formación de ampollas y costras; también son posibles la cicatrización y la atrofia. Para las lesiones de alto riesgo, la crioterapia puede tener cierto valor. En un estudio, 158 CBC periorbitarios fueron tratados con criocirugía, y la tasa de recurrencia a los 5 años de seguimiento fue del 7,6% [11].
Terapia tópica con imiquimod (Aldara®) y mebutato de ingenol (Picato®): La terapia con imiquimod está actualmente aprobada para el CCB superficial. Una reacción cutánea más intensa (erosiones, ulceraciones) conduce a mejores resultados pero tiene un impacto negativo en el cumplimiento, por lo que la Asociación Británica de Dermatólogos (BAD) recomienda un régimen de 5×/semana durante seis semanas para el suBCC [8]. La oclusión de la zona de terapia no parece aportar ninguna ventaja. No existe autorización de comercialización para el tratamiento del nBCC en Suiza.
El mebutato de ingenol está aprobado en Suiza para el tratamiento de la queratosis actínica desde 2013. Se ha descrito el tratamiento con éxito del suBCC [12], pero en Suiza no se dispone de autorización de comercialización para esta indicación.
Terapia fotodinámica (TFD) con ácido 5-aminolevulínico (ALA) o aminolevulinato de metilo (MAL): la TFD es una opción para los pacientes que padecen un CBCsu o un CBCn de gran superficie difíciles de operar. Para el suBCC, la tasa de remisión a los 3 años es del 69-85%; para el nBCC, la tasa de remisión a los 5 años de seguimiento es del 70-82%. En el caso del nBCC, la citorreducción debe realizarse en primer lugar con un grosor tumoral de >2 mm. En suBCC, pueden utilizarse tanto ALA como MAL. Para el nBCC, el MAL es preferible, ya que penetra más profundamente en la piel [13].
Radioterapia: La radioterapia sigue teniendo cabida en pacientes mayores que no pueden ser operados o que son difíciles de operar. En este caso, la radioterapia puede utilizarse bien para el CBC de bajo riesgo y de forma condicional para el de alto riesgo y las recidivas. La radioterapia también es adecuada como terapia neoadyuvante y adyuvante. La tasa de remisión a los 4 años es del 80% en numerosos estudios >.
Como efecto secundario, cabe mencionar sobre todo la radionecrosis, para la que están predestinadas algunas zonas como el puente de la nariz. Otros efectos secundarios son los trastornos pigmentarios, la telangiectasia y la radiodermitis. Las escisiones quirúrgicas tienen un mejor resultado cosmético. En el NBCCS, así como en el xeroderma pigmentoso, la radioterapia está contraindicada, ya que el daño por radiación puede provocar la formación de nuevos CCB [10,14]. Además, la recidiva de un CBC radioterapiado no debe irradiarse de nuevo [8].
Vismodegib (Erivedge®): En el NBCCS, una mutación provoca una regulación al alza permanente de la vía Hh. El vismodegib es un inhibidor de SMO-1 y de esta forma inhibe la vía Hh. Desde 2013, el vismodegib está aprobado en Suiza para el tratamiento del CBC avanzado, localmente invasivo y metastásico en el que otras opciones terapéuticas (escisión, radioterapia, etc.) supondrían desventajas considerables para el paciente. Los efectos secundarios incluyen espasmos musculares, disgeusia, caída del cabello, fatiga, náuseas e hiponatremia. Desgraciadamente, la resistencia ya está mostrando [15]; en los pacientes correspondientes, la SMO se alteró de forma diferente según el lugar de la biopsia. Las futuras opciones de tratamiento dirigidas a la vía Hh podrían incluir el itraconazol y la vitamina D3, que tienen un efecto inhibidor sobre la SMO.
Cuidado posterior
El riesgo de desarrollar un segundo CBC aumenta después de un CBC primario. A medida que aumenta el número de CCB y la edad, también lo hace el riesgo de que aparezcan más CCB. En el cantón de Vaud, el riesgo acumulado de un segundo CCB es del 20% al cabo de diez años y del 40% al cabo de 20 años [2]. Las siguientes recomendaciones son útiles para los cuidados de seguimiento:
- Autocontrol estrecho del paciente. Esto requiere una explicación e instrucciones detalladas por parte del médico.
- Protección solar constante con un factor SPF 30 como mínimo.
- El riesgo de un segundo CBC es mayor en los tres primeros años tras el diagnóstico [16]. Las directrices actuales en Alemania (03/2012) recomiendan controles anuales durante los tres primeros años [8].
Conclusión para la práctica
- El CCB es el cáncer más común de todos. Antes de la terapia, se realiza una clasificación en CBC de alto y bajo riesgo.
- En caso de sospecha, se realiza una escisión de la muestra para confirmar el diagnóstico.
- Tanto en el CBC de alto como de bajo riesgo, la escisión quirúrgica es el mejor método de tratamiento. Las terapias no invasivas pueden considerarse para el CBC de bajo riesgo cuando las circunstancias son desfavorables para la cirugía.
- Si el CCB se produce en un paciente muy joven, debe descartarse el CCNB.
- Debido al mayor riesgo de un segundo CBC, los pacientes deben someterse a un seguimiento anual durante al menos tres años.
Dr. Omar Hasan Ali
Dr. Josef Aschwanden
Dr. Lukas Flatz
Literatura:
- Wong CS, et al: Carcinoma de células basales. BMJ 2003; 327(7418): 794-798.
- Levi F, et al: Alta incidencia de segundos cánceres cutáneos de células basales. Revista internacional del cáncer 2006; 119(6): 1505-1507.
- Reifenberger J: Carcinoma de células basales. En: Plewig G, editor. Dermatología, venereología y alergología de Braun-Falco. Berlín: Springer; 2012.
- Soyer HP, et al: Queratosis actínica, carcinoma de células basales y carcinoma de células escamosas. En: Bolognia J, Jorizzo JL, Schaffer JV, editores. Dermatología. [Philadelphia] Elsevier Saunders; 2012.
- Hartevelt MM, et al: Incidencia del cáncer de piel tras el trasplante renal en los Países Bajos. Trasplantes 1990; 49(3): 506-509.
- Kasper M, et al.: Carcinoma basocelular: biología molecular y nuevas terapias potenciales. The Journal of clinical investigation 2012; 122(2): 455-463.
- Hauschild A, et al: Breves directrices S2k–Carcinoma basocelular de piel. Revista de la Sociedad Alemana de Dermatología 2013; 11 Suppl 3: 10-15, 1-6.
- Telfer NR, et al: Directrices para el tratamiento del carcinoma basocelular. Revista británica de dermatología 2008; 159(1): 35-48.
- Rowe DE, et al: La cirugía de Mohs es el tratamiento de elección para el carcinoma basocelular recidivante (previamente tratado). Revista de cirugía dermatológica y oncología 1989; 15(4): 424-431.
- Berking C, et al.: Carcinoma basocelular: tratamientos para el cáncer de piel más frecuente. Deutsches Ärzteblatt internacional 2014; 111(22): 389-395.
- Tuppurainen K: Crioterapia para carcinomas de células basales de párpados y perioculares: resultados en 166 casos durante un periodo de 8 años. Archivo de oftalmología clínica y experimental de Graefe 1995; 233(4): 205-208.
- Siller G, et al: Gel PEP005 (mebutato de ingenol) para el tratamiento tópico del carcinoma basocelular superficial: resultados de un ensayo aleatorizado de fase IIa. The Australasian journal of dermatology 2010; 51(2): 99-105.
- Braathen LR, et al: Directrices sobre el uso de la terapia fotodinámica para el cáncer de piel no melanoma: un consenso internacional. J de la Academia Americana de Dermatología 2007; 56(1): 125-143.
- Kimonis VE, et al: Manifestaciones clínicas en 105 personas con síndrome de carcinoma basocelular nevoide. Revista americana de genética médica 1997; 69(3): 299-308.
- Brinkhuizen T, et al: Resistencia adquirida al inhibidor de la vía Hedgehog vismodegib debido a mutaciones smoothened en el tratamiento del carcinoma basocelular localmente avanzado. J Am Acad Dermatol 2014. pii: S0190-9622(14): 1792-1797.
- Marcil I, et al: Riesgo de desarrollar un cáncer de piel no melanoma posterior en pacientes con antecedentes de cáncer de piel no melanoma: revisión crítica de la literatura y metaanálisis. Archivos de dermatología 2000; 136(12): 1524-1530.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2014; 2(9): 8-13