Es importante un esclarecimiento microbiológico rápido con diagnósticos sensibles y específicos debido al aumento de la resistencia a los antibióticos, especialmente en el caso de los gonococos. Este artículo de revisión proporciona conocimientos sobre los aspectos epidemiológicos y de diagnóstico de las infecciones por Chlamydia trachomatis y Neisseria gonorrhoeae.
En Suiza y otros países europeos se ha producido un rápido aumento de las enfermedades de transmisión sexual en los últimos años. Es importante un esclarecimiento microbiológico rápido con diagnósticos sensibles y específicos debido al aumento de la resistencia a los antibióticos, especialmente en el caso de los gonococos. Este artículo de revisión pretende aportar conocimientos sobre los aspectos epidemiológicos y de diagnóstico de las infecciones por Chlamydia trachomatis y Neisseria gonorrhoeae.
Epidemiología
Las cifras de infecciones por Chlamydia trachomatis, Neisseria gonorrhoeae y Treponema pallidum han aumentado considerablemente en términos absolutos y relativos en Suiza y en muchos países europeos en los últimos años [1,2]. En Suiza, estos tres patógenos bacterianos y los virus de transmisión sexual, como el VIH y el virus de la hepatitis B, deben ser notificados por el laboratorio de diagnóstico por ley. La notificación obligatoria de estas enfermedades permite la vigilancia epidemiológica (www.bag.admin.ch) y la identificación de los factores de riesgo y de las poblaciones.
En los cantones de Basilea-Ciudad, Zúrich, Ginebra y Vaud, el aumento de las enfermedades de transmisión sexual es significativo, mientras que en las zonas rurales se han documentado cifras inferiores [1]. Aunque es probable que el gran desarrollo de los diagnósticos moleculares en los últimos años y la mayor cobertura diagnóstica en los centros urbanos expliquen parte de este aumento, también es muy probable que el comportamiento sexual descuidado sea en parte responsable, aunque los estudios bien fundamentados sobre este tema son escasos. Se puede postular que la posibilidad de una profilaxis preexposición específica para el VIH ha reducido significativamente el miedo a la infección por el VIH. Esto acepta un riesgo sexualmente mayor de contraer otras infecciones. Por ello, para determinadas poblaciones de riesgo con infecciones bacterianas recurrentes, se está debatiendo la profilaxis contra la clamidia y los gonococos [3,4]. Sin embargo, hasta ahora faltan estudios aleatorizados en este ámbito, también en el contexto de la resistencia a los antibióticos.
Neisseria gonorrhoeae: En 2015, se notificaron 1895 infecciones confirmadas de N. gonorrhoeae en Suiza, lo que supone aproximadamente un 23% más que el año anterior, con 1545 notificaciones (Fig. 1A, www.bag.admin.ch). La mayoría de los casos han afectado a hombres (alrededor del 80%). Sin embargo, se ha producido un aumento significativo en ambos sexos desde el año 2000. La incidencia en Suiza en 2015 fue de 9 por 100.000 habitantes para las mujeres y de 37 por 100.000 habitantes para los hombres [5]. La mayoría de los casos se dan en centros urbanos. La mayor proporción de mujeres se encontró en el grupo de edad de 15 a 24 años, y entre los hombres, el grupo de 25 a 34 años es el especialmente afectado. Se observó un aumento especialmente fuerte en el grupo de hombres que mantienen contactos sexuales con otros hombres (HSH). Se calcula que sólo el 3% de la población sexualmente activa son HSH, pero según los estudios de la FOPH presentan una media del 38% de infecciones por gonorrea [5].
Chlamydia trachomatis: En 2015, se notificaron 10.157 infecciones confirmadas de C. trachomatis en Suiza, lo que supone aproximadamente un 5% más que el año anterior, con 9.677 notificaciones (Fig. 1B, www.bag.admin.ch). En general, el número de casos se ha más que duplicado en los últimos diez años. La incidencia en Suiza en 2015 fue de 161 por 100.000 habitantes para las mujeres y de 80 por 100.000 habitantes para los hombres [6]. Esto puede ser en parte un pseudoincremento, ya que el porcentaje de positivos en todas las pruebas realizadas se ha mantenido relativamente estable [7]. Ciertamente, también se están diagnosticando más infecciones asintomáticas, lo que tiene que ver con la disponibilidad de diagnósticos moleculares sensibles y de cribados más frecuentes. Aproximadamente el 70% de las infecciones se producen en mujeres, la mitad de las cuales tienen entre 15 y 24 años. En el 70-90% de las mujeres, la infección es asintomática.

Diagnóstico de N. gonorrhoeae – Recogida de muestras
La recogida correcta de las muestras es fundamental para la detección cultural de N. gonorrhoeae. Los gonococos tienden a la autolisis y son sensibles a la desecación y a las sustancias tóxicas de algunos lubricantes [8].
Hoy en día se utilizan medios de transporte universales líquidos como medio de recogida y transporte de elección, que permiten realizar tanto cultivos bacterianos como análisis de diagnóstico molecular (PCR) (por ejemplo, eSwab de Copan). Estos medios de transporte contienen unos novedosos hisopos con fibras de flocado de nailon que aumentan el rendimiento de la recogida de muestras en comparación con los hisopos convencionales [9–11]. Sin embargo, como también hay laboratorios de diagnóstico que requieren recipientes de transporte diferentes para la PCR gonocócica y el cultivo, recomendamos consultar al laboratorio examinador respectivo antes de tomar la muestra.
El lugar de recogida debe elegirse en función de la historia sexual [12]. En los hombres, los hisopos uretrales y la orina de primer chorro se consideran el material de examen de elección. Ambas muestras deben tomarse al menos una hora después de la última micción. El frotis cervical debe tomarse como el material de examen de elección en las mujeres. Por lo general, no deben utilizarse muestras de orina de mujeres, ya que son menos sensibles que las citologías cervicales [13]. En las niñas prepúberes, las infecciones por gonococos deben buscarse por vía vaginal y no cervical [14]. En este grupo de edad, las niñas y los niños deben consultar, por supuesto, a un pediatra.
Los hisopos rectales deben obtenerse con un rectoscopio. Debe evitarse el uso de lubricantes, ya que a veces contienen sustancias tóxicas para N. gonorrhoeae y reducen la sensibilidad de la detección cultural. La técnica de recogida debe abarcar una zona de hisopado lo más amplia posible [15]. Un estudio demostró que en el caso de la infección orofaríngea, el área más amplia posible con presión adicional durante el hisopado casi duplicaba la tasa de detección [15]. Para una orientación detallada sobre la recogida óptima de muestras para el diagnóstico de la gonorrea, consulte las recomendaciones de la Comisión Federal de Salud Sexual y la Sociedad Suiza de Infectología [13]. Si se desea realizar un cultivo gonocócico, la muestra debe tomarse antes de administrar los antibióticos. El transporte de las muestras al laboratorio debe ser lo más rápido posible y el cultivo debe realizarse preferentemente en un plazo de veinticuatro horas [16]. La muestra puede enviarse en el medio de transporte a temperatura ambiente.
Microscopía
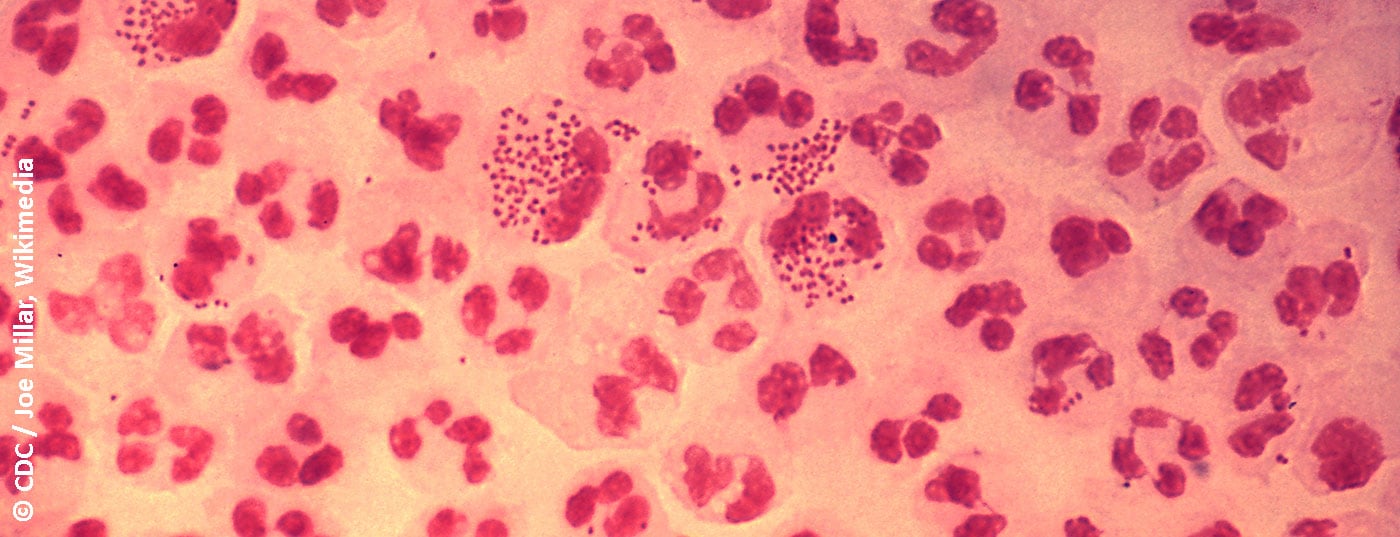
En los hombres sintomáticos, la detección es posible con una preparación de Gram a partir de un hisopo uretral. La detección de diplococos gramnegativos con forma de grano de semen a café en los leucocitos polinucleares es seminal para la gonorrea [17]. La sensibilidad y especificidad de este examen es >90% [14]. En las mujeres, la sensibilidad del análisis microscópico de un frotis cervical es inferior, del 50-70%, pero la especificidad es de >90% [14]. Por supuesto, la fiabilidad de la microscopía depende de la calidad de la muestra y de la experiencia del examinador [14]. La microscopia no es útil para diagnosticar una infección orofaríngea porque las Neisseria spp. apatógenas como componente de la flora oral no permiten una diferenciación fiable de las N. gonorrhoeae patógenas.
Métodos de biología molecular
En la actualidad, existen varios sistemas comerciales que permiten la detección de N. gonorrhoeae y C. trachomatis a partir de la misma muestra mediante la amplificación del ADN (PCR), las denominadas PCR dúplex. La sensibilidad y la especificidad de estos sistemas son excelentes, cada una de ellas en >95% [18–21], por lo que ahora son estándar para la detección de infecciones por N. gonorrhoeae y C. trachomatis [22].
Recientemente, también existen PCR multiplex que permiten un esclarecimiento más amplio con otros patógenos como Mycoplasma hominis, M. genitalium, Ureaplasma urealyticum y U. parvum [23,24]. Las pruebas moleculares con sistemas (semi)automatizados son menos costosas que los métodos de cultivo y permiten un alto rendimiento de las muestras clínicas, especialmente para el cribado rápido. El tiempo que transcurre desde la recepción de la muestra en el laboratorio hasta la obtención del resultado (el llamado tiempo de respuesta) suele ser de sólo unas horas, y los resultados suelen estar disponibles el mismo día, dependiendo de la hora de recepción de la muestra. Los métodos de PCR no deben utilizarse para documentar el éxito del tratamiento a corto plazo, ya que el ADN de N. gonorrhoeae puede seguir determinándose varias semanas después del éxito del tratamiento utilizando métodos de detección sensibles [14]. Las reinfecciones o los aislados resistentes también pueden ser responsables [25]. En este caso, debe realizarse de nuevo la historia clínica y a continuación una detección cultural con pruebas de resistencia a los antibióticos.
Otros métodos de detección
Las pruebas en el punto de atención (POC) para la detección de la esterasa leucocitaria y las pruebas inmunocromatográficas muestran una baja sensibilidad en las infecciones por N. gonorrohoeae, con sólo un 23-85% y un 60-94%, respectivamente [26]. Por el momento, los métodos basados en la PCR son, por tanto, claramente superiores.
Cultivo bacteriano
La detección cultural de gonococos viables es necesaria para detectar un posible fracaso del tratamiento y recopilar datos fiables sobre la situación y la evolución de la resistencia. Los gonococos suelen cultivarse en medios selectivos. Los medios contienen antibióticos y antifúngicos para inhibir la flora bacteriana y fúngica acompañante. Un medio típico, que también se utiliza en nuestro laboratorio, es el agar Martin-Lewis basado en agar sangre de cocción. Se comprueba diariamente el crecimiento de las placas inoculadas y se incuban durante 48 horas a 36°C en una atmósfera con un 5% de CO2. Los gonococos crecen como colonias pequeñas, lisas y grises en el primer o segundo día. Así, una detección cultural de bacterias vivas suele tardar entre dos y tres días, a diferencia de una PCR, pero ofrece más posibilidades de diagnóstico.
La identificación precisa de las colonias sospechosas en la placa de cultivo solía hacerse probando varias reacciones bioquímicas, lo que llevaba varias horas para establecer un perfil bioquímico. Hoy en día, la identificación de un aislado bacteriano se realiza en pocos minutos mediante espectrometría de masas de Ionización por Desorción Láser Asistida por Matriz – Tiempo de Vuelo (MALDI-TOF). La espectrometría de masas MALDI-TOF se ha convertido en la actualidad en el estándar de identificación de una amplia variedad de bacterias y hongos en los laboratorios de microbiología [27]. Sin embargo, el factor que limita el tiempo sigue siendo el cultivo de las bacterias en una placa de agar.
Posición de resistencia
La Organización Mundial de la Salud (OMS) ha elaborado recientemente una lista de gérmenes resistentes para los que deben desarrollarse urgentemente nuevos antibióticos eficaces: la N. gonorrhoeae resistente a las cefalosporinas y a las fluoroquinolonas se encuentran entre ellos (www.who.int). Las pruebas de resistencia tras la detección cultural de N. gonorrhoeae son importantes [13,28]. A pesar de la urgencia, la vigilancia de la resistencia a los antimicrobianos no está normalizada ni suficientemente establecida en muchos países [29]. Normalmente se prueban los siguientes antibióticos para N. gonorrhoeae: Cefixima, ceftriaxona, fluoroquinolonas (por ejemplo, ciprofloxacina) y azitromicina. Las pruebas de resistencia requieren dos días adicionales tras la identificación.
El tratamiento de la N. gonorrhoeae se complica por el desarrollo de la resistencia a los antibióticos. Aunque la penicilina seguía considerándose el tratamiento de elección en la década de 1970, el aumento de las penicilinasas mediadas por plásmidos (enzimas que eliminan la penicilina) y la resistencia cromosómica a la penicilina han puesto fin a la terapia con penicilina [30]. Del mismo modo, el desarrollo de resistencia plasmídica y cromosómica a la tetraciclina condujo al uso de cefalosporinas de amplio espectro en la década de 1980 y, posteriormente, al uso de fluoroquinolonas [30]. En la década de 1990 se produjo un aumento de los aislados resistentes a la fluoroquinolona, inicialmente en el sudeste asiático, seguido de una rápida propagación a muchos países. El aumento global de aislados resistentes a la cefixima está progresando y es motivo de preocupación porque este antibiótico se recomienda actualmente como dosis oral única para el tratamiento [30]. Otro problema es el aumento de la resistencia a la ceftriaxona. Debido al aumento de N. gonorrhoeae multirresistente, algunas directrices ya recomiendan una combinación de ceftriaxona intramuscular y azitromicina oral como primera elección en el tratamiento [30].
Para los detalles actuales sobre la terapia de la gonorrea, remitimos a las “Recomendaciones de la Comisión Federal para la Salud Sexual y la Sociedad Suiza de Infectología” actuales [13].
Diagnóstico de C. trachomatis – Recogida de muestras
Las clamidias son bacterias intracelulares obligadas, por lo que es importante que la muestra contenga tantas células como sea posible. Esto se consigue frotando la torunda al tomar la muestra [31].
Los lugares habituales para la recogida de muestras en las infecciones genitales sintomáticas por C. trachomatis son el endocérvix en las mujeres y la uretra en los hombres. Hoy en día también es posible obtener muestras menos invasivas, como un frotis vaginal en las mujeres y un frotis de orina a mitad del chorro o del meato uretral en los hombres, lo que aumenta la aceptación de la prueba por parte de los pacientes. La sensibilidad y especificidad de la detección por PCR de C. trachomatis en muestras recogidas de forma no invasiva son comparables a las muestras recogidas directamente del cuello uterino o la uretra [32]. Las muestras de orina de mujeres suelen ser menos adecuadas para la detección de C. trachomatis por PCR, ya que muestran una sensibilidad subóptima [29]. Los hisopos vaginales auto recogidos se describen en las recomendaciones de laboratorio de los CDC como muestras precisas y aceptables [33]. Para la detección de clamidia con PCR, el material debe procesarse transcurridas 48 horas como máximo [31]. La muestra puede transportarse a temperatura ambiente. Para una orientación detallada sobre la recogida óptima de muestras, consulte las “Recomendaciones de la Comisión Federal de Salud Sexual y la Sociedad Suiza de Infectología” [28].
La infección por los serotipos L1, L2 y L3 de C. trachomatis se asocia a una mayor patogenicidad y da lugar al cuadro clínico conocido como linfogranuloma venéreo (LGV). Las infecciones por LGV se producen principalmente en poblaciones de riesgo como los HSH. La detección tiene lugar en frotis rectales o uretrales, pus o material de punción de los ganglios linfáticos afectados.
Métodos de biología molecular
Como método de elección, la clamidia se detecta hoy en día con métodos de amplificación del ADN (PCR). La detección puede realizarse simultáneamente para C. trachomatis y N. gonorrhoeae con una sensibilidad y especificidad excelentes (véase más arriba). La importancia de un diagnóstico fiable y de la vigilancia epidemiológica se ilustra con el siguiente ejemplo: C. trachomatis tiene de 4 a 8 copias de un plásmido de 7500 nucleótidos de longitud. Por lo tanto, este plásmido es un objetivo muy atractivo para un método de detección por PCR, ya que se consigue una mayor sensibilidad diagnóstica gracias a las copias múltiples. Entre noviembre de 2005 y agosto de 2006, se produjo un descenso inesperado de la incidencia de C. trachomatis en una determinada región de Suecia [34]. La reducción del 25% de los casos diagnosticados se interpretó inicialmente como el éxito de las medidas de prevención. Sin embargo, esto fue en realidad el resultado de una alteración genética con una deleción de 377 pares de bases en dicho plásmido [34]. Como resultado, las pruebas PCR comerciales utilizadas con frecuencia dejaron de detectar las clamidias en el material de muestra. Esta variante denominada “sueca” o “escandinava” de C. trachomatis es frecuente en Suecia y ahora también puede encontrarse en otros países escandinavos [35]. Hasta ahora, sólo se ha informado de casos individuales en otros países. Los fabricantes de diagnósticos PCR han reaccionado rápidamente y han adaptado y mejorado los métodos de detección en consecuencia. La clamidia asociada al LGV puede determinarse mediante PCR para la detección de los serotipos específicos del LGV [36,37]. En un curso más grave de la enfermedad, por ejemplo con ganglios linfáticos agrandados, debe buscarse el LGV -especialmente en los HSH- y tratarse en consecuencia [38]. Al igual que ocurre con N. gonorhoeae, el ADN de las bacterias no viables puede permanecer detectable durante mucho tiempo en caso de infección por C. trachomatis, por lo que la PCR no debe repetirse antes de tres semanas [39].
Otros métodos de detección
La detección serológica de anticuerpos o un ELISA de antígeno de Chlamydia con una reacción de inmunofluorescencia apenas se utilizan en la rutina.
Posición de resistencia
Dado que la clamidia sólo puede cultivarse en cultivos celulares complejos y que esto sólo se hace en laboratorios especializados, no suele realizarse ninguna prueba de resistencia. El tratamiento de elección son los antibióticos con actividad intracelular como la doxiciclina y la azitromicina. Aún no se ha demostrado el desarrollo de resistencia en C. trachomatis [28]. Para las pautas de tratamiento de la infección por C. trachomatis, remitimos a las “Recomendaciones de la Comisión Federal para la Salud Sexual y la Sociedad Suiza de Infectología” [28].
Resumen
Las enfermedades de transmisión sexual como la N. gonorrhoeae y la C. trachomatis están experimentando actualmente un renacimiento -que se explica en parte por la disponibilidad y la sensibilidad de los modernos diagnósticos moleculares-, pero no exclusivamente. Especialmente en tiempos de creciente resistencia a los antibióticos en N. gonorrhoeae y clamidias particularmente virulentas (linfogranuloma venéreo), debe realizarse un diagnóstico rápido y fiable. Además de la detección diagnóstica molecular, también se recomiendan las pruebas de resistencia a los antibióticos basadas en cultivos para N. gonorrhoeae.
Mensajes para llevarse a casa
- Las enfermedades de transmisión sexual como N. gonorrhoeae y C. trachomatis están experimentando actualmente un renacimiento. Este aumento no puede explicarse exclusivamente por la disponibilidad y sensibilidad de los modernos diagnósticos moleculares.
- El aumento de la resistencia a los antibióticos en N. gonorrhoeae y la detección de clamidias especialmente virulentas (linfogranuloma venéreo) requieren diagnósticos rápidos y fiables.
- Además de la detección diagnóstica molecular, también se recomiendan las pruebas de resistencia a los antibióticos basadas en cultivos para N. gonorrhoeae.
Literatura:
- Oficina Federal de Salud Pública DÖG. VIH, sífilis, gonorrea y clamidiosis en Suiza en 2015: panorama epidemiológico. Boletín FOPH 2016; 46: 12-13.
- (ECDC) ECfDPaC. Infecciones de transmisión sexual en Europa 2013. Informe de vigilancia del ECDC 2015: 1-124.
- Dubourg G, Raoult D: Los retos de la profilaxis preexposición para las infecciones bacterianas de transmisión sexual. Microbiología clínica e infección: la publicación oficial de la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas 2016; 22 (9): 753-756.
- Unemo M, Bradshaw CS, et al: Infecciones de transmisión sexual: retos futuros. Lancet Infect Dis 2017; 17 (8): e235-e279.
- Oficina Federal de Salud Pública DÖG: Gonorrea en Suiza en 2015. Boletín FOPH 2016; 46: 27-30.
- Oficina Federal de Salud Pública DÖG: Clamidiosis en Suiza en 2015. Boletín FOPH 2016; 46: 32-33.
- Schmutz C, Burki D, et al.: Pruebas de detección de Chlamydia trachomatis: tendencias temporales de las tasas de positividad en el cantón de Basilea-Stadt, Suiza. Epidemiol Infect 2013; 141 (9): 1953-1964.
- Vogel U, Forsch M: Cocos aerobios gran negativos y anaerobios facultativos. En: Neumeister M, Geiss HK et al. (ed.) Diagnóstico microbiológico. Stuttgart, Nueva York: Thieme; 2009.
- Coorevits L, Vanscheeuwijck C, et al: Evaluación de Copan FLOQSwab para la detección molecular de Chlamydia trachomatis mediante PCR Abbott RealTime CT. Acta clinica
- Belgica 2015; 70 (6): 398-402.
- Jun JK, Lim MC, et al. Comparación de los hisopos vaginales SECOS y HÚMEDOS con las muestras cervicales en las pruebas de VPH Roche Cobas 4800 y VPH de alto riesgo Abbott RealTime. J Clin Virol 2016; 79: 80-84.
- Tan TY, Ng LS, et al.: Evaluación de la recuperación y viabilidad bacterianas a partir de tres sistemas diferentes de transporte de torundas. Patología 2014; 46 (3): 230-233.
- den Heijer CDJ, Hoebe C, et al: Una visión global de las pruebas y diagnósticos urogenitales, anorrectales y orofaríngeos de Neisseria gonorrhoeae entre diferentes proveedores de atención de ITS: un estudio transversal. BMC Infect Dis 2017; 17 (1): 290.
- Toutous Trellu L, Oertle D, et al: Gonorrea: nuevas recomendaciones sobre diagnóstico y tratamiento. Foro médico suizo 2014; 14 (20): 407-409.
- Ng LK, Martin IE: El diagnóstico de laboratorio de la Neisseria gonorrhoeae. The Canadian journal of infectious diseases & medical microbiology = Journal canadien des maladies infectieuses et de la microbiologie medicale / AMMI Canada 2005; 16 (1): 15-25.
- Mitchell M, Rane V, et al: La técnica de muestreo es importante para el aislamiento óptimo de la gonorrea faríngea. Sex Transm Infect 2013; 89 (7): 557-560.
- Wind CM, de Vries HJ, et al.: Combinación exitosa de diagnóstico mediante prueba de amplificación de ácido nucleico y cultivo diferido específico de Neisseria gonorrhoeae. Revista de microbiología clínica 2015; 53 (6): 1884-1890.
- Spence JM, Wright L, Clark VL: Mantenimiento en laboratorio de Neisseria gonorrhoeae. Protocolos actuales en microbiología 2008; Capítulo 4: Unidad 4A 1.
- Perry MD, Jones RN, Corden SA: ¿Es necesario realizar pruebas de confirmación de las muestras positivas a Neisseria gonorrhoeae en la prueba CT/NG Roche cobas 4800? Comparación de la prueba Roche cobas 4800 CT/NG con un ensayo dúplex opa/pap para la detección de N gonorrhoeae. Sex Transm Infect 2014; 90 (4): 303-308.
- Ursi D, Crucitti T, Smet H, Ieven M: Evaluación del ensayo Bio-Rad Dx CT/NG/MG(R) para la detección simultánea de Chlamydia trachomatis, Neisseria gonorrhoeae y Mycoplasma genitalium en orina. Revista europea de microbiología clínica y enfermedades infecciosas: publicación oficial de la Sociedad Europea de Microbiología Clínica 2016; 35 (7): 1159-1163.
- Wong KC, Ho BS, et al: Sistema PCR dúplex para la detección simultánea de Neisseria gonorrhoeae y Chlamydia trachomatis en muestras clínicas. Revista de patología clínica 1995; 48 (2): 101-104.
- Meyer T, Klos C y otros: Evaluación del rendimiento del
- Kit de prueba PelvoCheck CT/NG para la detección de Chlamydia trachomatis y Neisseria gonorrhoeae. BMJ open 2016; 6 (1): e009894.
- Low N, Unemo M, et al.: Diagnóstico molecular de la gonorrea: implicaciones para la resistencia a los antimicrobianos y la amenaza de la gonorrea intratable. PLoS medicine 2014; 11 (2): e1001598.
- Del Prete R, Ronga L et al: Detección e identificación simultáneas de patógenos de ITS mediante PCR multiplex en tiempo real en muestras del tracto genital en una zona seleccionada de Apulia, una región del sur de Italia. Infección 2017; 45 (4): 469-477.
- Fernández G, Martro E, et al.: Utilidad de un nuevo ensayo multiplex de PCR en tiempo real para el diagnóstico de las infecciones de transmisión sexual. Enferm Infecc Microbiol Clin 2016; 34(8): 471-476.
- Bissessor M, Whiley DM et al: La persistencia del ADN de Neisseria gonorrhoeae tras el tratamiento de la gonorrea faríngea y rectal está influida por la susceptibilidad a los antibióticos y la reinfección. Clin Infect Dis 2015; 60 (4): 557-563.
- Watchirs Smith LA, Hillman R et al: Pruebas en el punto de atención para el diagnóstico de la infección por Neisseria gonorrhoeae: una revisión sistemática de las características operativas y de rendimiento. Sex Transm Infect 2013; 89 (4): 320-326.
- Dierig A, Frei R, Egli A: La vía rápida para la identificación de microbios: espectrometría de masas de desorción/ionización láser asistida por matriz en tiempo de vuelo (MALDI-TOF MS). Pediatr Infect Dis J 2015; 34 (1): 97-99.
- Tarr P: Infecciones de transmisión sexual por Chlamydia trachomatis: Recomendaciones de la Comisión Federal para la Salud Sexual (FCSH) y la Sociedad Suiza de Infectología (SSI). Boletín FOPH 2017; 35: 8-14.
- Unemo M, Shipitsyna E, Domeika M: Eastern European S, Reproductive Health Network Antimicrobial Resistance G. Gonorrhoea surveillance, laboratory diagnosis and antimicrobial susceptibility testing of Neisseria gonorrhoeae in 11 countries of the eastern part of the WHO European region. APMIS: acta pathologica, microbiologica, et immunologica Scandinavica 2011; 119 (9): 643-649.
- Elias J, Frosch M, Vogel U: Neisseria. En: Jorgensen JH, ed. Manual de microbiología clínica. 11ª ed. Washington, DC: ASM Press; 2015: 635-651.
- Jacobs E: Micoplasma y bacterias intracelulares obligadas. En: Neumeister B, Geiss HK, BRaun RW, Kimmig P, eds. Diagnóstico microbiológico. Stuttgart, Nueva York: Thieme; 2009.
- Gaydos CA, Essig A, Vogel U: Chlamydaceae. En: Jorgensen JH, ed. Manual de micobiología clínica. 11ª ed. Washington: ASM Press; 2015: 1106-1121.
- Hobbs MM, van der Pol B et al. De los NIH: actas de un taller sobre la importancia de las muestras vaginales autoobtenidas para la detección de infecciones de transmisión sexual. Enfermedades de transmisión sexual 2008; 35 (1): 8-13.
- Ripa T, Nilsson P: Una variante de Chlamydia trachomatis con deleción en el plásmido críptico: implicaciones para el uso de las pruebas de diagnóstico PCR. Euro surveillance: bulletin Europeen sur les maladies transmissibles = Boletín europeo de enfermedades transmisibles 2006; 11 (11): E061109 2.
- Unemo M, Clarke IN: La nueva variante sueca de Chlamydia trachomatis. Curr Opin Infect Dis 2011; 24(1): 62-9.
- de Roche M, Sawatzki M et al: Linfogranuloma venéreo. Una vieja enfermedad con un vestido nuevo. Der Internist 2011; 52 (5): 584-589.
- Goldenberger D, Dutly F, Gebhardt M: Analysis of 721 Chlamydia trachomatis-positive urogenital specimens from men and women using lymphogranuloma venereum L2-specific real-time PCR assay. Euro surveillance: bulletin Europeen sur les maladies transmissibles = Boletín europeo de enfermedades transmisibles 2006; 11 (10): E061018 4.
- Stoner BP, Cohen SE: Linfogranuloma venéreo 2015: Presentación clínica, diagnóstico y tratamiento. Clin Infect Dis 2015; 61 (8): S865-873.
- Gaydos CA, Crotchfelt KA, et al: Ensayos de amplificación molecular para detectar infecciones clamidiales en muestras de orina de estudiantes femeninas de secundaria y para controlar la persistencia del ADN clamidial tras la terapia. J Infect Dis 1998; 177 (2): 417-424.
PRÁCTICA DERMATOLÓGICA 2017; 27(6): 22-28