La pérdida de la función renal puede provocar la acumulación de toxinas urémicas o cambios potencialmente mortales en el equilibrio electrolítico y de volumen. Esta evolución negativa puede contrarrestarse con diversos procedimientos de diálisis.
La insuficiencia renal aguda o crónica puede deberse a diversos factores. Si la pérdida de la función renal provoca una acumulación de toxinas urémicas o desviaciones de electrolitos y volumen que ponen en peligro la vida, se recurre a la diálisis como procedimiento de sustitución renal. La hemodiálisis (HD) se basa en el principio físico de la difusión, que elimina moléculas de moléculas pequeñas de la sangre a lo largo de su gradiente de concentración a través de una membrana semipermeable. La hemofiltración (HF), por su parte, se basa en la convección, que elimina el agua plasmática a través de la diferencia de presión transmembrana (ultrafiltrado) y elimina las moléculas disueltas en ella (“arrastre de disolvente”). La hemodiafiltración (HDF) combina los principios de difusión y convección.
Diálisis para la insuficiencia renal aguda
La insuficiencia renal aguda (IRA) es una de las complicaciones más frecuentes en los pacientes hospitalizados y se produce hasta en un 20% de los casos. Corren especial riesgo los pacientes críticos en cuidados intensivos con sepsis o cirugía mayor, los pacientes con insuficiencia renal preexistente y los que padecen enfermedades crónicas de otros órganos (por ejemplo, insuficiencia cardiaca o diabetes mellitus) [1]. La aparición de ANV es un factor pronóstico independiente; un aumento de la creatinina de 26,5 µmol/l ya se asocia a una duplicación de la mortalidad.
Las indicaciones para la diálisis de urgencia son las alteraciones electrolíticas potencialmente mortales, especialmente la hiperpotasemia (potasio >6,5 mmol/l y/o alteraciones del ECG), la sobrecarga de volumen (edema pulmonar), la acidosis metabólica grave (pH <7,1), complicaciones de la uremia (pericarditis) o intoxicaciones con sustancias dializables (por ejemplo, salicilatos, alcoholes). Las indicaciones relativas para la diálisis son los cambios electrolíticos refractarios y la sobrecarga de volumen o la hiperuricemia grave como ocurre en el síndrome de lisis tumoral (tab. 1).

Muchos estudios postulan que en los pacientes con NVA sin indicaciones de urgencia, el inicio precoz de la diálisis inmediatamente después del diagnóstico no aporta un beneficio significativo en cuanto a la supervivencia [2,3]. Pocos datos sugieren un beneficio del uso precoz de la diálisis [4]. Sin embargo, el retraso en la aparición puede ofrecer la posibilidad de una recuperación renal espontánea sin necesidad de recurrir a procedimientos de sustitución renal [2,3]. Debido a los datos controvertidos, las directrices KDIGO (“Kidney Disease: Improving Global Outcomes”) no recomiendan un tiempo concreto ni un umbral específico de creatinina o urea para el inicio de la diálisis [5].
La duración media de un procedimiento de diálisis en el contexto de una ANV es de 12-13 días [6]. Por ello, se recomienda un catéter central no tunelizado de doble luz, preferiblemente en la vena yugular derecha, como acceso temporal [5]. A diferencia de la diálisis ambulatoria para pacientes crónicos, también existen procedimientos de diálisis continua (más de 24 horas) para la ANV, además del tratamiento intermitente (de dos a cuatro horas cada 1-2 días). Las ventajas de la diálisis continua son la extracción más lenta y, por tanto, más respetuosa con la circulación del líquido y de las moléculas dializables. Las ventajas de la diálisis intermitente son la rápida eliminación de toxinas en casos de intoxicación y el tiempo limitado de tratamiento, que permite una mejor coordinación con el diagnóstico o las terapias intervencionistas. Es importante señalar que las dosis de medicación se adaptan a la modalidad respectiva. Esto es crucial para los antibióticos, por ejemplo.
Diversos estudios y metaanálisis no muestran diferencias significativas en la mortalidad o la duración de la estancia hospitalaria en pacientes en diálisis continua frente a intermitente. Curiosamente, sin embargo, se postula repetidamente una recuperación renal más rápida tras el uso de diálisis continua, aunque estudios recientes no lo confirman [7]. Por lo tanto, las recomendaciones KDIGO enumeran los métodos intermitentes y continuos como equivalentes. La diálisis continua sólo se recomienda en pacientes hemodinámicamente inestables y en aquellos con aumento de la presión intracraneal o edema cerebral [5].
Estimar la dosis de diálisis adecuada en el contexto de una ANV es complejo porque las condiciones metabólicas de los pacientes cambian a diario. La dosis óptima de diálisis de la hemodiálisis intermitente viene dada por el aclaramiento de urea (Kt/V = aclaramiento de urea × tiempo por volumen de distribución de urea); la KDIGO recomienda un Kt/V de 3,9 por semana para la ANV [5]. La intensidad de tratamiento de la diálisis continua, por otra parte, viene indicada por la tasa total de efluentes (tasa de ultrafiltrado y volumen de salida de dializado). Basándose en diversos estudios, se recomienda una tasa de descarga total de 20-25 ml/kg/h [5,6]. Una terapia más intensiva no conlleva ningún beneficio para la supervivencia ni una recuperación renal más rápida ni en diálisis intermitente ni en continua [6] e incluso es perjudicial en pacientes sépticos. Es importante prescribir una dosis más alta, ya que la dosis efectiva administrada puede desviarse hasta un 20% de la dosis objetivo debido a interrupciones en la terapia causadas, por ejemplo, por problemas de acceso o inestabilidad hemodinámica.
Así pues, en el contexto de una ANV, el contexto clínico, la enfermedad subyacente y la presencia de otras disfunciones orgánicas son cruciales para prescribir la diálisis adecuada para cada paciente en función de las circunstancias individuales.
Diálisis para la insuficiencia renal crónica
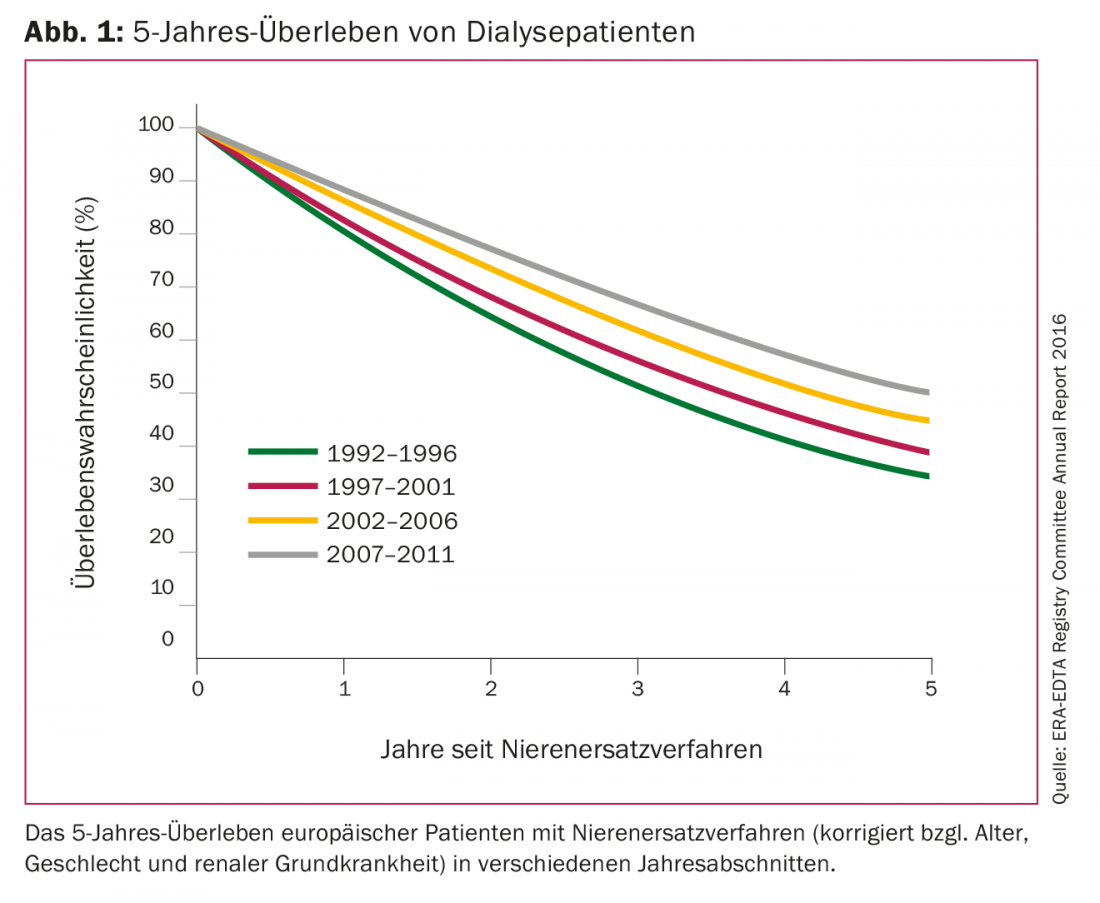
La mortalidad de los pacientes crónicos en diálisis es de diez a veinte veces superior a la de la población general emparejada por edad. Las enfermedades cardiovasculares se consideran la causa predominante de muerte. Según el Sistema de Datos Renales de Estados Unidos, la mortalidad a un año de los pacientes estadounidenses en diálisis en 2016 fue ligeramente inferior al 20%, cifras comparables a las de los tumores malignos. Entre los pacientes europeos en diálisis, la supervivencia a 5 años era de solo el 35% hace 25 años; en 2011 había aumentado a algo menos del 50%. (Fig. 1). Varios nuevos descubrimientos en el campo de la dosis óptima, la frecuencia y los procedimientos de diálisis, así como la biocompatibilidad de las membranas filtrantes y el desarrollo de la eritropoyetina recombinante han contribuido a esta mejora significativa de la supervivencia de los pacientes.
En el primer ensayo controlado aleatorio en nefrología, se investigó por primera vez en 1980 la dosis óptima de diálisis y se introdujo un Kt/V >1,0 por tratamiento como objetivo de dosis mínima [8]. Datos recientes confirman un aumento significativo de la mortalidad con un Kt/V <1,2 por diálisis [9] y refuerzan la asociación de una mejor supervivencia de los pacientes con una mayor dosis de diálisis. Sin embargo, el estudio de referencia HEMO no muestra ningún beneficio adicional para la supervivencia con un Kt/V >1,3 por tratamiento, aunque se han señalado algunas deficiencias en cuanto a la metodología utilizada en el estudio (población de estudio joven, efecto de arrastre) [10]. En resumen, actualmente se recomienda un Kt/V >1,2 por diálisis como la dosis de diálisis a la que debe aspirarse [11].
La terapia de diálisis estándar en todo el mundo comprende tres tratamientos a la semana, cada uno de tres a cinco horas de duración. La terapia más intensiva se define como ≥5 diálisis por semana, de duración corta (<3 horas), regular (3-5 horas) o larga (>5 horas) [11]. La Red de Hemodiálisis Frecuente (FHN) publicó tres ensayos aleatorios, cada uno de los cuales comparaba tratamientos intensivos (6×/semana de 1,5-3 horas; 6×/semana de >6 horas/noche; y 5-6×/semana de >6 horas/noche) con la frecuencia estándar. Todos mostraron una mejora significativa de la calidad de vida, una reducción de la hipertrofia ventricular izquierda y un mejor control de la hipertensión arterial y la hiperfosfatemia en las cohortes con un tratamiento más intensivo. Estos pacientes, por otra parte, tuvieron intervenciones más frecuentes del acceso vascular. Curiosamente, las observaciones a largo plazo muestran una ventaja de supervivencia sólo en las cohortes con diálisis diaria de duración regular. Sin embargo, hay que criticar los factores metodológicos que influyen en los estudios (escaso número de pacientes, baja potencia estadística). Una diálisis nocturna más intensiva acelera la pérdida de la función renal residual. Esto tiene una gran relevancia en los pacientes en diálisis, no sólo para la eliminación de moléculas pequeñas y medianas, sino también en términos de pronóstico [12]. Así pues, la diuresis residual es un parámetro crucial para una terapia de diálisis óptima. Basándose en esto, en los últimos años se ha desarrollado el concepto de diálisis incremental. Si aún se conserva la función residual, se inician primero uno o dos tratamientos por semana y se introduce la dosis estándar de tres veces por semana sólo cuando se alcanza el aclaramiento de urea <3 ml/min/1,73 m2 o la diuresis residual <600 ml/día [12]. Los pacientes con pocas comorbilidades, alteraciones electrolíticas leves y equilibrio de volumen compensado son los que tienen más probabilidades de beneficiarse de esta prescripción individualizada de diálisis.
El momento óptimo para iniciar un procedimiento de sustitución renal solía ser cuando se producía un descenso de la tasa de filtración glomerular (TFG) <15 ml/min/1,73 m2 y/o signos de uremia. Sin embargo, el estudio IDEAL no muestra ningún beneficio para la supervivencia del inicio precoz de la diálisis (TFG de 10-14 ml/min/1,73m2 frente a 5-7 ml/min/1,73 m2) [13], por lo que puede considerarse la posibilidad de esperar hasta un TFG de 7 ml/min/1,73 m2 y/o síntomas de uremia. Hay que prestar especial atención a los pacientes ancianos, que constituyen una proporción cada vez mayor de la población en diálisis. La calidad de vida no difiere entre el inicio temprano y tardío de la diálisis [13], pero el inicio de la diálisis en los ancianos conlleva un marcado aumento de la mortalidad y un rápido declive de la independencia [14].
Además, la hemodiafiltración (HDF en línea) se ha investigado cada vez más en los últimos años con la esperanza de mejorar la supervivencia de los pacientes en diálisis con una eliminación más eficaz de las moléculas de tamaño medio. Un análisis conjunto de cuatro ensayos prospectivos aleatorizados muestra una reducción significativa tanto de la mortalidad por cualquier causa como de la muerte cardiovascular en pacientes en diálisis con HDF frente a HD de alto flujo según [15]. Sin embargo, este efecto sólo es perceptible a partir de un volumen de convección de al menos 23 litros por tratamiento y es significativamente evidente tras la estandarización a toda la superficie corporal. Sin embargo, para alcanzar los altos volúmenes de convección, se requiere un flujo sanguíneo correspondiente (>300 ml/min) y un tiempo de diálisis más largo, lo que presupone un buen acceso vascular.
Además, el desarrollo de la eritropoyetina recombinante a finales de los años 80 es un avance revolucionario en el tratamiento de los pacientes en diálisis. Anteriormente, los pacientes en diálisis tenían regularmente niveles de hemoglobina bajos, de 60-80 g/l, que requerían transfusiones de sangre repetidas y se asociaban a los correspondientes riesgos de morbilidad. Con el uso de eritropoyetina recombinante, se observó en poco tiempo una mejora de los síntomas asociados a la anemia y de la calidad de vida, así como una reducción evidente de la necesidad de transfusión. Cuatro estudios de referencia investigaron el nivel objetivo de hemoglobina y su impacto en la mortalidad de los pacientes con insuficiencia renal crónica. En resumen, se observa un aumento de los acontecimientos tromboembólicos y de las muertes cardiovasculares cuando la hemoglobina se normaliza a ≥130 g/l. Así, las directrices más recientes recomiendan un nivel de hemoglobina de 110-115 g/l como objetivo para los pacientes en diálisis [16].
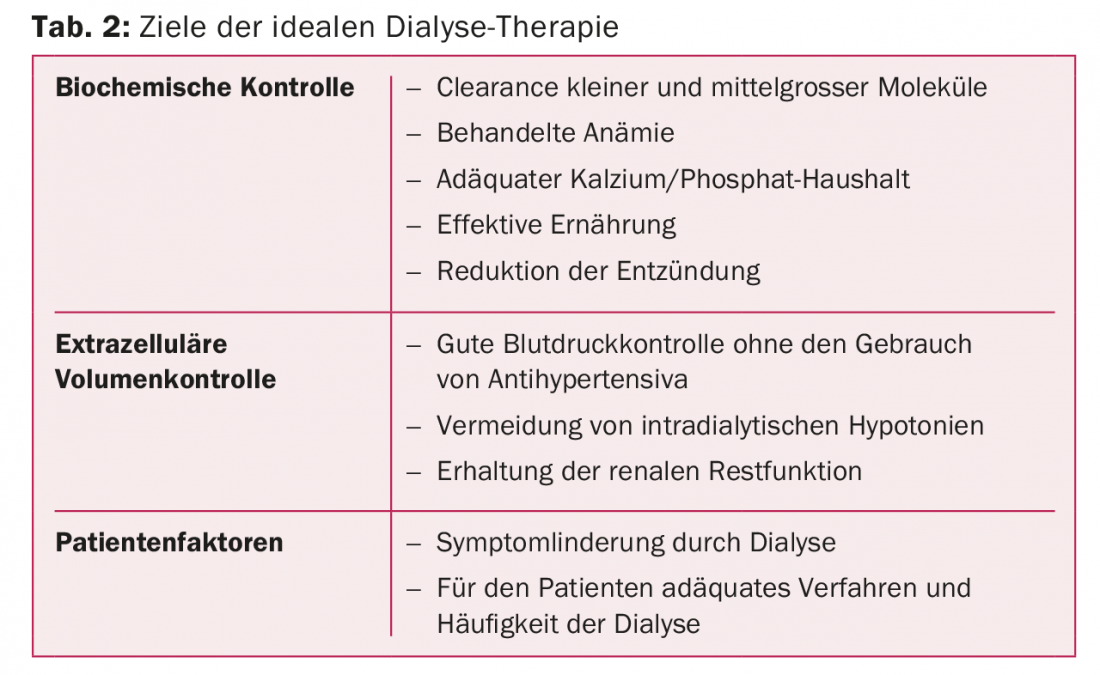
Por lo tanto, es crucial que se planifique y programe la diálisis adecuada de forma individual para cada paciente con el fin de mejorar su supervivencia sin perjudicar su calidad de vida. Las características de la diálisis ideal se enumeran en la tabla 2.
Mensajes para llevarse a casa
- En el contexto de la diálisis aguda, no existe ninguna ventaja de supervivencia para la diálisis intermitente frente a la continua. Se recomienda un procedimiento continuo en pacientes hemodinámicamente inestables y en aquellos con una presión intracraneal elevada.
- El inicio precoz de la diálisis no se asocia a una mejor supervivencia ni en la terapia de diálisis aguda ni en la crónica.
- La función residual renal es relevante desde el punto de vista pronóstico y permite una prescripción de diálisis diseñada individualmente.
- La ventaja de supervivencia de la hemodiafiltración sólo se observa en pacientes en diálisis crónica a partir de un volumen de convección de >23 litros por sesión.
Literatura:
- Rewa O, Bagshaw SM: Lesiones renales agudas: epidemiología, resultados y economía. Nat Rev Nephrol 2014; 10: 193-207.
- Gaudry S, et al: Estrategias de inicio de la terapia de sustitución renal en la unidad de cuidados intensivos. N Engl J Med 2016; 375: 122-133.
- Barbar SD, et al: Calendario del tratamiento de sustitución renal en pacientes con lesión renal aguda y sepsis. N Engl J Med 2018; 379: 1431-1442.
- Zarbock A, et al: Effect of early vs delayed initiation of renal replacement therapy on mortality in critically ill patients with acute kidney injury: the ELAIN Randomized Clinical Trial. JAMA 2016; 315(20): 2190-2199.
- Khwaja A: Guías de práctica clínica KDIGO para la lesión renal aguda. Nephron Clin Pract 2012; 120(4): c179-184.
- Palevsky PM, et al: Intensidad del soporte renal en pacientes críticos con lesión renal aguda. N Engl J Med 2008; 359: 7-20.
- Liang KV, et al: Modalidad de TRR y recuperación de la función renal tras una IRA en pacientes que sobreviven al alta hospitalaria. Clin J Am Soc Nephrol 2016; 11(1): 30-38.
- Lowrie EG, et al: Efecto de la prescripción de hemodiálisis sobre la morbilidad del paciente: informe del Estudio Nacional Cooperativo de Diálisis. N Engl J Med 1981; 305(20): 1176-1181.
- Port FK, et al: Estimaciones DOPPS de los años de vida de los pacientes atribuibles a prácticas de hemodiálisis modificables en Estados Unidos. Purificación de la sangre 2004; 22(1): 175-180.
- Eknoyan G, et al.: Efecto de la dosis de diálisis y del flujo de membrana en la hemodiálisis de mantenimiento. N Engl J Med 2002; 347: 2010-2019.
- Fundación Nacional del Riñón: Guía de práctica clínica de la KDOQI para la adecuación de la hemodiálisis: actualización de 2015. Am J Kidney Dis 2015; 66(5): 884-930.
- Obi Y, et al: Hemodiálisis incremental, función renal residual y riesgo de mortalidad en pacientes incidentes en diálisis: un estudio de cohortes. Am J Kidney Dis 2016; 68(2): 256-265.
- Cooper BA, et al: Un ensayo aleatorizado y controlado de la iniciación precoz frente a la tardía de la diálisis. N Engl J Med 2010; 363: 609-619.
- Kurella Tamura M, et al: Estado funcional de los adultos mayores antes y después del inicio de la diálisis. N Engl J Med 2009; 361(16): 1539-1547.
- Peters SA, et al: Hemodiafiltración y mortalidad en pacientes con enfermedad renal terminal: un análisis de datos agrupados de participantes individuales de cuatro ensayos controlados aleatorizados. Nephrol Dial Transplant 2016; 31(6): 978-984.
- Mejora de los resultados globales de las enfermedades renales (KDIGO): Guías de práctica clínica KDIGO para la anemia en la enfermedad renal crónica. Suplementos internacionales para el riñón 2012; 2(4).
Puede solicitar una lista completa de todas las fuentes utilizadas.
CARDIOVASC 2018; 17(6): 8-12











