La dosificación en pediatría supone un gran reto para los pediatras, ya que en muchos casos no se dispone de información vinculante. Éste es también el caso de la fitoterapia, ya que los datos vinculantes sólo pueden encontrarse con los correspondientes estudios clínicos, que casi nunca se llevan a cabo por razones éticas, o apenas se conceden permisos para ellos.
Fitoterapia adecuada para niños
La fitoterapia se ofrece como una forma de terapia adecuada para los niños por varias razones. Muchos medicamentos a base de plantas tienen un amplio margen terapéutico, por lo que el riesgo de sobredosis es muy pequeño en la mayoría de los casos. Debido a su efecto mayoritariamente suave, muchas plantas medicinales son adecuadas para aplicaciones pediátricas, ya sea como tratamiento único o como tratamiento adicional. Además, los medicamentos a base de plantas son muy adecuados para indicaciones que a menudo deben tratarse en niños, como enfermedades de las vías respiratorias, dolencias del tracto gastrointestinal, inquietud y trastornos del sueño, así como aplicaciones dermatológicas. Resulta muy ventajoso que los profesionales, como médicos y farmacéuticos, dispongan de información suficiente sobre la dosificación de los medicamentos a base de plantas para que puedan asesorar de forma óptima a los padres y utilizar de forma segura los medicamentos a base de plantas en las indicaciones adecuadas.
Conceptos básicos de dosificación
Para el cálculo de las dosis infantiles de medicamentos se utilizan fórmulas que intentan hacer justicia a la naturaleza del niño (Tab. 1). Existe poca bibliografía sobre la dosificación de medicamentos a base de plantas en niños [1–3]. Si en el prospecto de un medicamento figura información sobre la posología infantil, esta información es válida, por supuesto, ya que ha sido aprobada por Swissmedic. La tabla 2 enumera los medicamentos a base de plantas de la lista de especialidades (LS) para los que se indican dosis para niños en el prospecto.
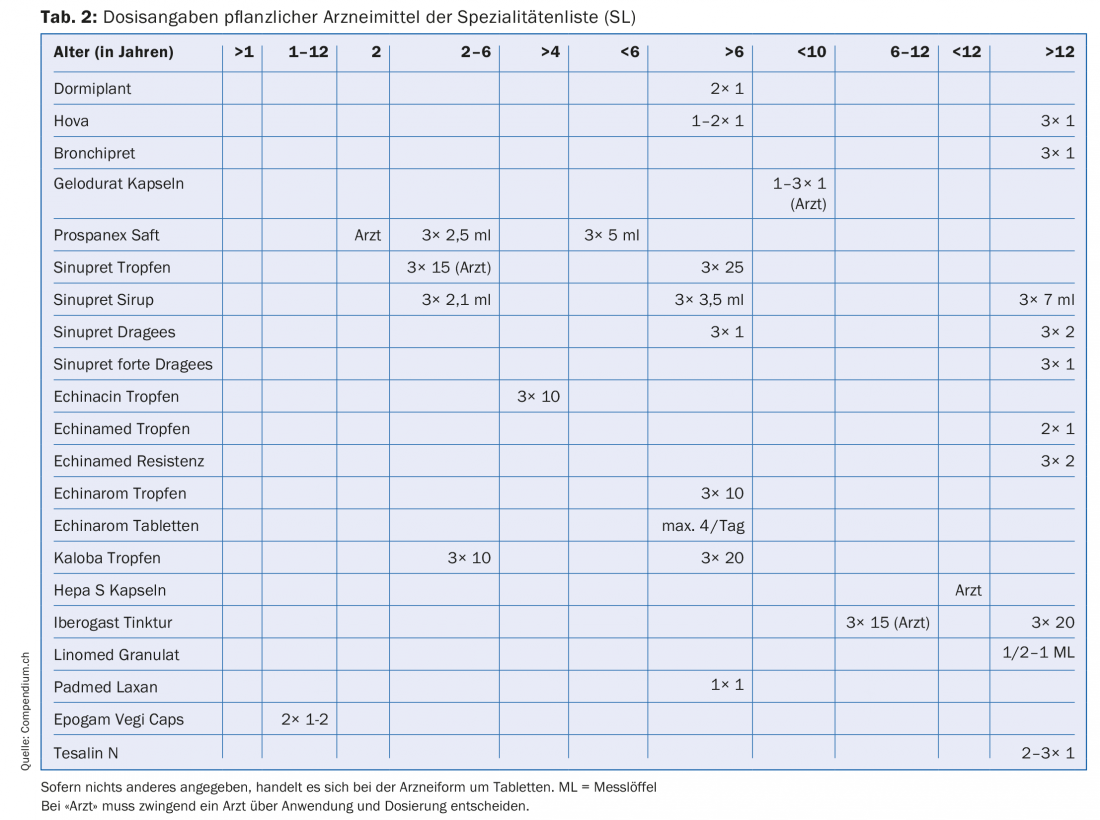
Las edades
La tabla 2 muestra que existen indicaciones de dosificación para grupos de edad bastante diferentes. La gama de grupos de edad va de >1 año a >12 años, con numerosos subgrupos intermedios.
Además, existe información para el paciente que obliga a ciertos grupos de edad a involucrar a un médico en relación con un uso planificado. Ex. Prospanex jarabe para la tos: en bebés menores de dos años, sólo un médico debe decidir el uso y la dosis. También hay medicamentos para los que la información al paciente da dosis para un determinado grupo de edad, pero sigue remitiendo al médico, que es el responsable último. Es el caso, por ejemplo, de las gotas Iberogast para niños de 6 a 12 años.
¿Por qué hay grupos de edad tan diferentes? Hay varias razones para ello.
Agencia Médica Europea (EMA)
La Agencia Médica Europea, la autoridad de registro de la Unión Europea con sede en Londres, estipula que cuando se autoriza por primera vez un medicamento, el fármaco en cuestión está contraindicado en niños y adolescentes menores de 12 años, a menos que el solicitante pueda aportar datos clínicos adecuados [4].
Así pues, si una empresa farmacéutica desea registrar los usos en niños como parte de una autorización de comercialización o de renovación de una autorización de comercialización de un medicamento, deberá presentar el denominado Plan de Investigación Pediátrica (PIP). Este documento, creado por la EMA, regula exactamente qué documentos y qué tipo de estudios son necesarios para una autorización de este tipo. Un PIP presentado es revisado por el Comité Pediátrico (PDCO), una organización de la EMA. El PDCO decide sobre la aprobación de las solicitudes de estos niños.
Conferencia Internacional sobre Armonización (ICH)
La Conferencia Internacional sobre Armonización de los Requisitos Técnicos para el Registro de Productos Farmacéuticos de Uso Humano, organización fundada en 1990, es la encargada de definir las clases de edad de los niños. Según su página web, su objetivo es lograr una mayor armonización en el desarrollo y registro de medicamentos eficaces y seguros en todo el mundo. Promueve el diálogo entre los fabricantes y las autoridades de registro. En las directrices “Investigación clínica de medicamentos en la población pediátrica” [5], aprobadas el 20 de julio de 2000, la ICH define los siguientes grupos de edad pediátrica:
- Recién nacido: 0-27 días
- Lactantes/niños pequeños: de 28 días a 23 meses
- Niños: 2-11 años
- Adolescentes: de 12 a 16-18 años
Esta clasificación se justifica por las diferencias en el desarrollo del sistema nervioso central (SNC), el sistema inmunitario, el aclaramiento renal y hepático y los cambios hormonales (adolescentes) de estos grupos de edad.
Aprobación sin PIP
Si una empresa farmacéutica desea obtener una recomendación de dosificación para uno o varios de estos grupos de edad para una indicación específica en el contexto de la autorización de comercialización de un medicamento, deberá presentar un PIP con la información correspondiente, como ya se ha mencionado. A menos que lo haga, o que se apruebe la información del PIP, la EMA declara que el uso de este medicamento está contraindicado para niños y adolescentes menores de 18 años. Es el caso, por ejemplo, del medicamento a base de plantas Kardionin, un preparado de Crataegus registrado desde 2013. Dado que el proveedor de cardionina no pudo o no quiso presentar documentación para su uso en niños, lo que es muy posible dada la indicación del fármaco, el prospecto sólo menciona el uso para adultos. >18 años de edad, así como la información “El uso y la seguridad del Kardionin en niños y adolescentes no se ha estudiado hasta el momento”.
Información divergente
En la lista de medicamentos a base de plantas que figura a continuación (Tab. 2), que incluye información sobre las dosis para niños, hay muchas indicaciones que no se corresponden con la clasificación por edades de la ICH, por ejemplo dosis para niños mayores de seis años o entre 2 y 6 años. Estas alegaciones pueden realizarse porque los medicamentos correspondientes fueron autorizados por la EMA y la ICH antes de la entrada en vigor de los reglamentos y se les permitió realizar las alegaciones correspondientes sobre la base de los reglamentos de entonces.
Resumen
Dado que los medicamentos a base de plantas son muy adecuados para su uso en pediatría, es importante que los profesionales dispongan de una base fiable para dosificar a los grupos de edad adecuados. En ausencia de tal información, pueden hacerse aproximaciones a las dosis apropiadas utilizando la superficie corporal, el peso o la edad del niño. Sin embargo, se trata de aproximaciones y deben manejarse con precaución. En el caso de un nuevo registro de un medicamento, es decir, también de un producto a base de plantas, el solicitante debe, de acuerdo con los reglamentos de la EMA y la ICH, proporcionar información precisa sobre la eficacia y la seguridad del medicamento, fundamentada con estudios clínicos, para que puedan hacerse las declaraciones correspondientes. Por lo demás, el fármaco está contraindicado en niños y adolescentes <18 años.
Literatura:
- Schicher H, Dorsch W: Fitoterapia en pediatría. Wissenschaftliche Verlagsgesellschaft Stuttgart 2006.
- Kooperation Phytopharmaka, Bonn: “Kinderdosierungen von Phytopharmaka” – 3ª edición revisada y ampliada 2002.
- von Mandach U, et al: Aplicación de los medicamentos a base de plantas en pediatría. Fitoterapia 2002(5); 2: 8-16.
- www.ema.europa.eu
- www.ich.org
PRÁCTICA GP 2017; 12(8): 2-4












