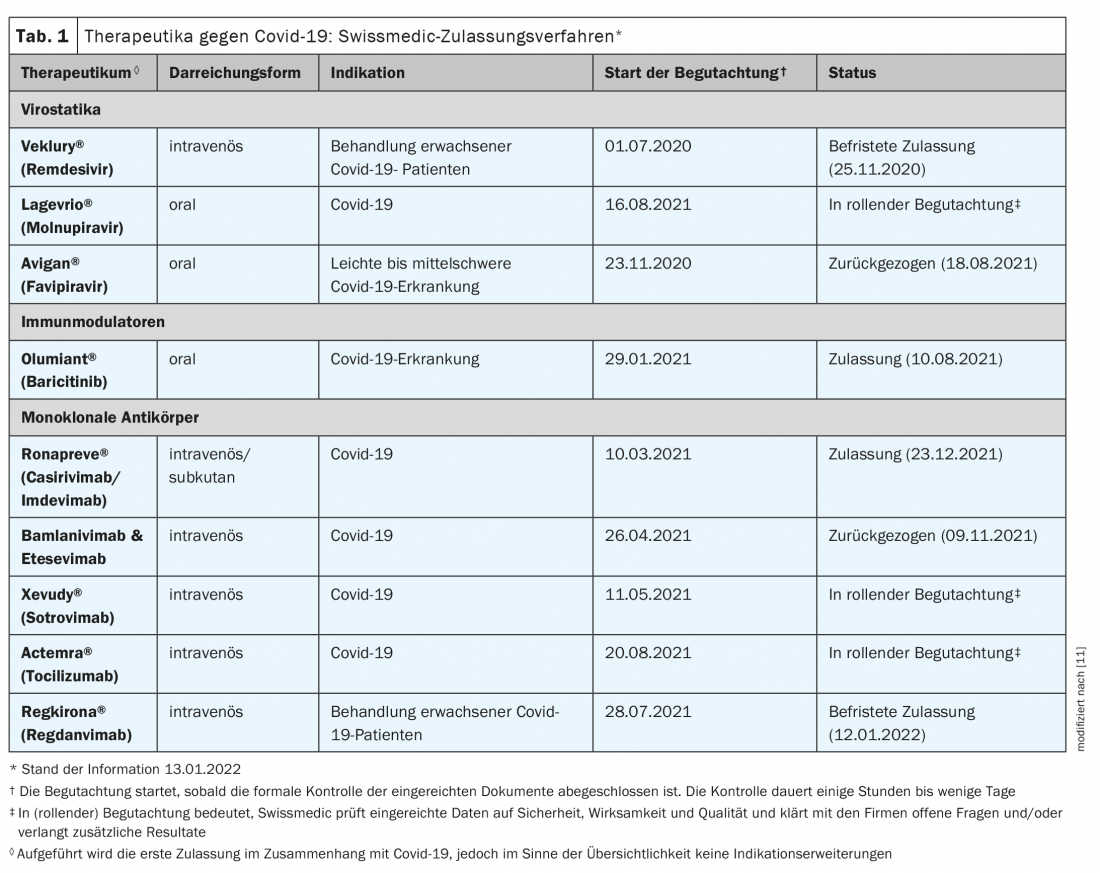
Los anticuerpos monoclonales casirivimab/imdevimab y sotrovimab recibieron la aprobación de Swissmedic el pasado diciembre y este enero, respectivamente. Pronto se lanzará en Suiza otro prometedor fármaco para el tratamiento de pacientes con Covid 19. El molnupiravir es un antiviral administrado por vía oral que debe utilizarse en la fase inicial de la sintomatología del covid 19, según muestran datos de ensayos recientes.
La vacunación es la herramienta más importante para la protección contra las infecciones, los cursos graves y las hospitalizaciones [1]. Sin embargo, para los que se infectan, es crucial una terapéutica segura y eficaz contra el covid-19. Los fármacos candidatos prometedores contribuyen en particular a reducir la necesidad de hospitalización y a contrarrestar los cursos graves en el hospital. Según las revisiones correspondientes, las tres categorías de fármacos siguientes cumplen estos criterios: anticuerpos monoclonales antivirales, sustancias orales antivirales e inmunomoduladores [1]. Mientras que los primeros tienen por objeto impedir que los virus entren o se multipliquen en las células del organismo, los inmunomoduladores se utilizan en las fases avanzadas de la enfermedad para amortiguar las reacciones de defensa del organismo [2]. La FOPH intercambia regularmente información con el grupo de trabajo científico sobre las terapias existentes y nuevas contra el covid-19. Las solicitudes de autorización de comercialización que Swissmedic está evaluando actualmente se muestran en la tabla 1 [3,15].
Primer medicamento oral para el tratamiento de pacientes ambulatorios
La Oficina Federal de Salud Pública ha firmado un contrato para la reserva del medicamento antivírico Molnupiravir (Lagevrio®) siguiendo la recomendación del grupo de trabajo científico Covid 19. El molnupiravir, que está disponible en forma de comprimidos, es un inhibidor de la ARN polimerasa y es uno de los agentes antivirales. El fármaco ya está aprobado en el Reino Unido desde noviembre de 2021, y en EE.UU. se solicitó una aprobación de emergencia en el mismo periodo [2]. En un ensayo clínico, se demostró la eficacia en pacientes covid-19 no hospitalizados con alto riesgo de progresión grave de la enfermedad, en los que la ventana temporal parece ser crítica para el éxito del tratamiento. [4,5] (Recuadro). El medicamento ya puede utilizarse en Suiza durante el actual procedimiento de autorización de comercialización tras una adaptación del Reglamento Covid 19 3, que aún debe llevarse a cabo (estado de la información: 15.01.2022). El gobierno federal cubrirá los costes del tratamiento en el sector ambulatorio hasta que sea reembolsado por el seguro médico obligatorio [3].

El sotrovimab y el casirivimab/imdevimab ya están aprobados oficialmente
Para Xevudy® (sotrovimab), la aprobación oficial de Swissmedic se concedió el 14.1.2022 y para Ronapreve® (casirivimab e imdevimab) el 23.12.2021 [6]. Ambos son anticuerpos monoclonales intravenosos indicados para adultos y adolescentes a partir de 12 años (peso corporal de al menos 40 kg) para el tratamiento del covid-19 cuando no se requiere oxigenoterapia ni hospitalización y existe un alto riesgo de desarrollar un curso grave de covid-19. Ronapreve® también está indicado -como único medicamento aprobado en Suiza hasta la fecha- para la prevención de la Covid-19 cuando no es posible una respuesta inmunitaria adecuada a la vacunación contra la Covid-19 debido a otras enfermedades o terapias. En el momento de su aprobación, sin embargo, no se disponía de información sobre la eficacia con la variante omicron [6].
Remdesivir – ¿Qué hay de nuevo?
Remdesivir (Veklury®) ya está disponible en Suiza desde 2020 para el tratamiento del covid-19. Ha habido y sigue habiendo un controvertido debate sobre los beneficios del principio activo desarrollado originalmente para tratar los virus del ébola. La publicación en diciembre de 2021 de los datos de un nuevo ensayo en el New England Journal of Medicine muestra que en los pacientes no hospitalizados con alto riesgo de progresión a covid-19, tres días de tratamiento con remdesivir se asocian a un menor riesgo de hospitalización o muerte en comparación con el placebo [7]. El estudio incluyó a pacientes no hospitalizados con covid-19 que habían experimentado síntomas en los últimos siete días y presentaban al menos un factor de riesgo de progresión de la enfermedad. Los pacientes fueron asignados aleatoriamente al tratamiento con remdesivir (n=279) o placebo (n=283). El remdesivir se administró por vía intravenosa a una dosis de 200 mg el día 1 y de 100 mg los días 2 y 3. Se produjeron hospitalizaciones o muertes relacionadas con el Covid-19 en dos pacientes del grupo remdesivir y en 15 del grupo placebo (0,7% frente a 5,3%; cociente de riesgos: 0,13). En el día 28, el 1,6% y el 8,3% de los pacientes de los grupos remdesivir y placebo, respectivamente, tuvieron una visita al médico relacionada con Covid 19 (cociente de riesgos: 0,19). No hubo muertes hasta el día 28. Se produjeron acontecimientos adversos en el 42,3% y el 46,3% de los pacientes de los grupos de verum y placebo, respectivamente.
¿Y qué hay del Paxlovid®?
Utilizado en una fase temprana de la enfermedad de Covid, este fármaco administrado por vía oral puede atenuar significativamente el curso de la enfermedad, según los hallazgos actuales. En los estudios, Paxlovid® (nirmatrelvir más ritonavir) redujo el riesgo de hospitalización y muerte en un 89% en pacientes adultos no hospitalizados de alto riesgo de covid 19 cuando se les trató con él durante cinco días en los tres días siguientes al inicio de los síntomas [8]. La Administración de Alimentos y Medicamentos de EE.UU. (FDA) concedió la aprobación de emergencia de Paxlovid® a finales de diciembre de 2021 para la indicación de pacientes con corona positiva mayores de 12 años con síntomas de leves a moderados y un alto riesgo de progresión grave [10]. La Agencia Europea del Medicamento (EMA) respalda el uso de Paxlovid® para el tratamiento de adultos con covid-19 que no requieran oxígeno suplementario y que presenten un mayor riesgo de progresión grave de la enfermedad [9].
Literatura:
- “Preguntas y respuestas sobre la lista de diez candidatos terapéuticos COVID-19”, 22.10.2021, https://ec.europa.eu (última consulta: 15.01.2022).
- “Fármacos terapéuticos contra la infección por coronavirus Covid-19”, 11.01.2022, www.vfa.de/de/arzneimittel-forschung (última consulta: 15.01.2022).
- “Coronavirus: la Confederación firma un contrato para reservar un medicamento”, www.bag.admin.ch, (última consulta: 15.01.2022)
- Jayk Bernal A, et al; Grupo de estudio MOVe-OUT. Molnupiravir para el tratamiento oral del Covid-19 en pacientes no hospitalizados. N Engl J Med. 2021 Dic 16: NEJMoa2116044.
- “Un estudio de fase 3 confirma la eficacia del molnupiravir en enfermos de COVID-19 no hospitalizados”, Sociedad Alemana de Neurología, 07.01.2022, https://dgn.org/neuronews (última consulta: 15.01.2022).
- “Swissmedic aprueba “Ronapreve(R)” para pacientes de Covid 19″. , 27.12.2021, www.swissmedic.ch (última consulta: 15.01.2022)
- Gottlieb RL, et al; Investigadores de GS-US-540-9012 (PINETREE). Remdesivir precoz para prevenir la progresión a Covid-19 grave en pacientes ambulatorios. N Engl J Med. 2021 dic 22. doi: 10.1056/NEJMoa2116846.
- “Un millón de envases del fármaco Covid 19 de Pfizer: el gobierno federal compra Paxlovid”, www.deutsche-apotheker-zeitung.de (última consulta: 15.01.2022)
- “La EMA apoya el uso de Paxlovid para emergencias”, www.aerzteblatt.de/, (última consulta: 15.01.2022)
- “Pfizer recibe la autorización de uso de emergencia de la FDA estadounidense para el novedoso tratamiento antiviral oral COVID-19”, www.pfizer.com/news (última consulta: 15 de enero de 2022).
- “Status of approvals for the control of Covid-19”, www.swissmedic.ch (última consulta: 15.01.2022)
- “BIO COVID-19 Therapeutic Development Tracker”, www.bio.org (última consulta: 15.01.2022).
- Whitley R: Molnupiravir – Un paso hacia las terapias biodisponibles por vía oral para el Covid-19. N Engl J Med. 2021 Dic 16: NEJMe2117814.
PRÁCTICA GP 2022; 17(1): 40-41
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2022; 4(1): 34-35
CARDIOVASC 2022; 21(1): 34-35












