Un primer conjugado anticuerpo-fármaco dirigido a BCMA para el tratamiento del mieloma múltiple en pacientes adultos muy pretratados que experimentaron una progresión de la enfermedad durante su última terapia está aprobado en Suiza desde junio de 2022 y está sujeto a la cobertura obligatoria del seguro desde noviembre de 2022 (1, 2). El tratamiento ambulatorio con monoterapia mostró una respuesta profunda y duradera y un perfil de seguridad manejable en el ensayo pivotal (3, 4).
El mieloma múltiple (MM), que pertenece a los linfomas de células B, constituye alrededor del 10 % de todas las neoplasias hematológicas (5). Las opciones de tratamiento existentes han permitido aumentar la supervivencia global (SG) de los pacientes con MM en los últimos años, pero la aparición de clones resistentes sigue conduciendo con frecuencia al fracaso del tratamiento. Con cada tratamiento posterior, la profundidad y la duración de la respuesta se reducen; una parte de los pacientes se vuelven refractarios a los inhibidores del proteasoma (IP), los inmunomoduladores (IMID) y los anticuerpos monoclonales. Estos pacientes tienen opciones de tratamiento limitadas y, con una mediana de SG de 5,6 meses, un mal pronóstico (6). Esto refleja la urgente necesidad de nuevas opciones terapéuticas con mecanismos de acción innovadores (6). En el ensayo pivotal DREAMM-2, el conjugado anticuerpo-fármaco dirigido a BCMA belantamab mafodotin (BLENREP) mostró una respuesta buena y duradera en pacientes muy pretratados y refractarios a múltiples tratamientos, especialmente en función del grado de pretratamiento (3, 4, 7).
Respuesta profunda y sostenida con BLENREP en el estudio DREAMM-2
En el ensayo multicéntrico, abierto y de dos brazos de fase II DREAMM-2, 97 pacientes cuya enfermedad era progresiva tras ≥3 líneas de tratamiento recibieron 2,5 mg/kg de BLENREP cada 3 semanas como monoterapia hasta la progresión de la enfermedad o toxicidad inaceptable (3, 4). La tasa de respuesta global (TRO), que fue evaluada por un comité independiente, fue el criterio de valoración principal y fue del 32% (31/97; IC del 97,5%: 21,7%-43,6%) tras una mediana de seguimiento de 13 meses(Fig. 1) (4). La mayoría (18/31; 58%) de estos respondedores se beneficiaron de una remisión parcial muy buena (VGPR*: n=11) o de una respuesta aún más profunda (CR*, sCR*; n=7). Los criterios de valoración secundarios incluyeron la mediana de la duración de la respuesta (mDOR; 11 meses [IC 95%: 4,2-NE]) y la mediana esperada de la SG (13,7 meses [IC 95%, 9,9 meses-no alcanzada]) en la población general hemo. La respuesta y la supervivencia de los pacientes con citogenética asociada al riesgo o insuficiencia renal fueron comparables a los resultados de la población general (4).
Seguimiento de los cambios corneales
Las reacciones adversas más frecuentes con 2,5 mg/kg de BLENREP fueron queratopatía (72%, gravedad ≥3 en el 46%) y trombocitopenia (38%, gravedad ≥3 en el 22%). Los efectos secundarios corneales provocaron el retraso del tratamiento en el 47% de los pacientes, pero su interrupción definitiva sólo en el 3%. Después de 13 meses, los cambios en la agudeza visual se habían resuelto en el 82% de los pacientes; no se observó ninguna pérdida de visión permanente (4). Para controlar los efectos secundarios, se realiza un examen oftalmológico antes de iniciar el tratamiento con BLENREP y antes de los tres primeros ciclos posteriores. Los pacientes también deben evitar las lentes de contacto y utilizar regularmente sustitutos lagrimales sin conservantes. En cuanto aparezcan efectos secundarios moderados en la córnea, ajuste la dosis de BLENREP o retrase el tratamiento (1). Aunque en este estudio se utilizaron con frecuencia modificaciones de la dosis (retrasos o reducciones) para el tratamiento de los efectos secundarios, su impacto en la respuesta fue mínimo en el BLENREP (4).
Conclusión
BLENREP está aprobado en Suiza desde junio de 2022 y las compañías de seguros médicos lo reembolsan desde noviembre de 2022 si se cumple el límite (1, 2). BLENREP está aprobado como monoterapia para el tratamiento del MM en pacientes adultos muy pretratados con al menos cuatro terapias previas que presentaron progresión de la enfermedad durante la última terapia y cuya enfermedad es refractaria al menos a un inhibidor del proteasoma, un inmunomodulador y un anticuerpo monoclonal anti-CD38 (1). Por tanto, los pacientes con un alto grado de pretratamiento en particular pueden beneficiarse ahora de esta nueva opción de tratamiento eficaz y tolerable.
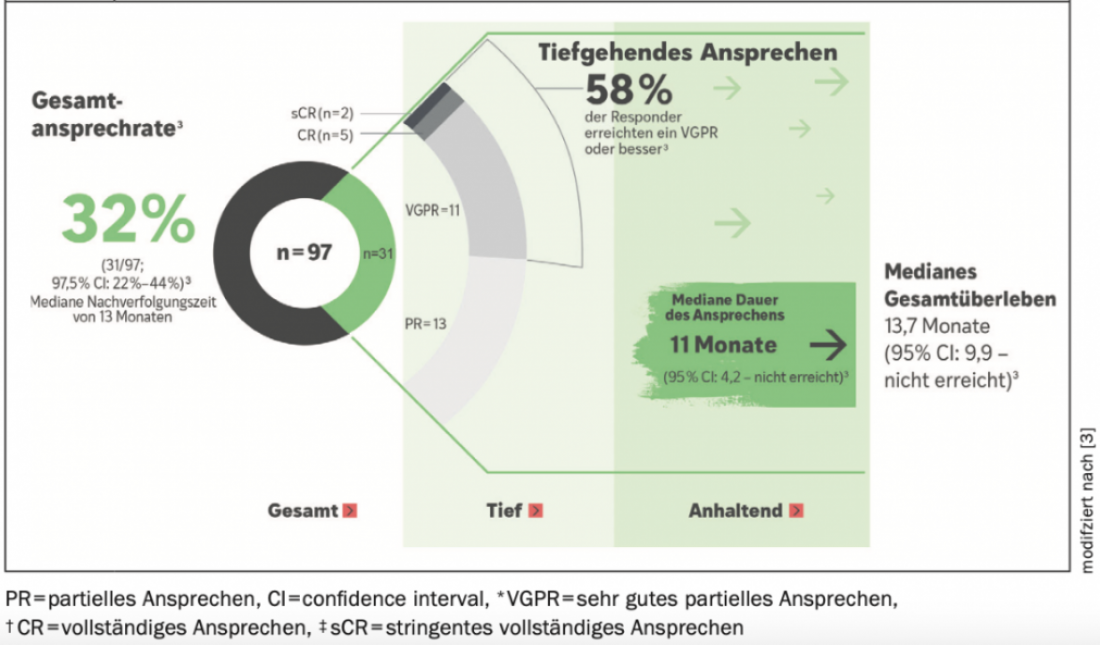
Figura 1: Tasas de respuesta, duración de la respuesta y supervivencia global en el ensayo DREAMM-2 de 2,5 mg/kg de BLENREP tras 13 meses de seguimiento. Adaptado de (4).
————-
°BCMA = antígeno de maduración de células B, proteína de superficie que se encuentra exclusivamente en células de mieloma y células plasmáticas
*VGPR = respuesta parcial muy buena; RC = respuesta completa; sCR = respuesta completa estricta
Más información
Publireportaje responsable y financiado por GlaxoSmithKline AG, Talstr. 3, CH-3053 Münchenbuchsee. Contacto: +41 31 862 21 11
Las marcas registradas pertenecen a sus respectivos propietarios. ©2022 Grupo de empresas GSK o su licenciante.
Breve información técnica BLENREP
PM-CH-BLM-ADVR-220029-11/2022
Literatura