En Suiza, la aprobación del biológico altamente eficaz Dupilumab en el área de indicación de la dermatitis atópica se ha limitado hasta ahora a pacientes adultos y adolescentes a partir de 12 años. El anticuerpo monoclonal convence con un alivio rápido y duradero de los síntomas y aumenta de forma demostrable la calidad de vida de los enfermos de neurodermatitis. En la UE, hace unos meses se concedió una ampliación de la indicación para el grupo de edad de 6 a 11 años basada en los estudios de fase III correspondientes. Que el dupilumab también es eficaz y seguro en niños en edad preescolar lo demuestran los datos publicados recientemente del estudio LIBERTY AD-PRESCHOOL.
Los pacientes con dermatitis atópica sufren una reducción considerable de su calidad de vida, especialmente cuando la enfermedad es grave. El picor insoportable es muy desagradable, puede provocar trastornos del sueño y, especialmente en niños y adolescentes, puede contribuir a las dificultades de concentración y aprendizaje. Además, los pacientes se sienten muy estigmatizados por los cambios visibles en la piel. El objetivo principal de la terapia es aliviar el picor y tratar los cambios inflamatorios de la piel. La terapia guiada se lleva a cabo de forma escalonada. La terapia sistémica se recomienda para el eccema persistente y grave que no responde adecuadamente a los agentes tópicos.
Para jóvenes de 12 a 17 años, régimen de dosificación adaptado al peso
El anticuerpo monoclonal dupilumab bloquea la transducción de señales de las interleucinas 4 y 13, cuya expresión se correlaciona con la actividad de la enfermedad en personas con dermatitis atópica. Dupilumab (Dupixent®) está disponible en la dosis prescrita como jeringa precargada y puede ser administrado por vía subcutánea por los propios pacientes tras instrucción médica [1]. Para adultos con dermatitis atópica de moderada a grave, Dupixent® está aprobado en Suiza desde 2019. En noviembre de 2020, Swissmedic concedió una ampliación de la indicación para adolescentes a partir de 12 años. Dupixent® está indicado cuando la terapia con medicamentos tópicos recetados no proporciona un control adecuado de la enfermedad o no es recomendable [1]. La condición para la cobertura de los costes por parte del seguro médico es la limitación de que un tratamiento con al menos un inmunosupresor convencional no haya logrado un efecto suficiente. En adultos, el dupilumab se administra a una dosis inicial de 600 mg (2× 300 mg) y después 300 mg a intervalos de dos semanas. En pacientes de 12 a 17 años, el intervalo de administración es también de dos semanas, y el régimen de dosificación se adapta al peso: en adolescentes con un peso corporal <60 kg, la dosis inicial es de 400 mg (2× 200 mg), seguida de 200 mg a intervalos de 2 semanas. En adolescentes con un peso corporal ≥60 kg, se recomienda una dosis inicial de 600 mg (2× 300 mg), seguida de 300 mg a intervalos de dos semanas [1].
Ya aprobado en la UE para niños de 6 a 11 años y
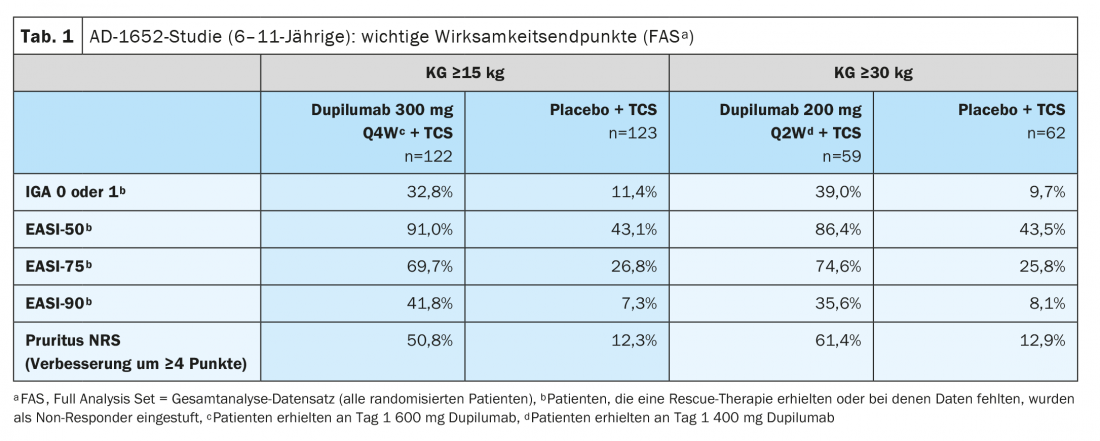
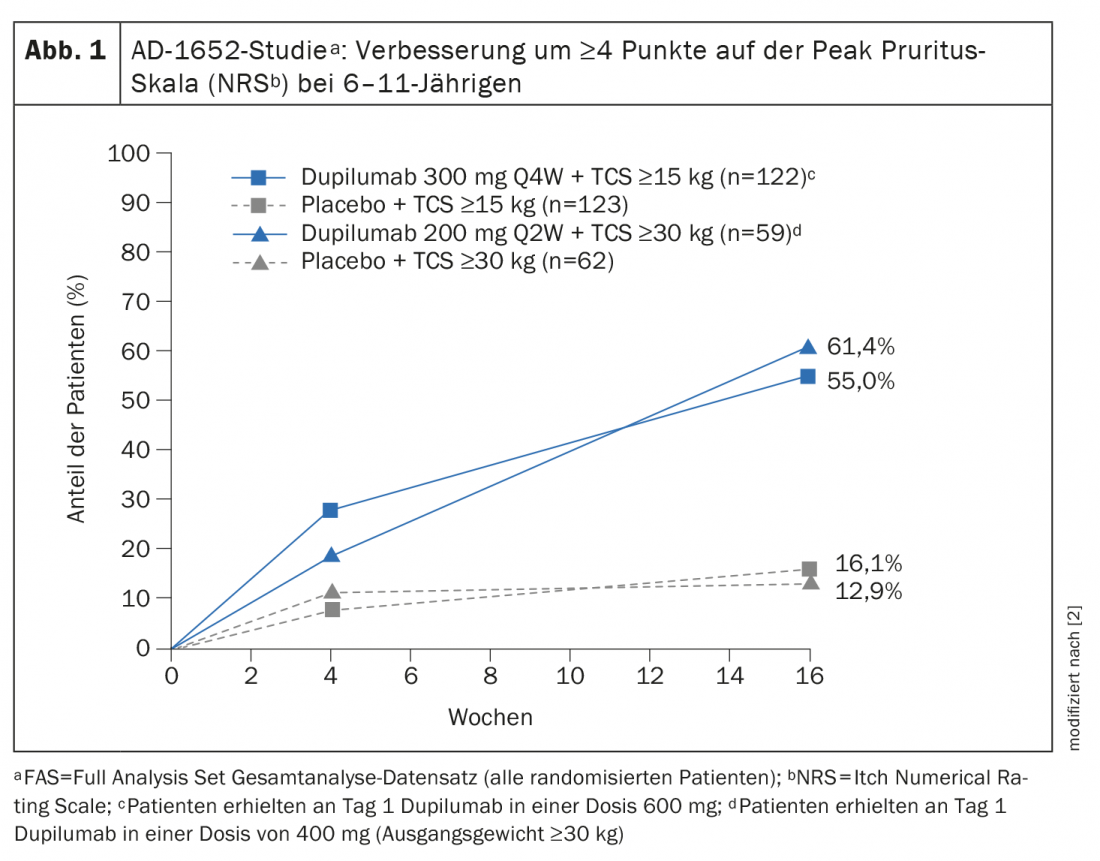
La Comisión Europea concedió una autorización de comercialización a dupilumab para niños a partir de 6 años en noviembre de 2020 [2,3]. La ampliación de la indicación se basa en los datos del estudio aleatorizado y doble ciego AD-1652, que investigó la eficacia y la seguridad de dupilumab en combinación con TCS en 367 pacientes de entre 6 y 11 años. Los resultados de los criterios de valoración de la eficacia importantes pueden verse en la tabla 1 [2]. El criterio de valoración coprincipal fue la proporción de pacientes con IGA* 0 ó 1 (sin apariencia o casi sin apariencia) con una mejora de ≥2 puntos y la proporción de pacientes con EASI-75 (mejora del EASI de al menos el 75%) entre el valor inicial y la semana 16. Los resultados estratificados según el peso inicial mostraron que para los participantes en el estudio con un KG de 15-29,9 kg tratados con dupilumab 300 mg Q4Wd#+ TCS, el 32,8% presentaba una piel sin apariencia o casi sin apariencia (IGA 0 ó 1), mientras que esta proporción fue del 11,4% en los participantes del estudio tratados con placebo más TCS. En los pacientes ≥30 kg que recibieron 200 mg de dupilumab cada quince días, este porcentaje llegó al 39,0% frente al 9,7%. El 69,7% y el 74,6% de los pacientes tratados con dupilumab lograron una mejora del 75% en el aspecto de la piel según el Índice de Área y Gravedad del Eccema (EASI-75), en comparación con el 26,8% y el 25,8% en los grupos de placebo. Dupilumab+TCS también demostró ser claramente superior a placebo+TCS en cuanto a la reducción de la SCORAD y la mejora de la NRS. Más de la mitad de los pacientes de los grupos de dupilumab lograron una mejora de ≥4 puntos en la NRS, mientras que en los grupos de placebo esta proporción fue del 12,9% o menos. 16,1% (Fig. 1).
* IGA = Evaluación Global del Investigador
#
Q4Wd = Intervalo de dosificación de 4 semanas
Pacientes de 6 meses a 5 años: nuevos datos prometedores
La dermatitis atópica suele comenzar entre el tercer y el sexto mes de vida, y el 60% de los pacientes enferman en el primer año de vida. Hacia el 5º año de vida , la enfermedad aparece en el 90% de los pacientes [4]. El estudio de fase III LIBERTY AD PRESCHOOL confirmó el perfil de eficacia y seguridad bien establecido de Dupixent® en otros grupos de edad en niños de 6 meses a 5 años con dermatitis atópica de moderada a grave. Se cumplieron todos los criterios de valoración primarios y secundarios. Los datos muestran que la adición de dupilumab al tratamiento estándar con corticosteroides tópicos (TCS) redujo significativamente la gravedad general de la enfermedad y mejoró el aclaramiento cutáneo, el picor y la calidad de vida relacionada con la salud al cabo de 16 semanas en comparación con los TCS solos. Durante el periodo de tratamiento de 16 semanas, la tasa global de acontecimientos adversos (AA) fue del 64% para el dupilumab y del 74% para el placebo. Los EAU más frecuentes incluyeron nasofaringitis (8% dupilumab, 9% placebo), infecciones de las vías respiratorias superiores (6% dupilumab, 8% placebo) y conjuntivitis (5% dupilumab, 0% placebo), infecciones por virus herpes (6% dupilumab, 5% placebo) y reacciones en el lugar de la inyección (2% dupilumab, 3% placebo). En resumen, los resultados de seguridad de este estudio fueron coherentes con el perfil de seguridad conocido del dupilumab en la dermatitis atópica.
Literatura:
- Breve información técnica: Dupixent®, www.swissmedicinfo.ch (última consulta: 19.11.2021)
- Agencia Europea de Medicamentos (EMA), www.ema.europa.eu/en/documents/product-information/dupixent-epar-product-information_de.pdf (última consulta: 19.11.2021)
- “Dupixent® (dupilumab) aprobado por la Comisión Europea como primer y único medicamento biológico para niños de 6 a 11 años con dermatitis atópica grave”, Sanofi, 30.11.2021
- Barbarot S, et al: Epidemiología de la dermatitis atópica en adultos: resultados de una encuesta internacional. Alergia 2018; 73(6): 1284-1293.
PRÁCTICA DERMATOLÓGICA 2021; 31(6): 41-42