La inhibición de la coagulación es una piedra angular importante de la terapia del síndrome coronario agudo. Los inhibidores de la agregación plaquetaria dirigidos contra la síntesis de tromboxano, el receptor ADP, el receptor de glicoproteína IIb/IIIa y el receptor de trombina PAR 1 se utilizan clínicamente con este fin, junto con los inhibidores de la coagulación plasmática. Los representantes más potentes de las sustancias individuales, así como su combinación, prometen una mayor eficacia antitrombótica, pero es posible que haya que sopesarlos con el riesgo de hemorragia de forma individual.
El camino desde la primera descripción de la angina de pecho por John Warren como “estrangulamiento del pecho” en la primera edición del New England Journal of Medicine en 1812 [1] hasta la comprensión actual de la cardiopatía coronaria a nivel genético y molecular ha estado jalonado de grandes descubrimientos, innovaciones y destacados avances terapéuticos.
Mientras que hasta 1961 los pacientes con SCA tenían que descansar lo menos posible y morían en un 30% de los casos, hoy en día se les vigila continuamente en las unidades de cuidados coronarios, lo que unido a la ampliación de las opciones de intervención terapéutica ha permitido reducir la mortalidad hospitalaria al 6-7%.
Además de la cirugía de bypass aortocoronario, que celebró su 50 aniversario en 2014, las opciones de intervención terapéutica incluyen la intervención coronaria percutánea (ICP), que fue lanzada en 1977 por Andreas Grüntzig en Zúrich. En la actualidad es una de las intervenciones más comunes en la medicina moderna [2], con unas tasas anuales de implantación de unos 500.000 stents liberadores de fármacos (DES) de segunda generación en Estados Unidos [3]. Dado el mecanismo patogénicamente esencial de la formación local de trombos, la terapia anticoagulante es de suma importancia. Se compone de la inhibición de la hemostasia primaria y de la coagulación plasmática. La inhibición terapéutica de la adhesión/activación y agregación plaquetaria se produce mediante la inhibición de la síntesis de tromboxano, el bloqueo del receptor ADP y la inhibición del receptor GP IIb/IIIa. La inhibición de varios factores de la cascada de coagulación garantiza la anticoagulación plasmática, que en el caso de la ICP se aplica mediante heparina, heparinas de bajo peso molecular e inhibidores selectivos de factores específicos (bivalirudina para la inhibición de la trombina; fondaparinux para la inhibición de FXa mediada por antitrombina).
En esta revisión se analizarán los mecanismos de acción y las indicaciones de uso de los antiagregantes plaquetarios que se utilizan en la actualidad. En aras de la claridad, la igualmente importante anticoagulación en la ICP no se trata aquí y puede leerse sobre ella en otro lugar [4,5].
Fisiología plaquetaria
Las plaquetas son células anucleares responsables de la hemostasia primaria a través de la adhesión, agregación, secreción e interacción con los factores de coagulación. La lesión de la integridad vascular con exposición de la matriz subendotelial provoca la activación inmediata de las plaquetas. Esto está mediado inicialmente por el contacto de las plaquetas circulantes con el colágeno, el factor von Willebrand y el fibrinógeno a través de los receptores de glicoproteínas VI, Ib y IIb/IIIa, y se ve reforzado por la secreción de, entre otros, tromboxano y ADP en el sentido de un bucle de retroalimentación positiva. El receptor heterodimérico de glicoproteínas GP IIb/IIIa, que está presente en gran número (aprox. 80.000/P) y tiene una menor afinidad por sus ligandos en las plaquetas en reposo, sufre un cambio conformacional a través de mecanismos de señalización intracelular que conduce a una exposición del sitio de unión para ligandos como el fibrinógeno, el FvW y la fibronectina. Esto media la agregación plaquetaria y la adhesión firme.
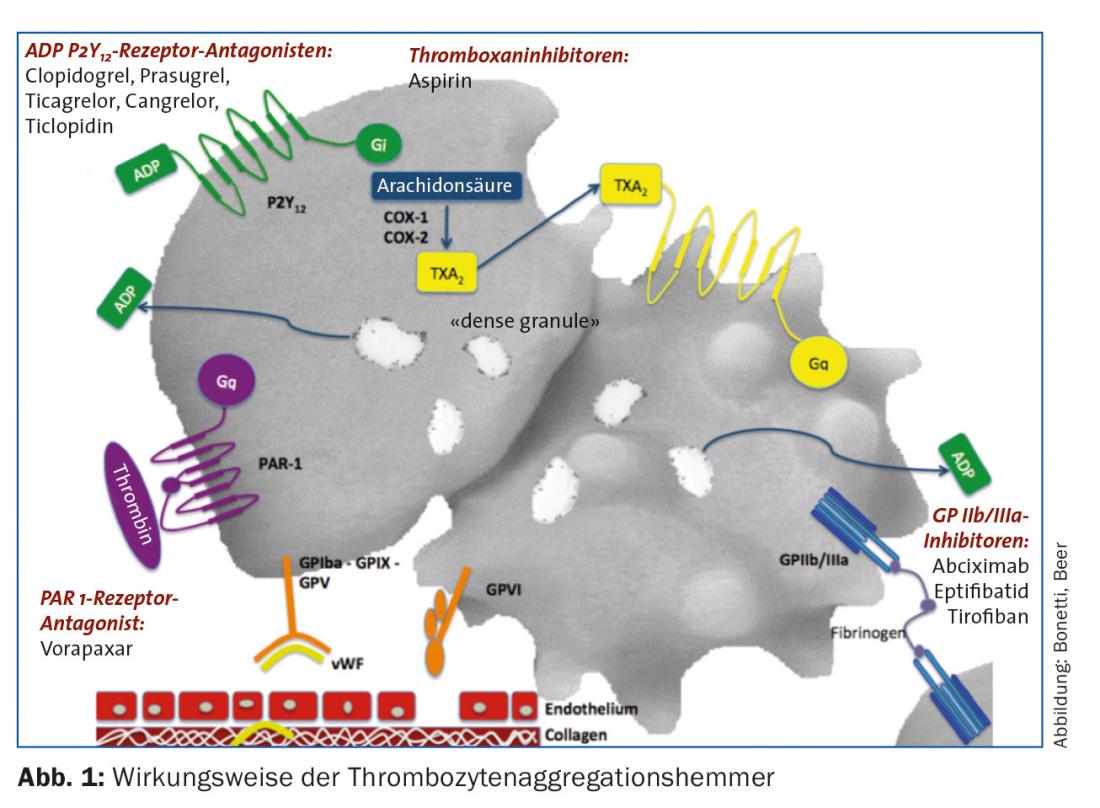
En el contexto del síndrome coronario agudo, este proceso puede interrumpirse terapéuticamente en los siguientes puntos (Fig. 1):
- Inhibición de la síntesis de tromboxano (el ácido acetilsalicílico [ASS] inhibe la ciclooxigenasa)
- Inhibición del receptor ADP P2Y12 (irreversible: clopidogrel, prasugrel; reversible: ticagrelor, cangrelor [de acción extremadamente corta, adecuado para puentes]).
- Inhibición del receptor GP IIb/IIIa (abciximab, eptifibatida, tirofibán)
- Inhibición del receptor de trombina (vorapaxar)
A continuación se ofrece una visión general de cada una de las sustancias y sus mecanismos de acción.
Aspirina
La aspirina inhibe de forma irreversible la ciclooxigenasa 1 (COX-1) y, por tanto, la síntesis de tromboxano A2. Este efecto persiste durante toda la vida de la plaqueta (diez días, regla empírica: 10% de Tc “fresco” diario). Se ha demostrado la eficacia de la aspirina en pacientes con angina de pecho inestable (AP). Cuatro ensayos controlados aleatorizados de la era anterior a la ICP mostraron una reducción del 51% en la tasa de infarto de miocardio, así como en la mortalidad [6–9]. Un metaanálisis de estos estudios mostró una reducción del 46% en el odds ratio de complicaciones vasculares en esta población de pacientes tras dos años de tratamiento con aspirina.
En cuanto a la dosificación, el ensayo CURRENT-OASIS 7, que estudió a unos 25.000 pacientes con SCA, no mostró diferencias en los resultados entre una dosificación más alta (300-325 mg) y una más baja (75-100 mg). De hecho, los efectos antiagregantes ya están saturados a una dosis en torno a 30-75 mg en estado estacionario, mientras que los efectos secundarios gastrointestinales y las tasas de hemorragia aumentan de forma dependiente de la dosis (incluso en el rango de dosis más bajo). En Suiza, se recomienda en consecuencia una dosis estándar de 100 mg en prevención primaria y secundaria. La prevención primaria, por otro lado, sólo se recomienda a pacientes mayores de 50 años con un perfil de riesgo significativamente mayor [4]. Deben utilizarse herramientas estandarizadas como la puntuación de riesgo de Framingham y las directrices AGLA para la estratificación del riesgo.
Inhibidores P2Y12
Clopidogrel: El clopidogrel (300-600 mg dosis de carga y 75 mg/día dosis de mantenimiento) requiere la oxidación por el sistema hepático del citocromo P450 para su conversión al metabolito activo. En este proceso, alrededor del 85% del profármaco es hidrolizado por las esterasas en una forma inactiva. El metabolito activo inactiva de forma selectiva e irreversible el receptor P2Y12, impidiendo la activación plaquetaria mediada por ADP. Aunque la terapia antiagregante dual con aspirina y clopidogrel reduce la tasa de acontecimientos isquémicos tras la ICP [10–11], hasta un 10% de los pacientes que reciben esta terapia combinada experimentan una recurrencia isquémica en el primer año, con una tasa de trombosis del stent de hasta el 2% [12]. Se responsabiliza de ello a la variabilidad interindividual, en parte grande, de la reactividad plaquetaria, debida a la biodisponibilidad variable. Farmacogenéticamente, esto se debe en gran parte a variantes de “pérdida de función” en el alelo CYP 2C19 y especialmente C19*2. Los pacientes con esta mutación tienen niveles más bajos del metabolito activo y, en consecuencia, una menor inhibición de la agregación plaquetaria. Aunque las pruebas genéticas rápidas para esta mutación están ahora más disponibles, la EMA y la FDA desaconsejan su uso no selectivo. Las pruebas genéticas y el análisis de la función plaquetaria deben reservarse para los pacientes con estado post-trombosis de stent en tratamiento, alto riesgo de hemorragia y stents en vasos críticos (por ejemplo, tronco principal izquierdo).
Las interacciones con los IBP, especialmente el omeprazol y el esomeprazol, han sido ampliamente descritas. Aunque las interacciones farmacodinámicas se consideran relativamente seguras, no se ha podido confirmar con certeza su relevancia clínica. En general, los IBP no deben prescribirse automáticamente ni siquiera en pacientes con doble antiagregación, sino que deben administrarse a los grupos de riesgo con estado posterior a una hemorragia digestiva, anticoagulación concomitante, en tratamiento con esteroides o AINE, edad avanzada (>65 años) o con infección por H. pylori. En el caso de una terapia IBP necesaria, los estudios farmacodinámicos hablan a favor del uso de sustancias más nuevas (por ejemplo, el pantoprazol).
Prasugrel: El prasugrel (60 mg dosis de carga, 10 mg/día dosis de mantenimiento) es un inhibidor irreversible del receptor P2Y12 con un inicio de acción más rápido y un efecto más potente que el clopidogrel. En el ensayo TRITON-TIMI 38, aproximadamente 10.000 pacientes con SCA (IAMCEST o IAMSEST) e ICP planificada fueron tratados con clopidogrel o prasugrel, iniciados durante o después de la intervención [13]. Después de 15 meses, los episodios cardiovasculares recurrentes se redujeron significativamente en el grupo de prasugrel (del 11,2% al 9,3%; riesgo relativo [RR] 0,82; p=0,002). En concreto, el riesgo de infarto de miocardio fue significativamente menor con prasugrel (reducción del riesgo relativo del 23,9%). Sin embargo, esto se produjo al precio de una tasa significativamente mayor de hemorragias graves y mortales (2,4% frente a 1,8%; HR 1,4; p=0,02). En vista de la tasa significativamente inferior de trombosis del stent (1,13% frente a 2,35%; HR 0,48; p<0,0001), el prasugrel debería considerarse especialmente en pacientes con trombosis del stent tratados con clopidogrel. En pacientes sometidos a ICP por SCA (IAMCEST o IAMSEST), el prasugrel es preferible al clopidogrel en ausencia de contraindicaciones apropiadas. Entre ellos se incluye el estado posterior a IVC o AIT, ya que existe un perfil beneficio-riesgo desfavorable para este grupo. Del mismo modo, debe evitarse su prescripción en personas mayores de 75 años y en pacientes con pesos corporales bajos de <60 kg. Si a pesar de todo se considera necesario, la terapia de mantenimiento debe administrarse a una dosis reducida de 5 mg/día.
Ticagrelor: El ticagrelor es un inhibidor reversible del P2Y12 que también inhibe la recaptación de ADP a través del ENT-1 (transportador equilibrante de nucleósidos). La semivida plasmática es de 6-12 h. La dosis de carga es de 180 mg, seguida de una dosis de mantenimiento de 2× 90 mg/día. Al igual que el prasugrel, el ticagrelor tiene un inicio de acción acelerado y más predecible en comparación con el clopidogrel y una regeneración más rápida de la función plaquetaria tras su interrupción. Los metabolitos del sistema CYP3A4, como la simvastatina, aumentan sus niveles plasmáticos con el ticagrelor, mientras que los inhibidores del CYP3A4 (por ejemplo, el diltiazem) aumentan los niveles de ticagrelor. En el ensayo PLATO, unos 18.000 pacientes con SCA fueron tratados con clopidogrel o ticagrelor [14]. Después de 12 meses, se observó una reducción significativa del criterio de valoración primario de infarto de miocardio, muerte vascular e ictus con ticagrelor (9,8% frente a 11,7%; HR 0,84; p=0,001). La tasa de mortalidad no vascular también se redujo significativamente en el grupo de ticagrelor (4% frente a 5,1%; p=0,001). La frecuencia de hemorragias graves no relacionadas con el BACG fue significativamente mayor con ticagrelor (4,5% frente a 3,8%; p=0,03). La tasa global de hemorragias mortales no difirió significativamente entre los grupos, aunque la tasa de hemorragias intracraneales mortales aumentó significativamente con el ticagrelor (0,1% frente a 0,001%; p=0,02). El ticagrelor se asoció más a efectos secundarios comunes como la disnea sin correlato morfológico (13,8% frente a 7,8%), las pausas ventriculares y la hiperuricemia asintomática. Al igual que el prasugrel, el ticargrelor es preferible a la terapia con clopidogrel tras un SCA (1B).
Cangrelor: El cangrelor es un análogo del ATP que se administra por vía intravenosa y se une de forma reversible al receptor P2Y12 con gran afinidad. La semivida plasmática es muy corta, de diez minutos. Ejerce una potente inhibición de la activación plaquetaria dependiente del ADP y permite una rápida recuperación de la función del CT tan pronto como una o dos horas después de interrumpir la infusión. Tres ensayos a gran escala compararon el cangrelor -iniciado antes de la ICP- con el clopidogrel administrado antes/después de la ICP o según la práctica local (CHAMPION-PCI; CHAMPION-PLATFORM; CHAMPION-PHOENIX). Un metaanálisis [15] demostró una reducción del 19% en el riesgo relativo de mortalidad periprocedimiento, infarto de miocardio, revascularización del vaso diana y trombosis del stent con cangrelor. El riesgo relativo de trombosis del stent por sí solo se redujo incluso en un 39%. Esto volvió a producirse al precio de una tasa de hemorragias significativamente mayor (cangrelor 0,9% frente a clopidogrel 0,6%; OR 1,38; p=0,007). El cangrelor está aprobado como complemento de la ICP en pacientes sin tratamiento previo con inhibidores de P2Y12 y sin bloqueo de los receptores GP IIb/IIIa.
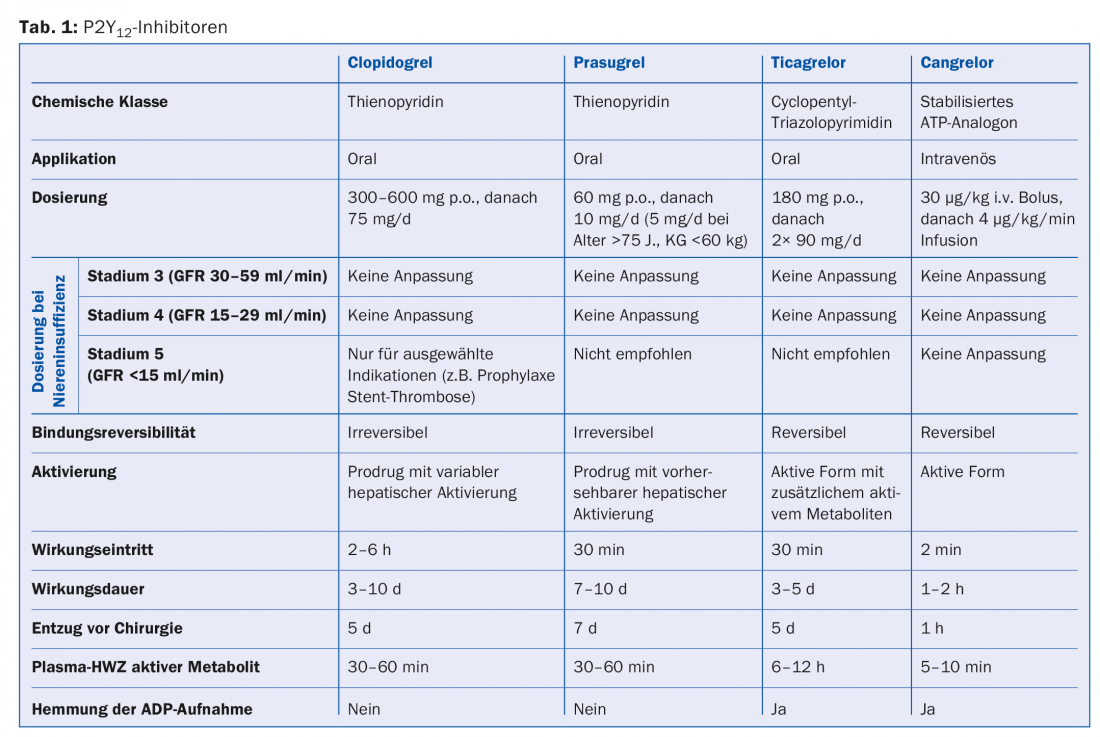
La tabla 1 ofrece una visión general de los inhibidores P2Y12 en uso.
Inhibidores de los receptores GP IIb/IIIa
Abciximab, eptifibatida, tirofibán: Los inhibidores de la GP IIb/IIIa aplicados por vía intravenosa inhiben la agregación al bloquear la unión del fibrinógeno a los receptores GP IIb/IIIa activados en las plaquetas adyacentes. Un metaanálisis de seis ensayos clínicos aleatorizados con más de 29 000 pacientes mostró una reducción del 9% del riesgo relativo de muerte e infarto de miocardio no mortal al añadir inhibidores de la GP IIb/IIIa al tratamiento con heparina [16]. El efecto positivo fue mayor en los pacientes que se sometieron a una ICP. Se observó que el riesgo de hemorragia grave pero no intracraneal aumentaba significativamente. Cabe señalar aquí que la mayoría de los estudios precedieron al uso generalizado de los inhibidores de P2Y12 y que las combinaciones con prasugrel y ticagrelor nunca se estudiaron de forma prospectiva. En consecuencia, los inhibidores de la GP IIb/IIIa en combinación con estos fármacos y también en pacientes con anticoagulación oral deben reservarse únicamente para situaciones de emergencia. En caso de deterioro de la función renal con una TFG <50 ml/min, el eptifibatide requiere un ajuste de la dosis, mientras que esto sólo está indicado para el tirofibán a partir de una TFG de <30 ml/min y, en el caso del abciximab, los fabricantes recomiendan considerar detenidamente la relación riesgo-beneficio. Para una TFG de 15-30 ml/min sólo está aprobado el tirofiban, por debajo de esa cifra se desaconseja el uso de todas las sustancias.
Antagonista del receptor PAR 1
Vorapaxar: Vorapaxar es un inhibidor selectivo activo por vía oral del receptor de trombina plaquetaria PAR 1. En el ensayo TRACER, se comparó vorapaxar con placebo además de la terapia estándar en casi 13 000 pacientes con IAMSEST. No hubo reducción del criterio de valoración primario de muerte cardiovascular, IM, IVC, isquemia de repetición o revascularización de repetición con vorapaxar (18,5% frente a 19,9%; HR 0,92; p=0,07). Por otro lado, se produjeron hemorragias intracraneales y significativamente más graves con vorapaxar (7,2% frente a 5,2%; HR 1,35; p<0,001). En el ensayo TRA 2P-TIMI 50, se comparó vorapaxar con placebo además de la terapia estándar en algo más de 24 000 pacientes con IM st. n., IVC st. n. o PAVK. Aquí, el vorapaxar se asoció a una reducción moderada de la muerte cardiovascular, el IM y la IVC a lo largo de tres años (9,3% frente a 10,5%; HR 0,87; p=0,001). Esto, a su vez, se produjo a costa de un aumento significativo de las tasas de hemorragia intracraneal (1% frente a 0,5%; p<0,001). En consecuencia, el fármaco está contraindicado en pacientes con enfermedad cerebrovascular. En EE.UU., el vorapaxar ha sido aprobado para la prevención secundaria del IM, aunque el beneficio moderado debe sopesarse cuidadosamente frente al mayor riesgo de hemorragia.
Inhibición de la agregación plaquetaria tras la ICP: uso según los escenarios clínicos
Aunque la inhibición de la agregación plaquetaria es la terapia estándar para la enfermedad aterosclerótica, la duración y la intensidad varían según la urgencia de la enfermedad. A continuación se analizan diferentes escenarios; la tabla 2 ofrece una visión general.
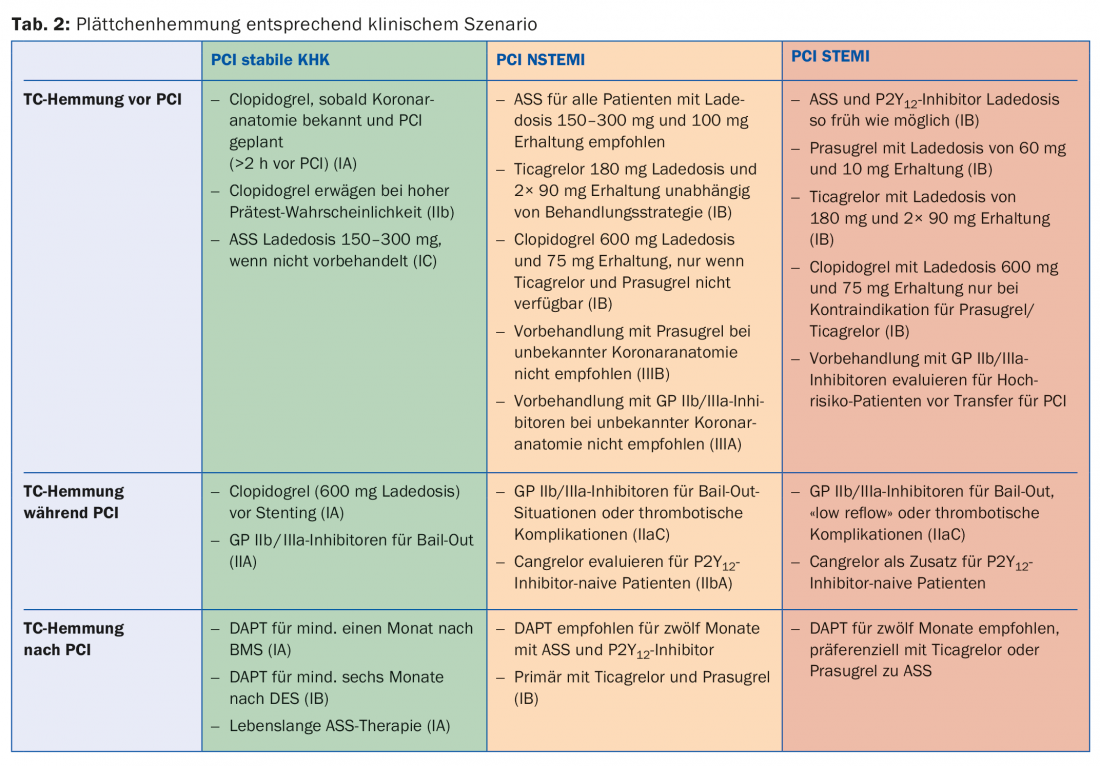
Enfermedad arterial coronaria estable (EAC): En general se recomienda utilizar un abordaje radial y preferiblemente la última generación de SLF para la ICP (1A). El tratamiento antiagregante plaquetario doble (TAPD) en el SCAD tras la ICP suele consistir en aspirina y clopidogrel. Lo ideal sería que todos los pacientes con SCAD o sospecha de SCAD recibieran un tratamiento previo con aspirina 100 mg. Si no es el caso, debe aplicarse una dosis de carga oral de 150-300 mg antes de la ICP electiva. No existen pruebas para el tratamiento previo con clopidogrel antes de una ICP puramente diagnóstica. Sin embargo, si ya se conoce la anatomía coronaria y se planifica la revascularización en consecuencia, se recomienda una dosis de carga de clopidogrel de 600 mg al menos dos horas antes de la ICP. En pacientes aún no pretratados, se recomienda una dosis de carga de 600 mg de clopidogrel durante la ICP una vez que se haya establecido la indicación de colocación de stent. El uso de antagonistas de la GP IIb/IIIa en el marco de una ICP debe reservarse para situaciones de emergencia (por ejemplo, trombosis coronaria inminente) en el SCAD. Tras la ICP, se recomienda un DAPT con clopidogrel 75 mg/día y aspirina 100 mg/día durante un mes tras la implantación de un BMS (1A) y durante seis meses tras la implantación de un DES (1B). A partir de entonces, la monoterapia generalmente con aspirina debe continuarse de forma óptima de por vida (1A). Se ha demostrado que las circunstancias de la interrupción son importantes para el desarrollo de complicaciones coronarias tras la suspensión de la antiagregación dual. En el 50% de los casos, el aborto fue prescrito por un médico y no provocó un mayor riesgo de acontecimientos adversos. En el 14% de los casos en los que la hemorragia o el mal cumplimiento provocaron la interrupción, el número de complicaciones cardiacas relevantes aumentó sustancialmente, aunque este efecto disminuyó a los 30 días [17]. Por ello, es importante informar e instruir bien a los pacientes.
IAMSEST: El DAPT tras un IAMSEST consiste en aspirina y un inhibidor de P2Y12, preferiblemente ticagrelor o prasugrel (1B). La aspirina se recomienda para todos los pacientes con una dosis de carga de 150-300 mg p.o. (o 80-150 mg i.v.) en pacientes sin aspirina, seguida de una dosis de mantenimiento a largo plazo de 100 mg/día. Se combina un inhibidor de P2Y12 con aspirina durante, por lo general, 12 meses (1A). Se recomienda el ticagrelor con una dosis de carga de 180 mg seguida de una dosis de mantenimiento de 2× 90 mg/día para todos los pacientes con un riesgo de isquemia de moderado a alto, independientemente de la estrategia de tratamiento inicial. Esto no excluye a los pacientes que han sido pretratados con clopidogrel, que debe suspenderse con ticagrelor. Se recomienda el uso de prasugrel con una dosis de carga de 60 mg seguida de una dosis de mantenimiento de 10 mg/día en pacientes con anatomía coronaria conocida que vayan a someterse definitivamente a una ICP. El clopidogrel (dosis de carga de 300-600 mg seguida de 75 mg/día) sólo debe utilizarse en pacientes con contraindicaciones para el ticagrelor o el prasugrel y en tratamiento con anticoagulantes orales. Los inhibidores de la GP IIb/IIIa durante la ICP pueden utilizarse en caso de complicaciones trombóticas o en las denominadas situaciones de rescate (“operaciones de salvamento”, por ejemplo, en caso de trombo grande, flujo lento o ausencia de flujo). El cangrelor puede considerarse un agente antiplaquetario adyuvante en pacientes sin bloqueo previo de P2Y12 y estimados de alto riesgo. Aunque el DAPT se recomienda generalmente durante doce meses, la duración puede acortarse de tres a seis meses o ampliarse hasta 30 meses (IIA) en pacientes seleccionados, en función de su riesgo individual de hemorragia e isquemia [4]. Para facilitar la toma de decisiones, la AHA recomienda el uso de la puntuación DAPT en las directrices actuales (Tab. 3). Esto se diseñó en el estudio DAPT y se validó en el estudio PROTECT. Una puntuación de -2 a 1 indica los pacientes cuyo riesgo de hemorragia se multiplica por 2,5 en comparación con el efecto protector antiisquémico y que, en consecuencia, tienen más probabilidades de no beneficiarse de un DAPT prolongado. A su vez, los pacientes con una puntuación de >2 experimentan un beneficio ocho veces mayor de la isquemia evitada en comparación con el riesgo de hemorragia y tienen más probabilidades de beneficiarse [18].

IAMCEST: Los pacientes con IAMCEST sometidos a ICP primaria deben recibir lo antes posible un TAPD con aspirina y un inhibidor de P2Y12, además de anticoagulación parenteral (IA). Se recomienda la aspirina con una dosis de carga de 300 mg p.o. para todos los pacientes independientemente del posible tratamiento previo para asegurar el bloqueo total de la síntesis de TXA2. Se recomienda la monoterapia de por vida con 100 mg/día en ausencia de contraindicaciones. Por lo general, debe combinarse un inhibidor de P2Y12 con aspirina durante 12 meses tras un IAMCEST (IA). El prasugrel y el ticagrelor (IB) vuelven a ser generalmente preferibles en este caso, después de que un análisis conjunto de unos 48.000 pacientes demostrara una ventaja de supervivencia sin un aumento significativo de las tasas de hemorragia en pacientes con IAMCEST bajo estas sustancias [19]. Es importante recordar que los inhibidores de P2Y12 más nuevos y potentes deben evitarse en caso de accidente cerebrovascular (hemorrágico) o de insuficiencia hepática de moderada a grave. También faltan datos sobre la combinación con (D)ROBLE, que debería evitarse. En este caso, o incluso si no se dispone de las sustancias, se sigue utilizando clopidogrel con 600 mg de carga y 75 mg/día de dosis de mantenimiento (IB). El uso de inhibidores de la GP IIb/IIIa durante la ICP parece adecuado en caso de trombo grande, flujo lento o ausente, o complicaciones trombóticas (CII) y se utiliza habitualmente a nivel internacional, aunque no existen grandes ensayos aleatorizados. La llamada aplicación “aguas arriba” (es decir, ya antes de la ICP) de los inhibidores de la GP IIb/IIIa es controvertida, aunque puede considerarse en pacientes de alto riesgo que aún necesitan ser trasladados primero (IIB). El cangrelor puede utilizarse como puente/suplemento a la ICP en pacientes sin tratamiento previo con inhibidores de P2Y12 y sin inhibidores de GP IIb/IIIa adicionales según la práctica local.
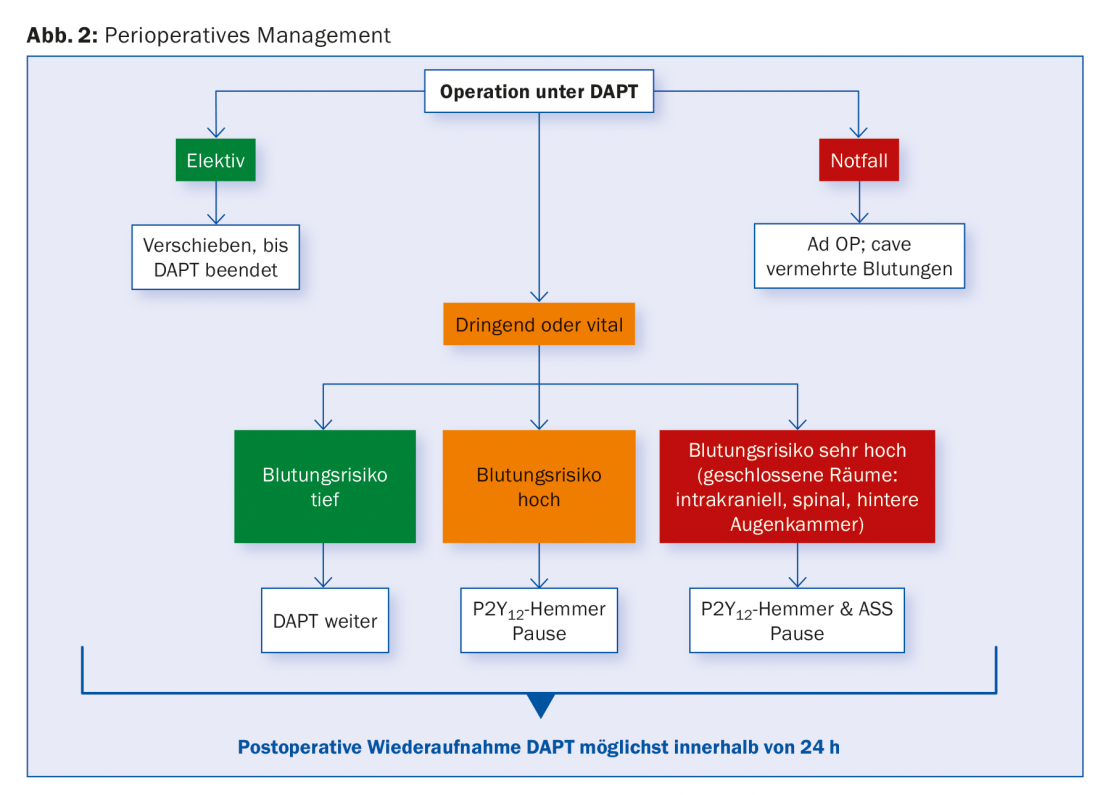
Cirugía bajo DAPT
Para los pacientes con SCAD, el DAPT se recomienda de uno a seis meses, dependiendo del tipo de stent, y generalmente durante doce meses para los stents después de un SCA.
No es infrecuente que durante este periodo surja la necesidad de una intervención quirúrgica, ya sea de revascularización quirúrgica (CABG) o de naturaleza no cardiaca. También en este caso la gestión depende del riesgo individual de hemorragia e isquemia y debe discutirse de forma interdisciplinar. Para los procedimientos con bajo riesgo de hemorragia, debe procurarse la continuación del DAPT. Si esto no es posible, al menos debe dejarse la aspirina en su lugar. Los datos de un gran estudio de cohortes mostraron que el riesgo de complicaciones cardiacas relevantes tras la cirugía aumentaba especialmente en los primeros seis meses tras la ICP. No se encontraron diferencias entre los tipos de endoprótesis.
Lo ideal sería posponer las intervenciones quirúrgicas electivas hasta que se haya completado la duración recomendada del DAPT. Para los procedimientos urgentes que requieran una interrupción, se recomienda pausar clopidogrel y ticagrelor durante cinco días, y prasugrel durante siete días antes, mientras se continúa con AAS. Los datos de pacientes sometidos a CABG sugieren que las mediciones de la reactividad del CT permiten determinar un tiempo quirúrgico seguro y pueden acortar la pausa en un 50%. Esta sería una posible alternativa a una ruptura arbitraria.
En los pacientes de alto riesgo, por ejemplo en los primeros días y semanas tras la colocación del stent, a veces se sugiere la antiagregación intravenosa en puente con inhibidores de la GP IIb/IIIa hasta cuatro horas antes del procedimiento, aunque no existen datos clínicos prospectivos al respecto. El cangrelor se estudió en el ensayo BRIDGE para puentear a CABG en pacientes pretratados con inhibidor de P2Y12. El cangrelor dio lugar a una antiagregación mejor conservada sin un aumento de la frecuencia de las hemorragias [20]. Ninguna de las sustancias ha recibido aún la aprobación oficial en este ámbito. Sustituir un DAPT por HBPM o HNF no tiene sentido. En el postoperatorio, se recomienda reanudar todos los inhibidores de P2Y12 lo antes posible. La figura 2 ofrece una visión general.
Conclusión
La anticoagulación es un principio clave en el tratamiento de la enfermedad coronaria. Varios inhibidores plaquetarios e inhibidores de la coagulación plasmática son de uso clínico diario. Las áreas de aplicación y las opciones de combinación se están ampliando, como el uso de dosis bajas de rivaroxaban tras un SCA además del DAPT. El éxito clínico de los preparados individuales y sus combinaciones viene determinado en última instancia por si la mayor eficacia antitrombótica mejora realmente el pronóstico sin que el posible beneficio se vea contrarrestado por un aumento de las tasas de hemorragia. Dada la prevalencia de la enfermedad y su gran repercusión en las estadísticas de las principales causas de muerte -y esto ya no se limita al mundo occidental-, es importante que los clínicos estén familiarizados con las distintas sustancias, sus indicaciones, ventajas e inconvenientes, con el fin de seguir la estrategia óptima para una población de pacientes cada vez más compleja.
Literatura:
- Warren J: Observaciones sobre la angina de pecho. N Engl J Med Surg 1812; 1: 1-11.
- Stefanini G, et al: Stents coronarios liberadores de fármacos. N Engl J Med 2013; 368: 254-265.
- Roger VL, et al: Estadísticas sobre enfermedades cardiacas e ictus – Actualización de 2012: un informe de la Asociación Americana del Corazón. Circulation 2012; 125(22): e1002.
- El Grupo de Trabajo sobre Revascularización Miocárdica de la Sociedad Europea de Cardiología (ESC) y la Asociación Europea de Cirugía Cardio-Torácica (EACTS): Directrices ESC/EACTS 2014 sobre revascularización miocárdica. Revista Europea del Corazón 2014; 35: 2541-2619.
- Bonetti N, Beer JH: NOAK update – una pequeña guía de viaje a través de un paisaje en movimiento. Practice Dispatch 2016; 12-19.
- Grupo RISC: Riesgo de infarto de miocardio y muerte durante el tratamiento con dosis bajas de aspirina y heparina intravenosa en hombres con enfermedad coronaria inestable. El grupo RISC. Lancet 1990; 336: 827-830.
- Lewis HD Jr, et al: Efectos protectores de la aspirina contra el infarto agudo de miocardio y la muerte en hombres con angina inestable. Resultados de un estudio cooperativo de la Administración de Veteranos. N Engl J Med 1983; 309: 396-403.
- Theroux P, et al: Aspirina, heparina o ambas para tratar la angina inestable aguda. N Engl J Med 1988; 319: 1105-1111.
- Cairns JA, et al: Aspirina, sulfinpirazona o ambas en la angina inestable. Resultados de un ensayo multicéntrico canadiense. N Engl J Med 1985; 313: 1369-1375.
- Yusuf S, et al: Efectos del clopidogrel además de la aspirina en pacientes con síndromes coronarios agudos sin elevación del segmento ST. N Engl J Med 2001; 345: 494-502.
- Mehta SR, et al: Efectos del tratamiento previo con clopidogrel y aspirina seguido de una terapia a largo plazo en pacientes sometidos a una intervención coronaria percutánea: el estudio PCI-CURE. Lancet 2001; 358: 527-533.
- Parodi G, et al.: Alta reactividad plaquetaria residual tras la carga de clopi- dogrel y acontecimientos cardiovasculares a largo plazo entre pacientes con síndromes coronarios agudos sometidos a ICP. JAMA 2011; 306: 1215-1223.
- Wiviott SD, et al: Prasugrel frente a clopidogrel en pacientes con síndromes coronarios agudos. N Engl J Med 2007; 357: 2001-2015.
- Wallentin L, et al: Ticagrelor frente a clopidogrel en pacientes con síndromes coronarios agudos. N Engl J Med 2009; 361(11): 1045-1057.
- Steg PG, et al: Effect of cangrelor on periprocedural out- comes in percutaneous coronary interventions: a pooled analysis of patient-level data. Lancet 2013; 382: 1981-1992.
- Roffi M, et al: Inhibición de la glucoproteína plaquetaria IIb/IIIa en los síndromes coronarios agudos. Gradiente de beneficio relacionado con la estrategia de revascularización. Eur Heart J 2002; 23: 1441-1448.
- Mehran R, et al: Cese del tratamiento antiagregante plaquetario doble y acontecimientos cardíacos tras una intervención coronaria percutánea (PARIS): resultados a 2 años de un estudio observacional prospectivo. Lancet 2013; 382(9906): 1714-1722.
- Levine GN, et al: Focused Update Writing Group, 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease. JACC 2016. doi:10.1016/j.jacc.2016.03.513 [Epub ahead of Print].
- Bellemain-Appaix A, et al: Nuevos inhibidores de P2Y12 frente a clopidogrel en la intervención coronaria percutánea: un metaanálisis. J Am Coll Cardiol 2010; 56(19): 1542-1551.
- Angiolillo DJ, et al: Tratamiento antiplaquetario puente con cangrelor en pacientes sometidos a cirugía cardiaca: un ensayo controlado aleatorizado. JAMA 2012; 307(3): 265-274.
PRÁCTICA GP 2016; 11(6): 22-29