Con el creciente número de opciones terapéuticas personalizadas e inmuno-oncológicas, también crece la importancia de los marcadores predictivos. Hasta la fecha, para determinarlo es necesario un diagnóstico tisular que incluya la extracción invasiva de una biopsia. Esto podría cambiar pronto con la introducción de la llamada biopsia líquida. Sin embargo, aún quedan algunos obstáculos por superar antes de su despliegue a gran escala.
Donde antes el análisis genético requería la extirpación de tejido tumoral, pronto podría bastar con una simple muestra de sangre. En el marco del análisis de ácidos nucleicos en sangre mediante biopsia líquida , las células tumorales circulantes, el ADN y el ARN tumorales se aíslan de la sangre venosa y se examinan. Se trata de un método que sólo es posible gracias a la detección altamente sensible de ácidos nucleicos. Si esto puede validarse para un uso generalizado, podría, entre otras cosas, simplificar significativamente el diagnóstico de las mutaciones impulsoras y, por tanto, la elección de la terapia. Aunque aún faltan procedimientos normalizados y datos a largo plazo, la tecnología ha experimentado un verdadero auge en los últimos años. Esto se refleja en un impresionante aumento de las contribuciones a congresos y de las publicaciones. Mientras que la búsqueda en PubMed de “biopsia líquida” arroja unos escasos 21 artículos publicados en 2013, la cifra para 2020 es de 1374 [1]. El nuevo campo de diagnóstico también parece interesante desde el punto de vista económico. Como resultado, ha surgido un gran número de empresas dedicadas exclusivamente a la investigación y comercialización de la biopsia líquida . La más famosa de ellas es probablemente la start-up GRAIL, que cuenta con el apoyo de Bill Gates y se ha dedicado en particular a la detección precoz del cáncer mediante ácidos nucleicos tumorales circulantes libres de células [2].
ADN tumoral en la sangre
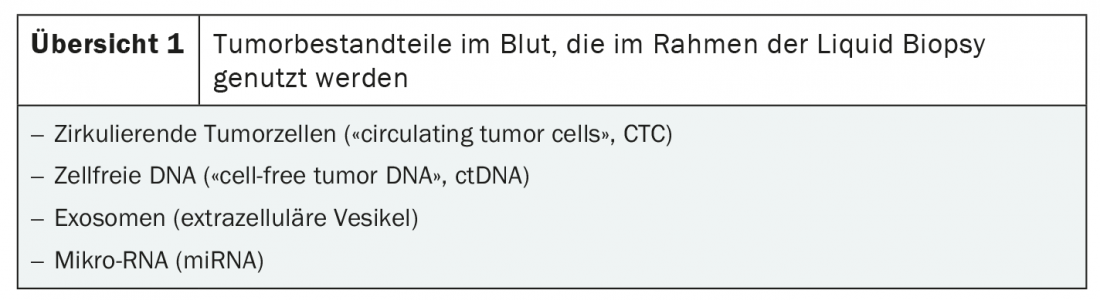
El requisito previo para la biopsia líquida es el aislamiento de los componentes tumorales en la sangre. Existen dos fuentes principales de ADN maligno: las células tumorales circulantes (CTC) y el ADN tumoral libre de células (ctADN). Además, la biopsia líquida puede utilizarse para identificar tumores. Se pueden detectar exosomas y microARN (miARN) (resumen 1) [3]. El procedimiento se basa en métodos muy sensibles de detección de ácidos nucleicos como la secuenciación paralela (NGS), la PCR y los análisis de células individuales [3,4].
Los diferentes enfoques se utilizan en distintos ámbitos en función de sus ventajas e inconvenientes. Por ejemplo, la heterogeneidad tumoral puede cartografiarse analizando el ADNct, mientras que es más difícil pronunciarse sobre la composición del tumor global utilizando células tumorales circulantes. En ambos casos, se pudo demostrar un valor pronóstico del examen para diversas neoplasias malignas: Cuantas más células tumorales circulantes, así como ADN libre de células, se detecten, mayor será el riesgo de recurrencia y progresión. Además, el grado y el estadio del tumor se correlacionan con la carga de ADNct. Pero las posibilidades de diagnóstico van mucho más allá de estos análisis cuantitativos. Los cambios cualitativos también tienen importancia pronóstica y predictiva. No sólo pueden utilizarse para identificar dianas terapéuticas y aberraciones genéticas, sino que también sirven como parámetros de progresión que podrían utilizarse para evaluar la respuesta terapéutica en el futuro. Por ejemplo, la persistencia de la expresión de PD-L1 en las células tumorales circulantes bajo un bloqueo adecuado de los puntos de control se clasifica como de pronóstico desfavorable [5]. Resultados similares se aplican a la terapia con inhibidores de la tirosina quinasa en pacientes con cáncer de pulmón: En respuesta, disminuye el nivel de ctADN para mutaciones del receptor del factor de crecimiento epidérmico (EGFR) [6]. En general, una inestabilidad de microsatélites (MSI) en el ADNct, entre otras cosas, parece indicar un estadio tumoral avanzado. Muchas investigaciones en este campo están actualmente en pleno apogeo, y con el creciente número de dianas terapéuticas y marcadores predictivos, hay otras innumerables cuestiones a la espera de que se compruebe su idoneidad para la biopsia líquida .
De exosomas y micro ARN
Sin embargo, no sólo las células tumorales circulantes y el ctADN son objeto de investigación en la actualidad, sino también otros componentes tumorales que pueden detectarse en la sangre: Exosomas y microARN (miARN). Estos últimos son pequeños fragmentos de ARN no codificante. Éstos intervienen en la regulación de la proliferación, la diferenciación celular y la apoptosis, por lo que funcionan como oncogenes o genes supresores de tumores [7]. Clínicamente, el miARN es particularmente prometedor como biomarcador, porque el nivel de expresión se correlaciona con el cambio maligno. Y esto ocurre a menudo incluso antes de que los cambios fenotípicos sean detectables [8]. Además, cada neoplasia maligna tiene una firma de miARN característica , una gran ventaja a la hora de determinar el origen tisular de un tumor poco diferenciado. Ya sea en la detección precoz o para aclarar la identidad de los tumores, probablemente se oirá hablar aún más de los miARN en los próximos años.
En este contexto, también resulta interesante analizar los exosomas, es decir, las vesículas extracelulares. Porque contienen altas concentraciones de miARN. Como presumiblemente todas las células, las tumorales también segregan vesículas de origen endosómico. Su papel aún no está muy claro, pero se está investigando intensamente. Por ejemplo, hay indicios de que los exosomas tumorales pueden promover la angiogénesis o inactivar anticuerpos terapéuticos al expresar antígenos tumorales.
Ya se trate de ctADN, células tumorales circulantes, miARN o exosomas, la biopsia líquida entra en consideración para numerosos ámbitos de aplicación. El método podría ser especialmente adecuado para la detección precoz de tumores, la caracterización genética y como parámetro de progresión durante la terapia [4]. Las ventajas son evidentes: el diagnóstico menos invasivo, que también es posible en ausencia de tejido tumoral y, además, es comparativamente de bajo riesgo, permite obtener una imagen dinámica del perfil genético tumoral. Por un lado, las recidivas pueden detectarse precozmente y, por otro, su perfil molecular, a menudo alterado, puede descifrarse mediante un muestreo de sangre, y atacarse en consecuencia. Si la biopsia líquida llegara a establecerse como método estándar, esto significaría probablemente otro hito en la era de la planificación de terapias personalizadas.
Es necesario un mayor desarrollo
Aunque ya se ha investigado mucho, el proceso aún está en pañales. En consecuencia, aún existen grandes incertidumbres en la evaluación y también en la aplicación. La aplicabilidad parece diferir significativamente entre los distintos tipos de tumores y estadios. Por ejemplo, el ctADN sólo es detectable en cerca del 70% de las neoplasias metastásicas. En muchas entidades tumorales, una proporción significativa de pacientes casi no tiene ctADN. En el caso de los tumores cerebrales, el uso del análisis de ADNct es cuestionable debido a la barrera hematoencefálica, ya que sólo muy pocos fragmentos de ADN llegan a entrar en la sangre [3,4]. Con nuevos aumentos de la sensibilidad de los métodos de medición, es probable que estas limitaciones puedan contrarrestarse de forma cada vez más eficaz en los próximos años. Sin embargo, aún deben realizarse algunas optimizaciones técnicas antes de que pueda utilizarse en la práctica clínica diaria [4].
Para permitir una aplicación más amplia, en la actualidad también faltan la normalización y la gestión de la calidad de los métodos. Los expertos coinciden en ello y piden, entre otras cosas, que se definan valores de corte claros y paneles normalizados. También es necesario determinar hasta qué punto los distintos marcadores son capaces de representar la heterogeneidad tumoral. La posibilidad de registrar las características moleculares de una neoplasia de forma más completa que, por ejemplo, mediante una biopsia clásica podría representar otra ventaja decisiva del nuevo método. La importancia de la biopsia líquida en la detección precoz del cáncer, con todos sus dilemas, aún está por ver. En este contexto, la relevancia de un hallazgo “patológico” debe analizarse en detalle, sobre todo en lo que respecta al riesgo real de enfermedad, antes de generalizar el uso de los diagnósticos [4]. Por tanto, aún queda mucho camino por recorrer antes de que se ponga en práctica en la vida cotidiana, lo que sin duda seguirá siendo apasionante en los próximos años.
Fuente: Wallesch M, Wirth M, Wollenberg B: La “biopsia líquida” como figura clave en la inmuno-oncología. ENT. 2020; 68(12): 899-904.
Literatura:
- www.ncbi.nlm.nih.gov/pubmed/ (consultado el 07.03.2021)
- https://grail.com/ (consultado el 07.03.2021)
- Nitz P: Biopsia líquida. Sociedad Alemana contra el Cáncer; 2018. www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/diagnosemethoden/liquid-biopsy.html (consultado el 07.03.2021)
- Dahl E: Diagnóstico: Biopsia líquida – Situación 2016. Dtsch Arztbl. 2016; 113(4). DOI: 10.3238/PersOnko/2016.09.30.01
- Hofman P, et al.: La biopsia líquida en la era de la inmuno-oncología: ¿está lista para su uso en pacientes con cáncer? Ann Oncol. 2019; 30(9): 1448-1459.
- Thress KS, et al: Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nat Med. 2015; 21(6): 560-562.
- Iorio MV, Croce CM: Disregulación del microARN en el cáncer: diagnóstico, seguimiento y terapéutica. Una revisión exhaustiva de . EMBO Mol Med. 2017; 9(6): 852.
- du Rieu MC, et al: El microARN-21 se induce precozmente en las lesiones precursoras del adenocarcinoma ductal pancreático. Clin Chem. 2010; 56(4): 603-612.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2021; 9(2): 42-43