Debido al creciente envejecimiento de la población, así como a la mejora de la atención médica, el número de pacientes sometidos a procedimientos de sustitución renal ha aumentado en los últimos años. A finales de 2015, unos 4.100 pacientes estaban en programa de diálisis, 423 en diálisis domiciliaria (sobre todo diálisis peritoneal) [1] y el resto en hemodiálisis en centro. Además, en Suiza hay unos 5.000 pacientes con un trasplante en funcionamiento. Muchas especialidades médicas intervienen en el cuidado de los pacientes con insuficiencia renal crónica. En los estadios 1-3 de la ERC, el médico de cabecera es el cuidador principal, mientras que en los estadios 4+5 de la ERC (pacientes en diálisis), es más probable que la atención corra a cargo del nefrólogo (Fig. 1). Si la función renal es <30% (TFG <30 ml/min.), debe remitirse al paciente a un nefrólogo para que pueda prepararse cuidadosamente para un procedimiento de sustitución renal [2].
Por regla general, la diálisis crónica se inicia cuando el FG está entre 8-12 ml/min., por lo que la decisión de comenzar no se basa únicamente en los valores de laboratorio [3]. En pacientes asintomáticos, la indicación de iniciar la diálisis puede hacerse con cautela [4]. Una indicación absoluta es la hiperpotasemia que no puede controlarse con medidas conservadoras, o la hipervolemia que no puede controlarse con diuréticos (especialmente en el síndrome cardiorrenal). Con una buena cooperación entre el nefrólogo, el médico de cabecera y el paciente, el cuadro clínico de pericarditis urémica o encefalopatía urémica no debería producirse; ambos cuadros clínicos serían una indicación de urgencia para el inicio de diálisis.
Diálisis peritoneal [5]
- DPCA = diálisis peritoneal ambulatoria continua
- DPA = diálisis peritoneal automatizada
Como procedimiento de diálisis aguda en adultos, la diálisis peritoneal no tiene cabida. En cambio, el procedimiento se establece para la insuficiencia renal crónica que requiere diálisis. En Suiza, la proporción de pacientes en diálisis peritoneal ha aumentado en los últimos años (10-12%). No existen ensayos aleatorios prospectivos con comparación directa de la mortalidad y la morbilidad entre la DP y la HD, pero al menos en los primeros años de la terapia sustitutiva renal los procedimientos parecen equivalentes. En casos de insuficiencia cardiaca grave (e inestabilidad circulatoria durante la HD) y falta de acceso vascular para la hemodiálisis, es preferible la DP. Una buena alternativa a la hemodiálisis en el centro es la DPA nocturna, especialmente para los pacientes más jóvenes que trabajan.
La figura 2 muestra los aspectos técnicos: la DP se realiza a través de un catéter de diálisis intraperitoneal, normalmente insertado por laparoscopia. El procedimiento utiliza el peritoneo como membrana semipermeable para eliminar los productos metabólicos por difusión y ósmosis. En la diálisis peritoneal, el cumplimiento del paciente es muy esencial, ya que él mismo lleva a cabo la terapia. Es entrenado y controlado por personal de enfermería especializado y, si el curso es estable, se realizan controles nefrológicos y consultas cada 4-6 semanas.
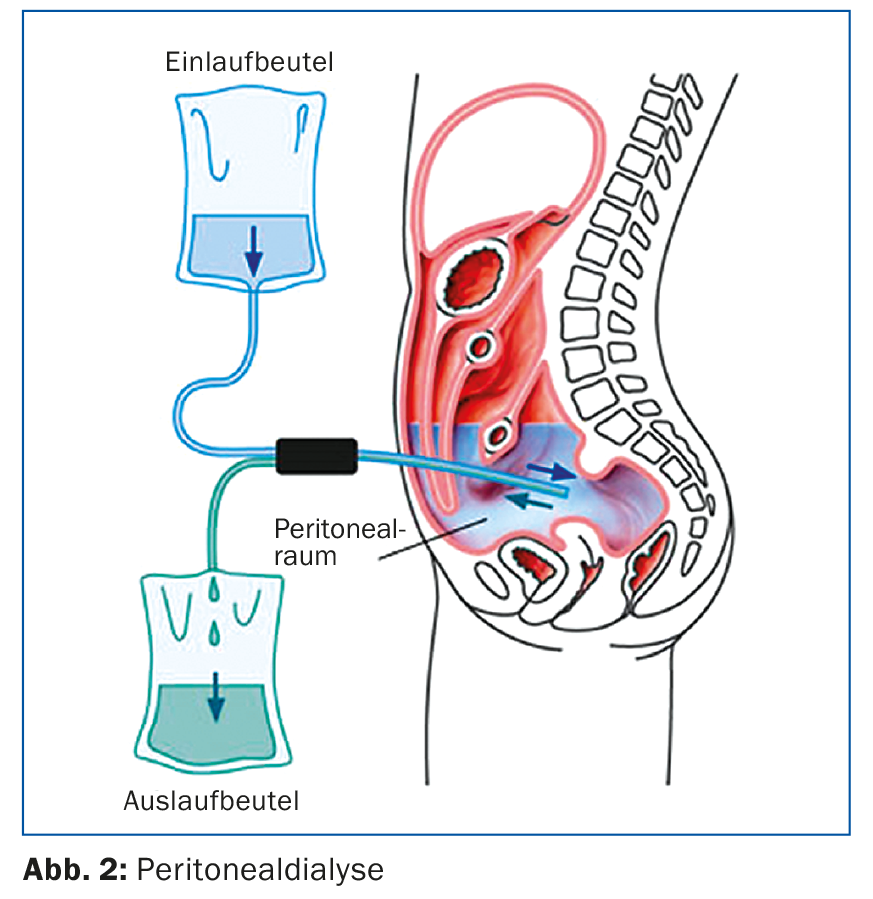
Una posible ventaja de la diálisis peritoneal en comparación con la hemodiálisis es que se puede reducir la función residual o el flujo sanguíneo. La diuresis residual se conserva durante más tiempo. Por este motivo, es importante que se realicen el menor número posible de exploraciones radiológicas con medio de contraste yodado. También deben evitarse los antiinflamatorios no esteroideos para preservar la función residual, que es importante para la diálisis peritoneal. En el caso de las complicaciones de la diálisis peritoneal, el centro de nefrología suele ser el responsable, sobre todo de los problemas con el catéter, como la dislocación o la fuga del catéter. Con los sistemas de diálisis peritoneal actuales, la peritonitis es rara pero sigue siendo peligrosa [5]. Si se produce un dializado turbio o dolor abdominal, debe examinarse el dializado en urgencias e iniciarse una terapia antibiótica (normalmente intraperitoneal, a menudo puede evitarse la hospitalización).
Hemodiálisis
Para la mayoría de los pacientes, la hemodiálisis se realiza en el centro de diálisis (diálisis en centro), sólo unos pocos pacientes realizan la diálisis en casa (hemodiálisis domiciliaria). Un solo tratamiento de hemodiálisis dura entre 3,5 y 4,5 horas, dependiendo de la función residual y de otros factores individuales. Normalmente se realizan tres sesiones de hemodiálisis a la semana. En la mayoría de los centros es técnicamente posible realizar una llamada hemodiafiltración (desintoxicación mediante una combinación de hemodiálisis y hemofiltración). Para una diálisis eficaz, se necesita un acceso vascular [6] que proporcione un flujo sanguíneo suficiente (>300 ml/min.). El acceso vascular sigue llamándose “la pata de caballo de la diálisis” debido a diversos problemas técnicos. Las distintas posibilidades se muestran en la figura 3 : Si no se dispone de una derivación al inicio de la diálisis, el procedimiento se realiza a través de un catéter auricular tunelizado por vía subcutánea. La ventaja es que la diálisis puede iniciarse inmediatamente. Un catéter auricular también puede ser la opción principal de acceso vascular, especialmente en pacientes de edad avanzada y pacientes con condiciones vasculares periféricas muy deficientes e insuficiencia cardiaca grave. Después de cada diálisis, los volúmenes del catéter se bloquean con una solución especial (por ejemplo, liquemin o solución de citrato). La manipulación de los catéteres de diálisis de larga duración sólo debe ser llevada a cabo por personal de diálisis formado, ya que de lo contrario las complicaciones como la disfunción del catéter o las infecciones del catéter están programadas de antemano [7].
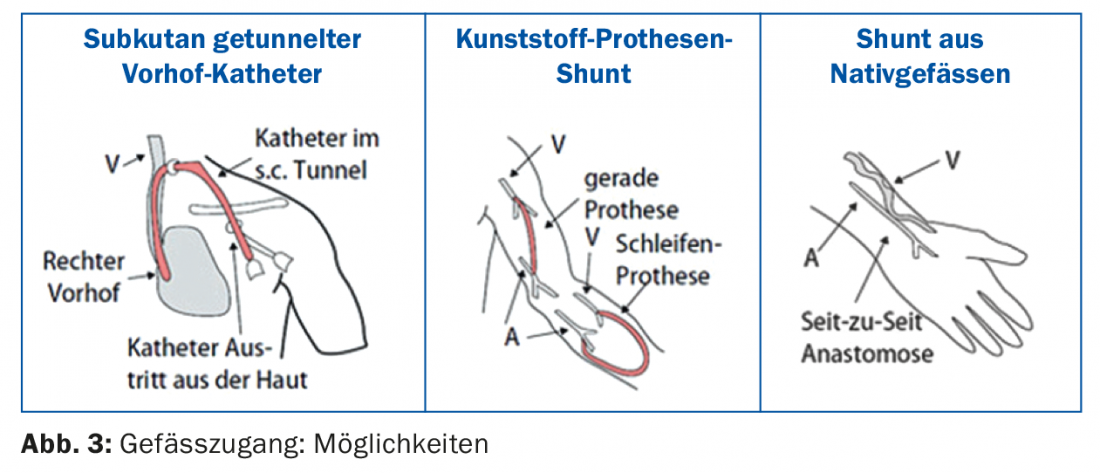
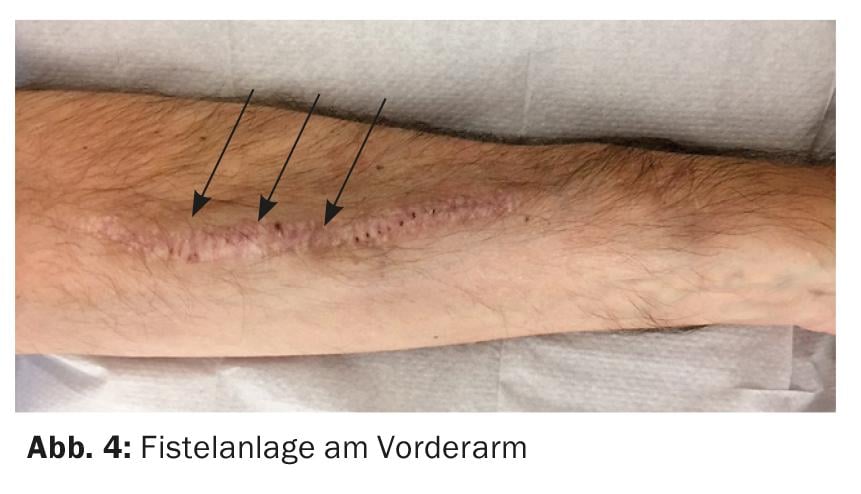
El mejor acceso vascular sigue siendo una fístula arteriovenosa (AV) nativa. Preferiblemente, la fístula se crea en el antebrazo no dominante (Fig. 4) . Una alternativa es utilizar la vena cefálica de la parte superior del brazo, pero con un diámetro de vaso grande existe el riesgo de una derivación hiperdinámica con el peligro de estrés cardiaco.
La alternativa a una fístula nativa es una derivación protésica de plástico, por ejemplo en forma de prótesis de asa en el antebrazo. Es importante que el brazo con una derivación de diálisis en funcionamiento sólo se utilice como acceso vascular para la diálisis, deben evitarse las tomas de muestras de sangre o las cánulas permanentes.
Aspectos dietéticos
Los aspectos dietéticos deben tenerse en cuenta tanto en la EP como en la EH. En el transcurso del tratamiento de diálisis, es de esperar una disminución de la función residual y, paralelamente, la restricción de potasio, fosfato, sal y líquidos adquiere mayor importancia. Para ambos procedimientos, se aplica el principio relativo a la ingesta de líquidos: diuresis residual + 800 ml al día, ingesta de suero salino 4-6 g al día. Especialmente en pacientes en hemodiálisis, es necesaria la restricción nutritiva de potasio (Tab. 1) , así como el uso de intercambiadores de iones de gato (por ejemplo, polisterol sulfonato, Resonium A). Los fármacos que aumentan el potasio sérico (inhibidores de la ECA, bloqueantes de la angiotensina II) deben utilizarse con precaución; la espirolonactona y las dosis altas de Bactrim no deben utilizarse.

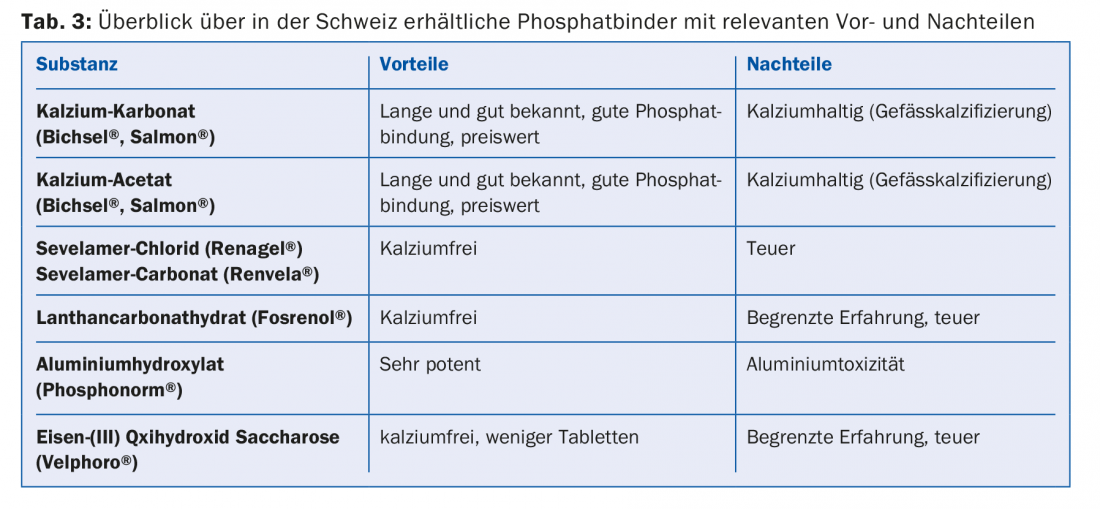
Otro problema es la hiperfosfatemia, ya que la diálisis sólo puede eliminar una parte del fosfato reabsorbido. La hiperfosfatemia persistente va acompañada de una calcificación creciente de los vasos [9], por lo que los pacientes en diálisis a largo plazo sufren a menudo una arteriosclerosis grave generalizada. Al mismo tiempo, la hiperfosfatemia favorece el hiperparatiroidismo secundario renal [8]. Por estas razones, por un lado, es necesaria una dieta baja en fosfatos (alimentos que contienen fosfatos, tab. 2) con la ingesta simultánea de captores de fosfatos. Distinguimos entre captores de fosfato con calcio y sin calcio, que difieren en potencia, perfil de efectos secundarios e interacciones (Tab. 3).

Aspectos farmacológicos
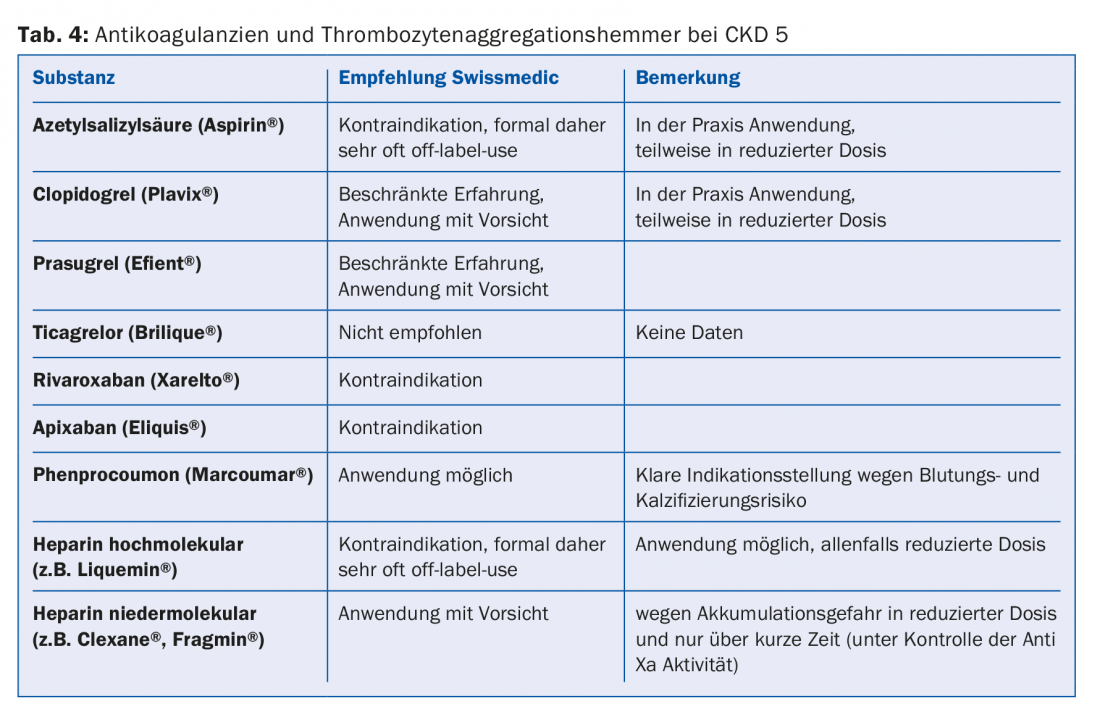
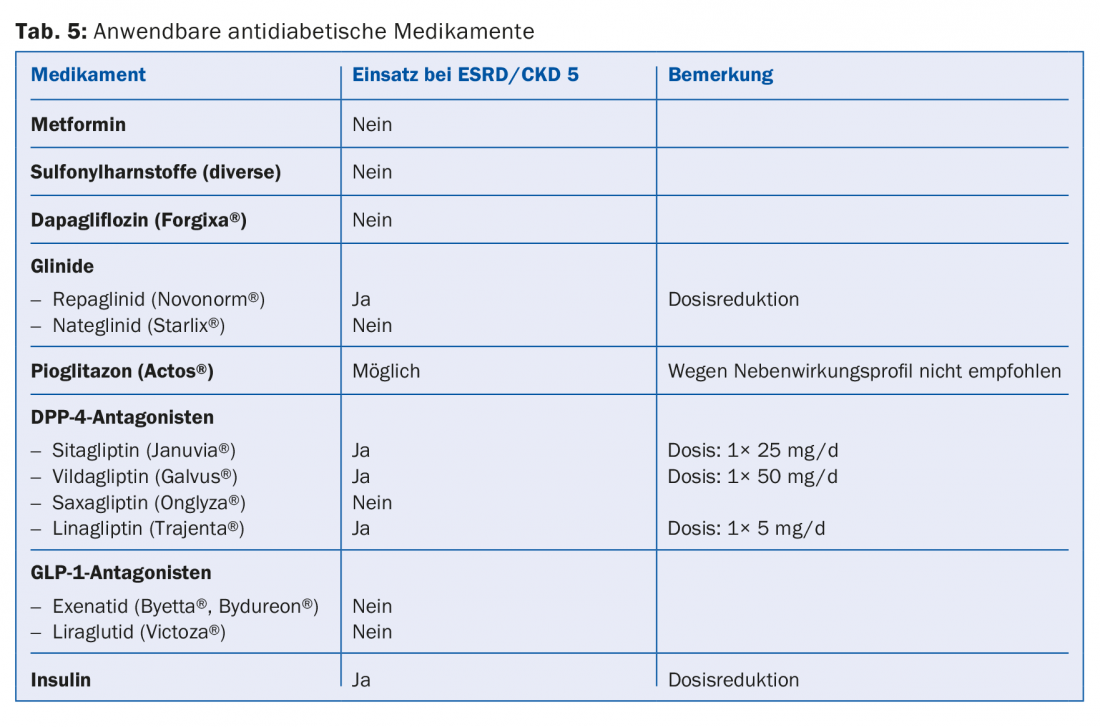
Una gran parte de los medicamentos o sus metabolitos se eliminan por vía renal. Por lo tanto, las contraindicaciones absolutas y relativas deben ajustarse a las directrices (por ejemplo, Compendium). Esto es especialmente cierto para la mayoría de los antibióticos, anticoagulantes y antiagregantes plaquetarios (tab. 4). Dado que el 30-40% de los pacientes en diálisis padecen diabetes, es importante evitar por completo ciertos fármacos antidiabéticos (por ejemplo, metformina, sulfonilureas) o reducir la dosis (por ejemplo, sitagliptina, vildagliptina, etc.) (tab. 5) [10]. En cuanto a la medicación para el dolor, los antiinflamatorios no esteroideos sólo deben administrarse durante poco tiempo, si acaso (riesgo de hiperpotasemia, reducción de la diuresis residual, trastorno adicional de la agregación plaquetaria). Los preparados de paracetamol (hasta 3 g/día) y el metamizol se consideran relativamente seguros. Los opiáceos deben tomarse en dosis bajas; aquí también hay que tener en cuenta la acumulación de metabolitos. Los preparados de buprenorfina o fentanilo son muy adecuados para este fin (normalmente con un FG <15 ml/min). Reducción de la dosis a la mitad [11]. Los preparados con codeína son menos adecuados (riesgo de acumulación y potencial de interacción). Del mismo modo, el tramadol sólo debe dosificarse a dosis bajas. Está contraindicada la petidina (riesgo de convulsiones).
Importancia de la atención del médico de cabecera
En los pacientes en hemodiálisis a los que se visita tres veces por semana, el nefrólogo suele ser también el médico de cabecera. Para los pacientes que están más lejos del centro de diálisis o viven en una institución asistencial, el médico de familia sigue teniendo una gran prioridad. Lo mismo ocurre con los pacientes de DPCA que sólo acuden al centro de diálisis cada 1-2 meses.
El médico de familia también es importante como confidente cuando un paciente anciano con una calidad de vida en declive decide interrumpir el tratamiento de diálisis. La interrupción activa de la diálisis es responsable de casi el 20% de las muertes anuales en pacientes con sustitución renal. El médico de familia, que conoce al paciente desde hace años, está en condiciones de juzgar si se trata de un equilibrio vital o, en el mejor de los casos, de una depresión (tratable). Esto debe tratarse con medicación antes de tomar la importante decisión de interrumpir el tratamiento de diálisis.
Literatura:
- Asociación Suiza para las Tareas Conjuntas del Seguro de Enfermedad (SVK): www.svk.org/assets/uploads.
- Elsässer H, et al: Planificación de una intervención de sustitución renal: ¿qué necesita saber? Schweiz Med Forum 2008; 8: 70-74.
- Kleophas W: ¿Cuándo es el momento adecuado para iniciar la terapia renal sustitutiva? Nefrólogo 2012; 7: 96-103.
- Cooper BA, et al: Un ensayo aleatorizado y controlado de la iniciación precoz frente a la tardía de la diálisis. N Engl J Med 2010; 363: 609-619.
- Kribben A, et al.: Situación, indicaciones y limitaciones de la diálisis peritoneal. Nefrólogo 2007; 2: 74-81.
- KDOQI. Guías de práctica clínica para el acceso vascular. Am J Kidney Dis 2006; 48: 176-247.
- Alerta rápida: “Uso incorrecto de los catéteres de diálisis”; en curso (Patient Safety Switzerland).
- Grupo de trabajo CKD-MBD Enfermedad renal: mejora de los resultados globales (KDIGO). Guía de práctica clínica KDIGO para el diagnóstico, la evaluación, la prevención y el tratamiento de la enfermedad renal crónica-trastorno mineral y óseo (ERC-TMO), Kidney Int 2009; 76(Suppl): 1-130.
- Herzog CA, et al: Enfermedad cardiovascular en la enfermedad renal crónica. Un formulario de actualización clínica Enfermedad renal; mejora de los resultados globales (KDIGO. Kidney Int 2011; 80: 572-586.
- Zanchi A, et al: Insuficiencia renal y diabetes, actuar con previsión. Schweiz Med Forum 2014; 14(6): 100-104.
- Liechti ME: Farmacología de los analgésicos para la práctica, parte 2: Opiáceos. Foro Med Suiza 2014; 14: 460-464.
PRÁCTICA GP 2016; 11(10): 32-38