La respuesta Th2 de la dermatitis atópica está fuertemente controlada por la IL-13, que activa el receptor de tipo II uniéndose a la cadena IL-13Rα. La IL-13 se expresa a un nivel más elevado que la IL-4 en la piel lesional de los pacientes con dermatitis atópica y sus efectos perjudiciales directos sobre la piel son cada vez más conocidos. Al influir específicamente en estos patomecanismos, nos acercamos al objetivo de la medicina de precisión individualizada.
La dermatología, como la propia piel, cambia constantemente. Al igual que en el resto de la medicina, nuestra comprensión de los procesos fisiopatológicos básicos se ha ampliado de forma espectacular y aprendemos cada día. Durante mucho tiempo, el único tratamiento de la dermatitis atópica consistió predominantemente en el uso de esteroides muy potentes, complementados como mucho con inhibidores tópicos de la calcineurina, fototerapia y, en las formas graves, inmunosupresores como la ciclosporina A. En la actualidad, este enfoque puede ampliarse cada vez más mediante un uso mucho más selectivo de los fármacos gracias a nuestra comprensión más detallada de la patología subyacente [1].
La dermatitis atópica, al igual que la alopecia areata o el asma bronquial, es una enfermedad dominante de tipo 2 causada por complejas interacciones entre la genética y el medio ambiente. No obstante, pueden identificarse puntos en común entre fenotipos clínicamente muy diferentes. Algunas interleucinas y sus receptores, así como las vías de señalización descendentes, han demostrado tener una importancia fundamental.
El origen de la respuesta inmunitaria T2 se encuentra probablemente en la protección contra las infecciones parasitarias. Además de las células T auxiliares de tipo 2 clásicas (células Th2), las fuentes de las citocinas esenciales IL-4, IL-13 e IL-5 incluyen las células linfoides innatas de tipo 2 (ILC-2), los mastocitos y los basófilos. La IL-5 también desempeña un papel clave en la maduración y el reclutamiento de eosinófilos en la mayoría de los tejidos, donde actúan como células efectoras de las reacciones alérgicas [2].
Modo de acción molecular
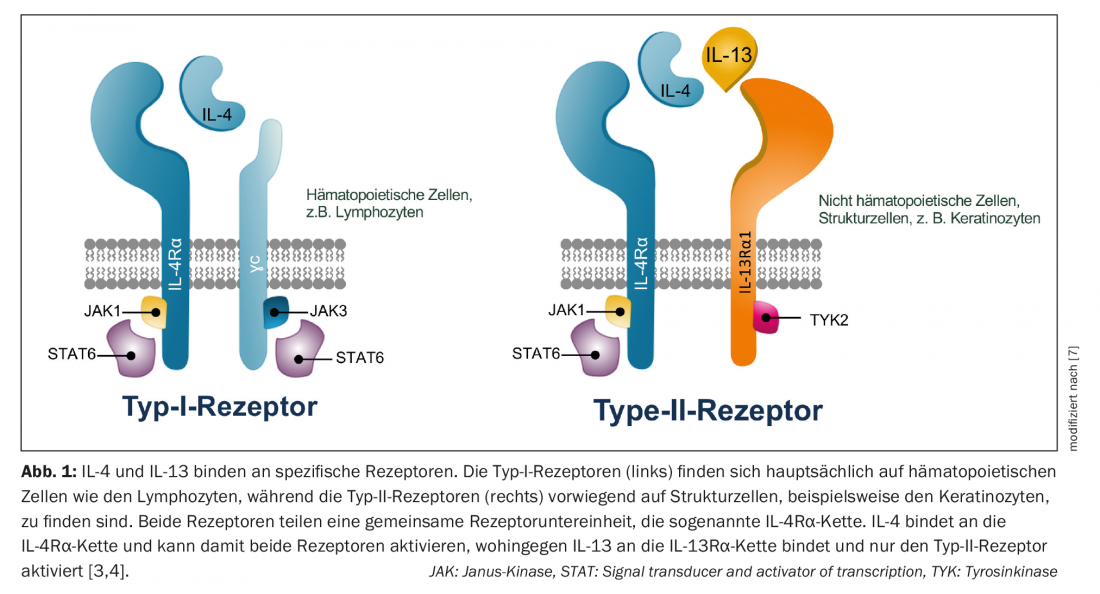
La IL-4 y la IL-13 se unen a receptores específicos. Los receptores de tipo I se expresan principalmente en los ganglios linfáticos y desempeñan un papel en la respuesta inmunitaria humoral, mientras que los receptores de tipo II median la respuesta inmunitaria en los tejidos periféricos y, por tanto, en la piel. La IL-4 puede activar ambos receptores, mientras que la IL-13 sólo activa el receptor de tipo II [3]. Tanto la IL-13 como la IL-4 se unen al denominado receptor de tipo II, formado por la subunidad IL-4Rα y la subunidad IL-13Rα1. En este proceso, las dos citocinas compiten por unirse al receptor de tipo II – por lo tanto, la proporción de IL-4/IL-13 presente determina cuál de las dos citocinas controla la respuesta inflamatoria [4] (Fig. 1). Además, la IL-13 se une al receptor IL-13Rα2, cuyo papel, sin embargo, aún no se ha aclarado del todo [5]. Es probable que la respuesta Th2 de la dermatitis atópica no esté controlada predominantemente por la IL-4, como se pensaba anteriormente, sino principalmente por la IL-13 a través del receptor de tipo II [6–8].
Expresión y progresión de la enfermedad de la IL-13
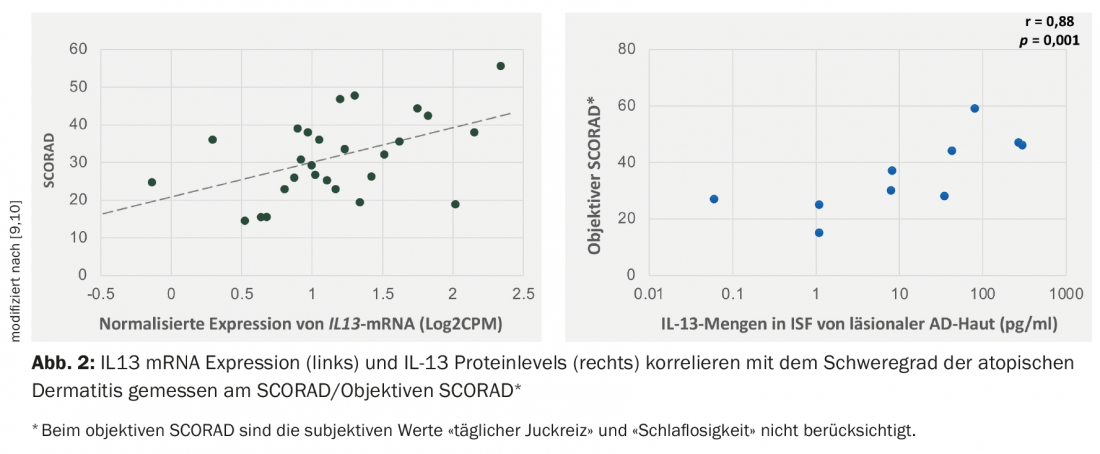
Los estudios han demostrado que la IL-13 se expresa en mayor medida que la IL-4 en la piel lesional de los pacientes con dermatitis atópica. El nivel de expresión del ARNm de la IL13 se correlaciona positivamente con el índice de gravedad (SCORAD, SCORing Atopic Dermatitis) [9–11] (Fig. 2).
Cascada de señalización intracelular
Dirigirse a las vías de señalización implicadas en la enfermedad es el objetivo de la medicina de precisión (véase la sección siguiente). La unión de la IL-13 y la IL-4 a sus receptores activa las quinasas de la corriente descendente que se fosforilan entre sí. Al receptor de tipo II, la IL-4 se une a través de la cadena IL-4Rα y la IL-13 se une a través de la cadena IL-13Rα y activa la Janus quinasa (JAK) 1 y la tirosina quinasa 2 (TYK2). La unión de la IL-4 al receptor de tipo I activa JAK1 y JAK3 [4]. La IL-5, que es importante para el reclutamiento de eosinófilos como células efectoras importantes en las alergias, también activa la JAK2 [12]. La fosforilación de las JAK respectivas activa el factor de transcripción STAT6 (transductor de señales y activador de la transcripción 6), que inicia la expresión génica en el núcleo celular. Dado que las JAK participan en diversas cascadas de señalización a través de distintos tipos de receptores, su bloqueo mediante inhibidores de las JAK (JAKis) es otro enfoque terapéutico posible y eficaz, aunque menos específico [13].
Efectos de la sobreexpresión de IL-13 en la piel
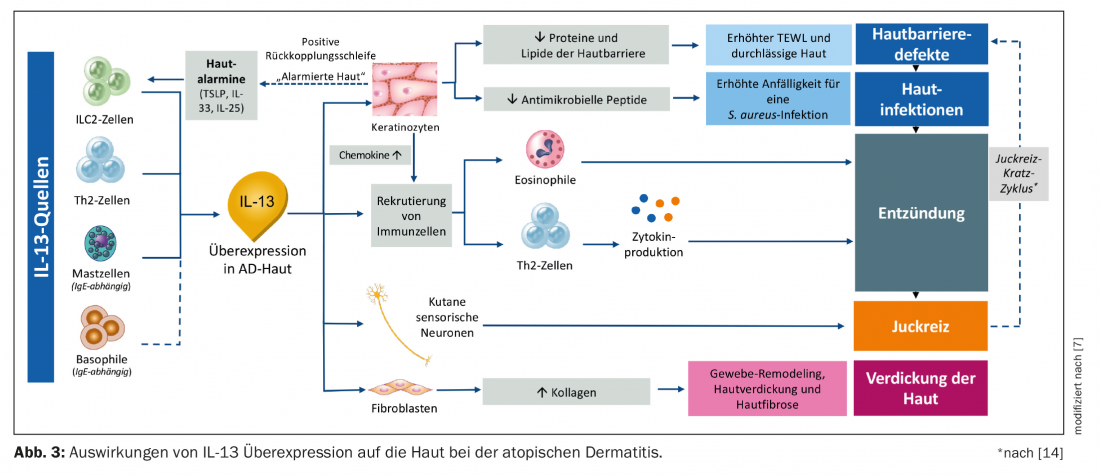
En la dermatitis atópica, la IL-13 es producida cada vez más por mastocitos, células Th2, ILC-2 y basófilos. Los queratinocitos segregan las llamadas alarminas (TSLP, IL-33, IL-25) y estimulan así a las células ILC-2 para que segreguen IL-13 e IL-5. Al mismo tiempo, esto reduce la secreción de péptidos y lípidos antimicrobianos, lo que hace más permeable la barrera cutánea y provoca una mayor susceptibilidad al S. aureus e inflamación de la piel. La sobreproducción de IL-13 también alerta al sistema inmunitario, provocando un aumento de la producción de eosinófilos y células Th2 y desencadenando una inflamación del tejido mediada por citocinas (Fig. 3) [7]. También están implicadas otras citocinas como la IL-10, la IL-22 y la IL-31 [8].
El aumento del picor se debe a la estimulación repetida de las neuronas sensoriales cutáneas, que liberan más IL-4 e IL-13 [7]. Otra citocina con un alto potencial pruritogénico es la IL-31 [15,16]. La liberación de estas sustancias conduce a un ciclo de picor-rascado que aumenta aún más la permeabilidad de la barrera cutánea. El bucle de retroalimentación desencadenado por esto hace que los queratinocitos vuelvan a ponerse en alerta y produzcan más alarminas cutáneas, que estimulan de nuevo a las células ILC-2 para que produzcan aún más IL-13. A través de este ciclo, la cascada de señalización se inicia de nuevo y el estado de la enfermedad empeora. Además, se estimula la reproducción de los fibroblastos a través de la IL-13; aumenta la producción de colágeno, lo que puede provocar un engrosamiento de la piel y una fibrosis cutánea adicional. A largo plazo, esto conduce a la liquenificación crónica de la piel [5,17–22].
Estrategias terapéuticas
La dermatitis atópica es una enfermedad fuertemente controlada por la IL-13. Son posibles las siguientes estrategias terapéuticas para inhibir la actividad biológica [7]:
- pequeñas moléculas que influyen en la interacción entre la IL-13 y el receptor: Moduladores de la interacción proteína-proteína (PPIM).
- Pequeñas moléculas que influyen en las vías de señalización intracelular descendentes (inhibidores de la quinasa, JAKis).
- Biológicos que inhiben la señalización a través de la IL-13, por ejemplo bloqueando su unión al receptor.
Los PPIM son actualmente objeto de investigación; se diseñan con ayuda de bibliotecas moleculares y simulaciones dinámicas. Este enfoque in silicopermite el desarrollo de nuevos fármacos dirigidos a interleucinas específicas y a sus receptores [7,23].
Ya se utilizan JAKis con diferente selectividad en el tratamiento de la artritis reumatoide. Las aplicaciones orales y tópicas son posibles para el tratamiento de la dermatitis atópica, y el inicio de la acción es muy rápido. Debido a su modo de acción, los JAKis inhiben parcialmente varias citocinas, por ejemplo, la IL4, la IL-5, la IL-31 y otras citocinas además de la IL-13, a diferencia de los biológicos, que sólo inhiben casi por completo las citocinas individuales. Los JAKis de primera generación inhiben principalmente la JAK1 y la JAK2 (ruxolitinib y baricitinib) o todas las JAK en una medida similar (pan-JAKis delgocitinib, tofacitinib, peficitinib, oclacitinib) [13,24–27]. El baricitinib ya está aprobado en Suiza para el tratamiento de pacientes adultos con EA de moderada a grave [28]. El oclacitinib cuenta con una autorización de comercialización veterinaria para el tratamiento de la EA en perros [29]. Los JAKis de segunda generación son algo más selectivos y actúan principalmente, aunque no de forma exclusiva, sobre JAK1 (abrocitinib, filgotinib, upadacitinib, itacitinib) o TYK2 (BMS-986165) [25–27]. Los perfiles de seguridad y tolerabilidad de los distintos JAKis difieren según la forma de dosificación y la molécula. En general, se observan infecciones del tracto respiratorio superior como el efecto secundario más común; además, puede medirse un aumento de la creatina fosfoquinasa y de las transaminasas hepáticas. Además, un posible efecto secundario es el aumento del riesgo de desarrollar herpes zóster [25,28].
Un biológico de primera generación para el tratamiento de la dermatitis atópica es el dupilumab, un anticuerpo monoclonal de administración subcutánea que se une a la subunidad IL-4Rα de los receptores de tipo I y II. Así, el efecto de señalización mediado por la IL-4 y la IL-13 se ve impedido por los receptores de tipo I y II. Dupilumab está aprobado para el tratamiento de pacientes con dermatitis atópica de moderada a grave en Suiza desde 2019 [30]. Tiene una eficacia muy buena y un perfil de tolerabilidad favorable. Además de para la dermatitis atópica, también puede utilizarse para otras afecciones como las formas graves de asma bronquial y la rinosinusitis crónica con pólipos nasales. Cabe destacar la aparición de eosinofilia transitoria y el aumento de la conjuntivitis como los síntomas concomitantes más comunes; otros efectos secundarios o cambios en los parámetros de laboratorio son muy raros [2,31–33].
Medicina de precisión mediante la inhibición selectiva de la IL-13
El bloqueo selectivo y específico de las vías de señalización molecular es el objetivo de la medicina de precisión. Es probable que el desarrollo de las PPIM marque aquí el camino hacia el futuro. Para la inhibición específica de la IL-13 se han desarrollado hasta ahora los biológicos lebrikizumab y tralokinumab, ambos ya investigados en la dermatitis atópica [34]. El lebrikizumab inhibe selectivamente la formación de complejos de señalización de receptores heterodiméricos de IL-13Rα1 e IL-4Rα [35]. Los estudios de fase IIb mostraron efectos rápidos y dependientes de la dosis sobre diversos parámetros clínicos en la dermatitis atópica [36]. El tralokinumab es un anticuerpo monoclonal IgG4 totalmente humano que se une con muy alta afinidad a la IL-13. El epítopo se solapa con el sitio de unión de los receptores IL-13Rα, impidiendo la unión de la IL-13 tanto a IL-13Rα1 como a IL-13Rα2 [37]. De este modo, se elimina selectivamente un importante factor de la patogénesis de la dermatitis atópica.
Se ha postulado que esta estrategia puede ser más eficaz que bloquear únicamente la unión de IL-13Rα1 [9]. En ensayos clínicos en pacientes con dermatitis atópica de moderada a grave, el tralokinumab en combinación con esteroides produjo una mejoría rápida y sostenida de los síntomas de la DA durante al menos 52 semanas. El EASI, el índice SCORAD, el índice de calidad de vida dermatológica (DLQI) y la escala de valoración numérica del prurito mostraron puntuaciones significativamente mejores en comparación con el grupo placebo [2,38–40]. Además, se demostró un buen perfil de tolerabilidad y seguridad, también con eosinofilia mensurable transitoriamente y un ligero aumento de la incidencia de conjuntivitis, con reducción simultánea de las infecciones cutáneas en comparación con el grupo de control [7,39,40].
Outlook
La dermatitis atópica se caracteriza por un amplio espectro de fenotipos clínicos. Cada vez reconocemos más que en esta enfermedad subyacen complejos mecanismos basales, genéticos e inmunopatogénicos. La ausencia de un factor único que lo explique todo complica la respuesta terapéutica y requiere una terapia individualizada. El tratamiento a medida es el reto y el objetivo de la medicina centrada en el paciente. La IL-13 se expresa a niveles más altos que la IL-4 en la piel lesional de los pacientes con dermatitis atópica y cada vez se conocen mejor sus efectos dañinos directos sobre la piel. Cuanto más consigamos influir específicamente en estos patomecanismos, más nos acercaremos al objetivo de una medicina de precisión individualizada también en la dermatitis atópica.
Mensajes para llevarse a casa
- Las fuentes de las citocinas IL-4, IL-13, IL-5 son las células Th2 y las células ILC-2, los mastocitos y los basófilos.
- La IL-4 se une a receptores de tipo I y de tipo II.
- La IL-13 sólo se une a los receptores de tipo II que se encuentran en la piel.
- La respuesta Th2 de la dermatitis atópica está fuertemente controlada por la IL-13, que activa el receptor de tipo II uniéndose a la cadena IL-13Rα.
- La IL-13 se expresa a un nivel más alto que la IL4 en pacientes con dermatitis atópica y se correlaciona con la gravedad de la enfermedad.

Literatura:
- Siegels D, Heratizadeh A, Abraham S, European Academy of Allergy, Clinical Immunology Atopic Dermatitis Guideline group, et al: European Academy of Allergy, Clinical Immunology Atopic Dermatitis Guideline group. Tratamientos sistémicos en el manejo de la dermatitis atópica: Una revisión sistemática y metaanálisis. Alergia. 2021;76: 1053-1076.
- Gandhi NA, Bennett BL, Graham NM, et al: Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15: 35-50.
- Mueller TD, Zhang JL, Sebald W, Duschl A: Estructura, unión y antagonistas en el sistema receptor de IL-4/IL-13. Biochim Biophys Acta. 2002;1592(3): 237-250.
- McCormick SM, Heller NM: Comentario: Receptores y señalización de IL-4 e IL-13. Citocinas. 2015; 75: 38-50.
- Bao K, Reinhardt RL: La expresión diferencial de la IL-4 y la IL-13 y su impacto en la inmunidad de tipo 2. Citocinas. 2015; 75: 25-37.
- Leung DY, Bieber T: Dermatitis atópica. Lancet 2003; 361: 151-160. [PubMed: 12531593]
- Bieber T: Interleucina-13: el objetivo de una citoquina subestimada en la dermatitis atópica. Revisión. Alergia 2020; 75: 54-62.
- Langan SM, Irvine AD, Weidinger S: Dermatitis atópica. Lancet. 2020; 396: 345-360.
- Tsoi J, Rodriguez E, Sarkar MK, et al: La dermatitis atópica es una enfermedad con IL-13 dominante y mayor heterogeneidad molecular que la psoriasis. J Invest Dermatol 2019;139: 1480-1489.
- Szegedi K, Lutter R, et al: Perfiles de citoquinas en el líquido intersticial de la piel de la dermatitis atópica crónica. JEADV 2015; 29: 2136-2144.
- Ungar B, Garcet S, González J, et al: Un modelo integrado de biomarcadores de la dermatitis atópica pone de relieve la naturaleza sistémica de la enfermedad. J Invest Dermatol 2017; 137: 603-613.
- Long H, Liao W, Wang L, Lu Q: Actor y coordinador: las funciones versátiles de los eosinófilos en el sistema inmunitario. Transfus Med Hemother. 2016; 43: 96-108.
- Mobasher P, Heydari Seradj M, Raffi J, et al: Pequeñas moléculas orales para el tratamiento de la dermatitis atópica: una revisión sistemática. J Dermatolog Treat. 2018; 201: 1-8.
- Mack MR, Kim BS: El ciclo picor-rascado: una perspectiva neuroinmune. Trends Immunol 2018; 39: 980-991.
- Datsi A, Steinhoff M, Ahmad F, et al.: Interleucina-31: La citoquina “picante” en la inflamación y la terapia. Alergia. 2021 Feb 24. doi: 10.1111/all.14791. Publicación electrónica antes de impresión.
- Dillon SR, Sprecher C, Hammond A, et al; La interleucina 31, una citoquina producida por células T activadas, induce dermatitis en ratones. Nat Immunol 2004;5: 752-760.
- Salimi M, Barlow JL, Saunders SP, et al: A role for IL-25 and IL-33- driven type-2 innate lymphoid cells in atopic dermatitis. J Exp Med. 2013; 210: 2939-2950.
- Moriya C, Jinnin M, Yamane K, et al: La expresión de la metaloproteinasa de matriz-13 está controlada por la IL-13 a través de PI3K/Akt3 y PKC-d en fibroblastos dérmicos humanos normales. J Invest Dermatol 2011; 131: 655-661.
- Howell MD, Kim BE, Gao P, et al: Modulación por citoquinas de la expresión cutánea de la filagrina de la dermatitis atópica. J Allergy Clin Immunol 2007; 120: 150-155.
- Kim BE, Leung DY, Boguniewicz M, Howell MD: La expresión de loricrina e involucrina es regulada a la baja por las citoquinas Th2 a través de STAT-6. Clin Immunol 2008; 126: 332-337.
- Berdyshev E, Goleva E, Bronova I, et al. Las anomalías lipídicas en la piel atópica están impulsadas por las citoquinas de tipo 2. JCI Insight. 2018;3(4). https://doi.org/10.1172/jci.insight.98006
- Oetjen LK, Mack MR, Feng J, et al: Las neuronas sensoriales cooptan las vías clásicas de señalización inmunitaria para mediar en el picor crónico. Cell 2017; 171: 217-228.
- Majumdar S, Ghosh A, Saha S: Modulación de las interacciones de las interleucinas y sus receptores con pequeñas sustancias químicas mediante un enfoque in silico para el asma. Curr Top Med Chem 2018; 18: 1123-1113.
- Gadina M, Le MT, Schwartz DM, et al: De las quinasas Janus a los jakinibs: de los conocimientos básicos a la práctica clínica. Reumatología. 2019;58(suppl 1): i4-i16.
- Rodrigues MA, Torres T: Inhibidores JAK/STAT para el tratamiento de la dermatitis atópica. J Dermatolog Treat. 2020; 31: 33-40.
- Cotter DG, Schairer D, Eichenfield L: Terapias emergentes para la dermatitis atópica: inhibidores JAK. J Am Acad Dermatol. 2018;78(suppl 1): S53-S62.
- Schwartz DM, Kanno Y, Villarino A, et al: La inhibición de JAK como estrategia terapéutica para las enfermedades inmunitarias e inflamatorias. Nat Rev Drug Discov 2017: 843-862.
- Información sobre el producto Olumiant® (baricitinib). www.swissmedicinfo.ch
- Información especializada Apoquel® (oclacitinib). www.tierarzneimittel.ch
- Información técnica Dupixent® (Dupilumab). www.swissmedicinfo.ch
- Chang HY, Nadeau KC. Inhibidor de la IL-4Ralfa para la enfermedad atópica. Celda. 2017;170:222.
- Beck LA, Thaçi D, Hamilton JD, et al: Tratamiento con dupilumab en adultos con dermatitis atópica de moderada a grave. N Engl J Med. 2014 Jul 10; 371: 130-139.
- Simpson EL, Bieber T, Guttman-Yassky E, et al: Dos ensayos de fase 3 de dupilumab frente a placebo en dermatitis atópica. N Engl J Med. 2016; 375: 2335-2348.
- Gonçalves F, Freitas E, Torres T: Inhibidores selectivos de la IL-13 para el tratamiento de la dermatitis atópica. Contexto de las drogas. 2021;10: 1-7.
- Ultsch M, Bevers J, Nakamura G, et al: Base estructural del bloqueo de la señalización por el anticuerpo anti-IL-13 Lebrikizumab. J Mol Biol. 2013; 425(8): 1330-1339.
- Guttman-Yassky E, Blauvelt A, Eichenfield LF, et al: Eficacia y seguridad del lebrikizumab, un inhibidor de la interleucina 13 de alta afinidad, en adultos con dermatitis atópica de moderada a grave: un ensayo clínico aleatorizado de fase 2b. JAMA Dermatol 2020 abr 1; 156(4): 411-420.
- Popovic B, Breed J, Rees DG, et al: La caracterización estructural revela el mecanismo del anticuerpo monoclonal tralokinumab neutralizante de la IL-13 como inhibición de la unión a IL-13Ralpha1 e IL-13Ralpha2. J Mol Biol 2017;429: 208-219.
- Wollenberg A, Howell MD, Guttman-Yassky E, et al: Tratamiento de la dermatitis atópica con tralokinumab, un mAb anti-IL-13. J Allergy Clin Immunol 2019; 143: 135-141.
- Wollenberg A, Blauvelt A, Guttman-Yassky E, et al: Tralokinumab para la dermatitis atópica de moderada a grave: resultados de dos ensayos de fase III aleatorizados, doble ciego, multicéntricos y controlados con placebo de 52 semanas de duración (ECZTRA 1 y ECZTRA 2). Br J Dermatol 2021; 184: 437-449.
- Silverberg JI, Toth D, Bieber T, et al: Tralokinumab más corticosteroides tópicos para el tratamiento de la dermatitis atópica de moderada a grave: resultados del ensayo ECZTRA 3 de fase III, doble ciego, aleatorizado, multicéntrico y controlado con placebo. Br J Dermatol 2021; 184: 450-463.
PRÁCTICA DERMATOLÓGICA 2021; 31(4): 10-14