En las enfermedades neurodegenerativas crónicas como la esclerosis múltiple, las células del SNC realizan diversas adaptaciones durante la neuroinflamación. Las células más importantes implicadas en este proceso inflamatorio son las células gliales, entre las que destacan los astrocitos. Se ha informado de que los astrocitos reactivos pierden su función de apoyo y adoptan una función tóxica a medida que avanzan las enfermedades.
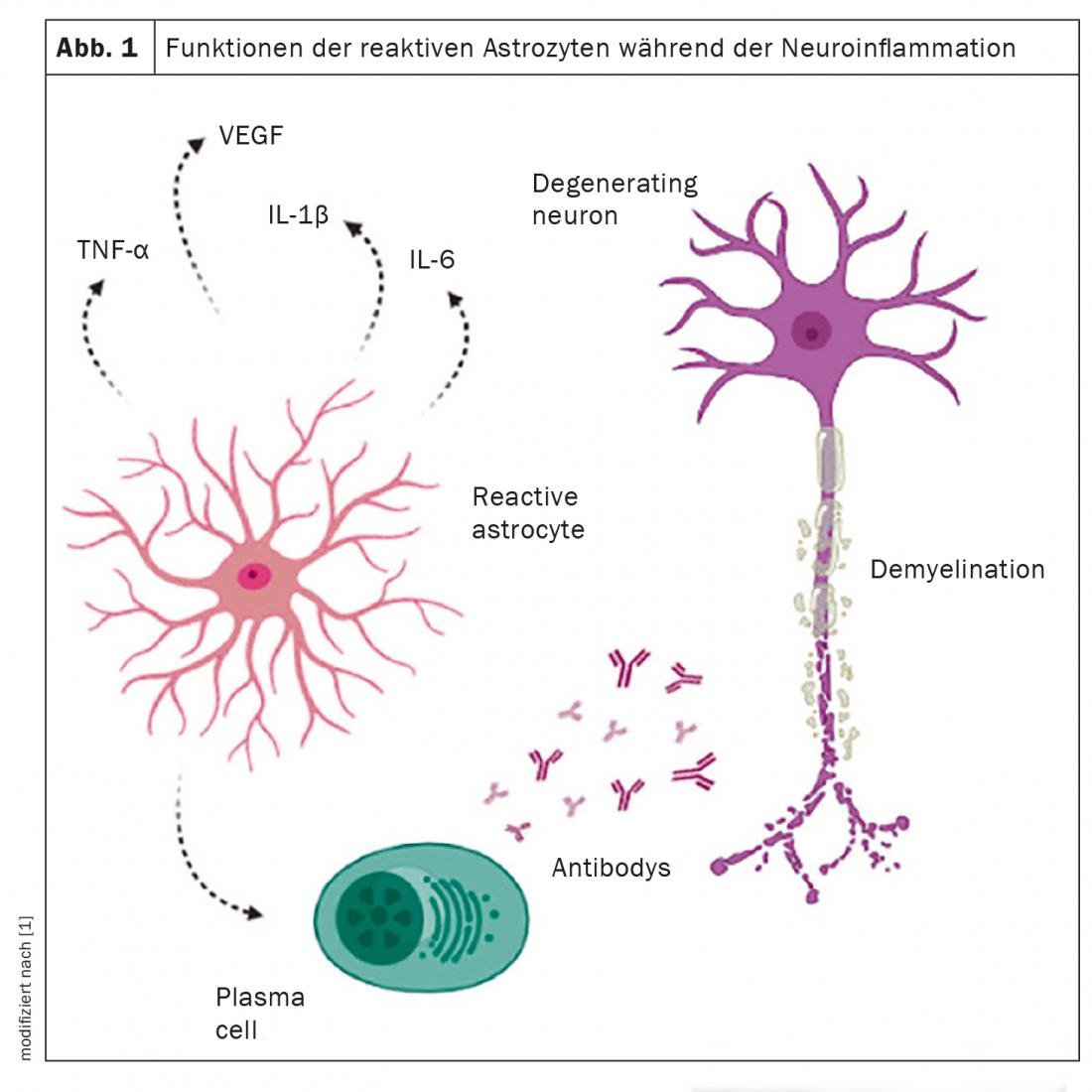
Los astrocitos son el grupo celular más abundante en todas las regiones del sistema nervioso central. Dependiendo del tipo de lesión, pueden segregar tanto citoquinas proinflamatorias (Th1, IL-1, IL-2, IL-6, IL-7 y TNF) como antiinflamatorias (Th2, IL-4, IL-10, IL-13 y TGFβ). Además, están asociadas a varias funciones fisiológicas, como la secreción de nutrientes, el mantenimiento del microambiente neuronal, la permeabilidad de la barrera hematoencefálica y el desarrollo de procesos patológicos en el cerebro. Los astrocitos desempeñan un papel complejo en la patogénesis de enfermedades neurodegenerativas como la esclerosis múltiple (EM). Varios estudios informan de que los astrocitos reactivos pierden su papel de apoyo y adquieren una función tóxica a medida que progresan estas enfermedades. Por ello, un artículo de revisión ha destacado las características clave de los astrocitos en el desarrollo de la EM para proporcionar una mejor comprensión de la enfermedad.
Las estrellas secretas del cerebro
Los astrocitos pertenecen a las células gliales, es decir, las células no excitables eléctricamente del sistema nervioso. Constan de muchas fibrillas entrelazadas cuya estructura se denomina filamento glial. Pueden dividirse en dos subtipos principales, denominados fibrosos o protoplásmicos, en función de las diferencias en su morfología celular y en el contenido de filamentos gliales. Los astrocitos fibrosos se localizan principalmente en la sustancia blanca y tienen fibras largas con muchos filamentos gliales en el citoplasma. Los astrocitos protoplásmicos, por su parte, están muy extendidos en la materia gris y tienen ramas gruesas. La formación de unidades neurovasculares se produce a través de procesos astrocíticos, ya que estas células actúan como puente entre las neuronas y los vasos sanguíneos. Además, las células astrocíticas pueden proporcionar estructuras y apoyo metabólico a las neuronas y desempeñan un papel importante en la regulación de la supervivencia neuronal, la formación de sinapsis y la distribución de los canales iónicos.
Los podocitos astrocíticos rodean estrechamente a las células endoteliales y son fundamentales para la estructura de la barrera hematoencefálica debido a su capacidad para formar uniones estrechas y a su alto contenido mitocondrial. A través de sus interacciones con los componentes de la barrera hematoencefálica (BHE), los astrocitos no sólo regulan su funcionamiento, sino que también reconocen las moléculas producidas por las células inmunitarias periféricas, incluidas las citocinas. También expresan numerosos receptores que les permiten responder a compuestos neuroactivos como neurotransmisores, neuropéptidos, factores de crecimiento, citoquinas y toxinas.
Su papel en el curso de la EM
La principal característica patológica de la EM es la presencia de lesiones inflamatorias focales y desmielinización causadas por la respuesta inmunitaria. El papel que desempeñan los astrocitos en el desarrollo de estas lesiones es activo y diverso, con varios cambios funcionales, como la alteración de la permeabilidad de la barrera hematoencefálica, que promueve una respuesta inmunitaria desregulada al sistema nervioso central.
Los astrocitos responden a las lesiones del SNC con un complejo proceso de activación que implica cambios morfológicos, transcripcionales y bioquímicos, así como cambios funcionales asociados a una reducción de las funciones metabólicas homeostáticas. Esto va acompañado de un aumento de la expresión de la proteína ácida del filamento intermedio de la fibrilla glial (GFAP), que por lo tanto sirve como marcador de los astrocitos reactivos. Dado que reaccionan a los cambios de su entorno, es difícil distinguir entre una célula normal y un astrocito reactivo. Un astrocito reactivo es la célula que ha reaccionado ante una enfermedad o un cambio tisular. Los astrocitos están presentes en los márgenes activos de las lesiones desmielinizantes y desempeñan un papel clave en la eliminación de la mielina dañada. Estas células son hipertróficas, tienen núcleos grandes y su citoplasma puede contener filamentos intermedios gliales y restos celulares. En las lesiones crónicas, el borde periférico astrocítico muestra una desmielinización activa y puede causar más daños inflamatorios que contribuyan a la progresión de la enfermedad.
Sin embargo, los astrocitos desempeñan un doble papel: no sólo contribuyen a la degeneración axonal y a la desmielinización, sino que también crean un entorno favorable que favorece la remielinización. Sin embargo, la influencia de los astrocitos en la patogénesis y la reparación del proceso inflamatorio depende de varios factores, como el momento posterior a la lesión, el tipo de lesión, el microambiente circundante, la interacción con otros tipos de células y los factores que influyen en su activación. Los diversos factores neurotróficos, citocinas y factores de crecimiento que aportan los astrocitos facilitan el importante proceso de reparación en la EM. Además, los astrocitos apoyan aún más la remielinización reclutando macrófagos/microglia, que se encargan de eliminar los restos de mielina de los lugares de la lesión desmielinizada, permitiendo así la formación de mielina nueva.
Los astrocitos como diana terapéutica
Dada la importancia de los astrocitos en la patogénesis de la EM, ofrecen una atractiva diana terapéutica. Ninguno de los tratamientos aprobados actualmente se dirige específicamente a los astrocitos. Sin embargo, varias terapias han demostrado su efecto sobre ellos. El dimetilfumarato (DMF) inhibe la activación proinflamatoria de los astrocitos, incluida la señalización NF-κB, y activa el factor de transcripción Nrf2, que regula la respuesta antioxidante en los astrocitos. El fingolimod actúa sobre los astrocitos inhibiendo la señalización NF-κB, reduciendo la expresión de citoquinas proinflamatorias y aumentando los factores neurotróficos. El laquinimod reduce la señalización NF-κB y las respuestas proinflamatorias de los astrocitos. El acetato de glatiramero (AG) induce la expresión de IL-10 y del factor de crecimiento transformante (TGF-β) por los astrocitos, restaura las conexiones perivasculares de los astrocitos con los vasos sanguíneos y las sinapsis neuronales e inhibe el TNF-α.
Fuente:
- Salles D, Spindola Samartini R, de Seixas Alves MT, et al: Funciones de los astrocitos en la esclerosis múltiple: una revisión. Esclerosis múltiple y trastornos relacionados 2022; 60: 103749.
Para saber más:
- Aharoni R, Eilam R, Arnon R, et al: Astrocitos en la esclerosis múltiple: componentes esenciales con diversas funciones polifacéticas. Int J Mol Sci 2021; 22: 11.
- Ambrosini E, Remoli ME, Giacomini E, et al: Los astrocitos producen quimiocinas atrayentes de células dendríticas in vitro y en lesiones de esclerosis múltiple. J Neuropathol Exp. Neurol 2005; 64(8): 706-715.
- Batiuk MY, Martirosyan A, Wahis J, et al: Identificación de subtipos de astrocitos específicos de una región a resolución unicelular. Nat Commun 2020; 11: 1220.
InFo NEUROLOGíA Y PSIQUIATRÍA 2022; 20(3): 35-35.