El primer paso en la prescripción de la terapia de inhalación es la elección óptima del dispositivo. Debe basarse en los factores del paciente (capacidad de cooperación, flujo inspiratorio alcanzable y gravedad de la obstrucción) y en el conocimiento de las condiciones físico-técnicas del aparato. Es importante una buena instrucción y una revisión periódica de la terapia de inhalación. En la EPOC (enfermedad pulmonar obstructiva crónica) con obstrucción de moderada a grave, la primera elección para la terapia inhalatoria es un preparado combinado LAMA/LABA, que produce una mejora funcional y una reducción de la tasa de exacerbaciones. Los corticoides tópicos sólo deben considerarse en caso de indicación clara (componente asmático) o de resultados insatisfactorios con LAMA/LABA en FEV1 <50% en forma de terapia triple. La terapia básica para el asma bronquial es una combinación de CSI/LABA con dosis de CSI ajustadas a los síntomas. Con Symbicort, también es posible la terapia según el principio SMART (“Terapia de mantenimiento y alivio Symbicort”).
Durante mucho tiempo, sólo se disponía de unos pocos fármacos para el tratamiento del asma bronquial y la EPOC, pero en pocos años el número de sustancias, combinaciones y formas de dosificación ha aumentado enormemente. Especialmente en el tratamiento de la EPOC, los avances han sido tan rápidos que resulta difícil para los no especialistas obtener una visión general actualizada.
Estamos acostumbrados a pensar en la elección del medicamento, la dosis y los intervalos de administración, así como en las posibles interacciones. Con la terapia de inhalación, también debe elegirse la forma óptima de administración. Es bien sabido que el cumplimiento de las terapias inhaladas suele ser deficiente; a menudo se cometen errores de aplicación, por lo que el tratamiento no resulta eficaz [1]. Esta circunstancia debe tenerse en cuenta a la hora de elegir una terapia.
Influencia de los factores dependientes de las partículas y del paciente
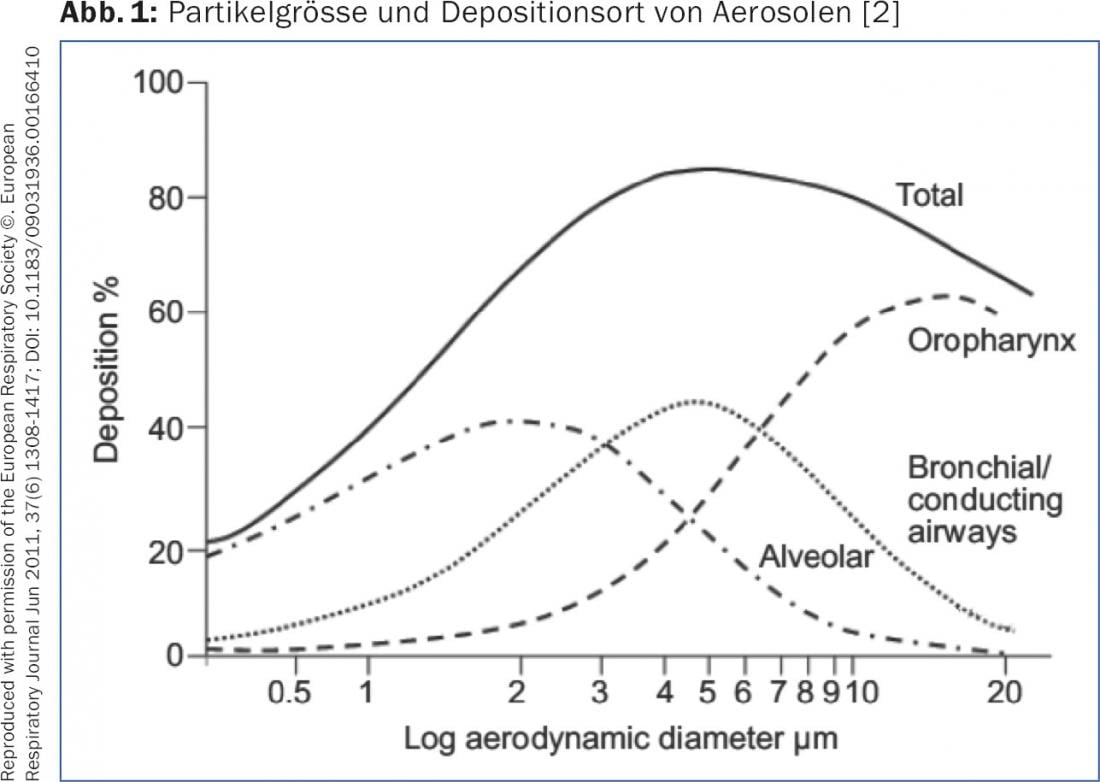
La deposición de un aerosol en las vías respiratorias, así como de las partículas de un inhalador de polvo, depende del tamaño de las partículas (“Diámetro aerodinámico medio de la masa” [MMAD]) y del flujo inspiratorio. Las partículas con una MMAD de >5 μm sólo alcanzan las vías respiratorias centrales y no, como sería deseable, las periféricas. Las partículas con una MMAD de 1-5 μm, la llamada “fracción de partículas finas” (FPF), entran en las vías respiratorias medias y pequeñas -como se desea para la terapia con broncodilatadores o esteroides tópicos- y se depositan aquí por sedimentación. Las partículas muy pequeñas con una MMAD de <1 μm llegan a los alvéolos por difusión o son exhaladas de nuevo (fig. 1). Para asegurar una buena sedimentación de las partículas, la respiración debe mantenerse durante 5-10 seg al final de la inhalación. ser detenido. Para optimizar la deposición de un aerosol dosificado (DA) con o sin cámara ascendente, el adulto debe ser tratado durante 4-5 seg. ser inhalado. Esto garantiza un caudal óptimo de aproximadamente 30 l/min. Con un inhalador de polvo, inhale lo más profunda y firmemente posible para generar suficiente FPF. Debe crearse un flujo turbulento dentro del dispositivo, que disgregue las partículas y genere las partículas finas deseadas [2,3]. Además, la enfermedad pulmonar existente influye en la deposición del aerosol. En caso de trastorno obstructivo grave de la ventilación o “taponamiento mucoso”, se depositan muchas menos partículas periféricamente. Los broncodilatadores desarrollan su mayor efecto en las vías respiratorias medias (las llamadas “vías respiratorias conductoras”), mientras que los corticosteroides probablemente se distribuyen mejor de forma uniforme a la periferia, ya que los cambios inflamatorios se manifiestan en las vías respiratorias más pequeñas.
Para que la terapia de inhalación sea eficaz, no sólo debe realizarse con regularidad, sino también de forma técnicamente correcta. Múltiples estudios han demostrado que sólo alrededor del 30% de los pacientes utilizan su inhalador MDI o de polvo de forma óptima, otro 40% lo hace de forma aceptable, pero cerca del 30% lo utiliza con una técnica inadecuada [4,5]. Una buena instrucción y un control regular de la técnica de inhalación son factores esenciales para el éxito de la terapia de inhalación. Los pacientes de edad avanzada, en particular, no suelen utilizar correctamente sus inhaladores a pesar de haber recibido buenas instrucciones. Por lo tanto, la elección de la terapia de inhalación debe basarse también en las capacidades del paciente. Si es posible, no deben prescribirse sistemas diferentes al mismo tiempo. La prescripción de preparados combinados es útil para simplificar la terapia. Una vez que el paciente domina el uso de un inhalador, no se le debe cambiar a otro sin una buena razón.
Dispositivos de inhalación disponibles
Inhaladores dosificadores (DA): Los DA han sido la vía de administración más popular desde la década de 1950. El recipiente está bajo presión, el medicamento y el propelente están en forma líquida. El clorofluorocarbono (CFC) utilizado anteriormente como propelente ha sido sustituido por hidrofluoroalcanos (HFA) en todos los DA desde la prohibición. En comparación con el CFC-DA anterior, la velocidad de descarga del HFA-DA es algo menor, la sensación de frío (el llamado efecto freón) algo menor. La velocidad de descarga y el efecto refrigerante pueden reducirse aún más añadiendo algo de alcohol, como ocurre en Foradil®, Alvesco® y Qvar®. La mayoría de los DA están disponibles en forma de dispersión, por lo que es necesario agitarlos antes de utilizarlos. Las excepciones son los esteroides tópicos Alvesco® (ciclesonida) y Qvar® (diproprionato de beclometasona), en los que el fármaco se disuelve en el propelente. Estos DA producen partículas significativamente más pequeñas de sólo 1,2 μm MMAD (“partículas extrafinas”) con una mejor deposición periférica a una velocidad de salida significativamente menor. Para la primera utilización y la no utilización durante varios días, todos los DA deben prepararse pulverizándolos dos veces en el ambiente. Los DA convencionales deben utilizarse con una cámara aguas arriba para superar el problema de la alta velocidad de salida y la difícil coordinación. La deposición pulmonar puede así aumentar del 15 al 40% aproximadamente. Los DA con fármaco disuelto consiguen una deposición muy buena de hasta el 60% incluso sin cámara previa. No obstante, para minimizar los problemas de coordinación, se suele recomendar el uso de una cámara aguas arriba. Las antiguas cámaras de interconexión de gran tamaño han desaparecido; hoy en día sólo se utilizan cámaras de interconexión antiestáticas más pequeñas, como la Aerochamber plus® o la Vortex®. Ventolin DA como medicación de emergencia para sobre la marcha también puede utilizarse sin precámara como compromiso, pero no en la consulta o en la sala de urgencias como para comprobar la reversibilidad en la espirometría.
Inhaladores de polvo seco ( [DPI]): En los últimos años se han introducido varios DPI nuevos. Todos requieren un flujo de inspiración diferente de un producto a otro para generar las partículas [6]. Sin embargo, siempre es mayor que con un DA. La mayoría de los pacientes son capaces de generar un flujo de inspiración suficiente. En caso de hiperinsuflación grave, la capacidad de proporcionar un volumen inspiratorio suficiente para inhalar toda la cantidad de medicamento es más problemática. Esto puede compensarse con los sistemas de cápsulas inhalando dos veces. Además, los DPI difieren en su resistencia a la inhalación. Aunque una resistencia elevada dificulta la obtención de un flujo alto, la menor velocidad de inhalación resultante conduce a una deposición más homogénea. Los sistemas de cápsulas Handyhaler® (para Spiriva) y Breezhaler® (para Onbrez®, Seebri®, Ultibro®) son pequeños y manejables, pero insertar las cápsulas requiere cierta habilidad. El paciente debe saber que las cápsulas -cuando se introducen correctamente- desarrollan un sonido vibratorio al inhalarlas. Una ventaja de estos sistemas es que es posible comprobar si el paciente ha inhalado toda la cantidad de medicamento (cápsulas abiertas con el Handyhaler®, cápsulas transparentes con el Breezhaler®). Además de los sistemas de cápsulas, existen varios DPI multidosis. El Turbuhaler® (para Symbicort®, Pulmicort®, Bricanyl) está establecido desde hace años, es manejable y sencillo, pero es algo propenso a errores de manipulación, sobre todo en pacientes de edad avanzada. Pronto estará disponible en Suiza Turbu+®, un accesorio electrónico basado en una aplicación que se acopla al Turbuhaler y permite documentar sin problemas la terapia de inhalación a través de un teléfono inteligente. Es probable que el intuitivo Discus® (para Serevent®, Axotide®, Seretide®) esté siendo desplazado cada vez más por el aún más fácil de usar Ellipta® (para Anoro®, Relvar®, Incruse®, Arnuity®), que se carga automáticamente al abrir el tapón. El Gennuair® (para Eklira®) es el único DPI que garantiza un flujo inspiratorio suficiente, ya que el dispositivo sólo libera la dosis cuando se alcanza un flujo inspiratorio suficiente. DPI logran una deposición pulmonar satisfactoria de alrededor del 30%.
Inhalador de niebla suave: El sistema inhalador de niebla suave Respimat® (para Spiolto®, Striverdi® y próximamente también Spiriva®), un práctico inhalador multidosis, está disponible desde hace poco en Suiza. Con la ayuda de un mecanismo de resorte, la solución del fármaco se presiona a través de dos boquillas de silicona y se produce un aerosol muy fino. Se caracteriza por una baja velocidad de descarga y una nube de pulverización muy estable (hasta 1,5 seg.). No es necesario un gas propulsor. El Respimat® permite una inhalación relativamente lenta y exige menos coordinación que el DA habitual. A diferencia del DPI, el tamaño de las partículas es independiente del flujo inspiratorio. Se consigue una muy buena deposición pulmonar del 40-50% de la dosis liberada.
Inhalación húmeda: El uso de un dispositivo nebulizador en la actualidad debe limitarse a casos individuales, si no se puede obtener un resultado satisfactorio con los dispositivos enumerados anteriormente, y a situaciones de emergencia en EPOC y asma. El tamaño de las partículas viene determinado por la cabeza del nebulizador y el caudal aplicado. Sólo deben combinarse cabezales nebulizadores y compresores que hayan sido validados. Cuando se utiliza aire comprimido procedente de una conexión mural, el caudal óptimo para el cabezal nebulizador (normalmente 6-8 l/min.). Los nebulizadores con un sistema de válvula que impide la pérdida de aerosol al medio ambiente (por ejemplo, Pari LC Plus) aumentan la dosis disponible de medicación. Siempre que sea posible, los adultos deben inhalar con una boquilla en lugar de una mascarilla facial para evitar la función de filtrado no deseada de la nariz. Para la inhalación húmeda, sólo los broncodilatadores de acción corta y un esteroide tópico (Pulmicort® Respules) están disponibles.
Elección de la medicación
EPOC: El objetivo de la terapia para la EPOC es mejorar la función pulmonar, pero sobre todo el rendimiento físico y la calidad de vida. La reducción de la tasa de exacerbación también es esencial. Las exacerbaciones de la EPOC son un factor de pronóstico desfavorable [7]. Son la causa de costosas hospitalizaciones, resultan muy estresantes para los pacientes y merman enormemente su calidad de vida. Por este motivo, las recomendaciones actuales de tratamiento ya no se basan únicamente en la gravedad de la obstrucción, sino en una clasificación multidimensional de la EPOC, que se basa en la gravedad de la obstrucción, la disnea, medida con el sencillo “Cuestionario modificado del Consejo de Investigación Médica” (mMRC) (Tab. 1) o el Test de Evaluación de la EPOC (CAT), que utiliza ocho preguntas para evaluar los síntomas de la enfermedad [8]. La prueba da como resultado una puntuación de 0-40. El cuestionario CAT está disponible en varios idiomas y puede consultarse en línea [9]. El tercer factor determinante es la frecuencia de las exacerbaciones, hasta una exacerbación/año sin hospitalización es tolerable, se considera que los pacientes con ≥2 exacerbaciones o una hospitalización reciben un tratamiento insatisfactorio. En función de estos factores, los pacientes con EPOC pueden dividirse en cuatro grupos (A-D), en los que se basa la terapia (Fig. 2).
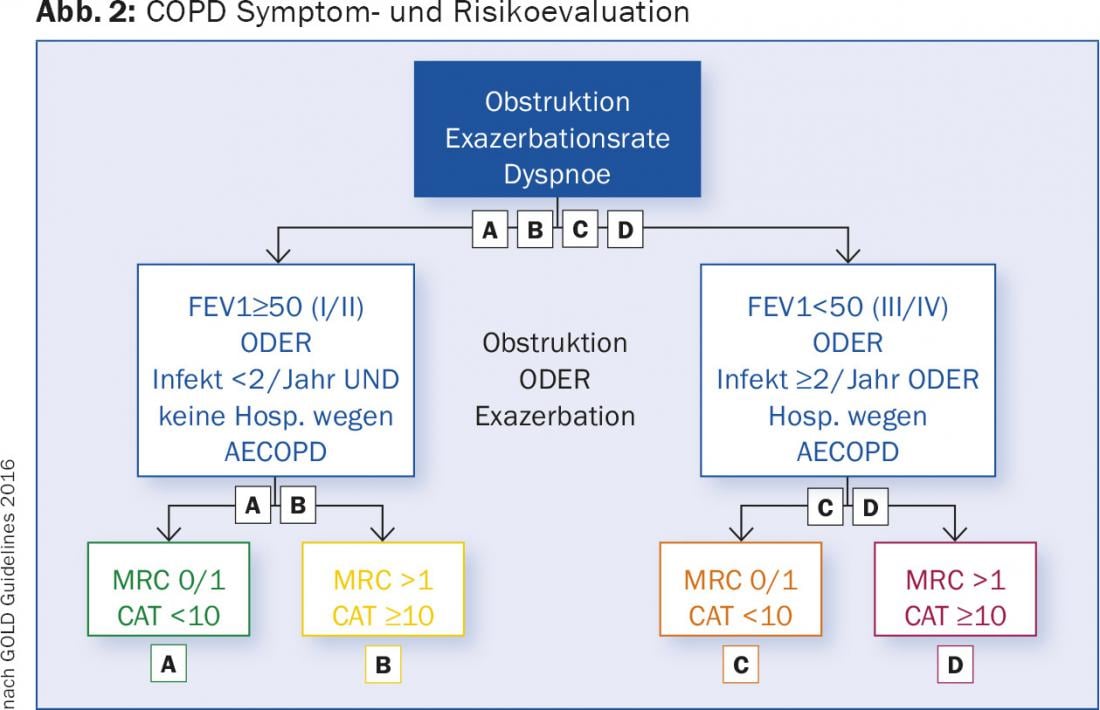
Las directrices de tratamiento se presentan de forma detallada y resumida en la página web de la “Iniciativa Global para la Enfermedad Pulmonar Obstructiva” [10]. Se utilizan las siguientes clases de fármacos: betamiméticos de acción corta (SABA), betamiméticos de acción prolongada (LABA), antimuscarínicos de acción prolongada (LAMA) y esteroides tópicos (ICS) (Tab. 2 y 3).
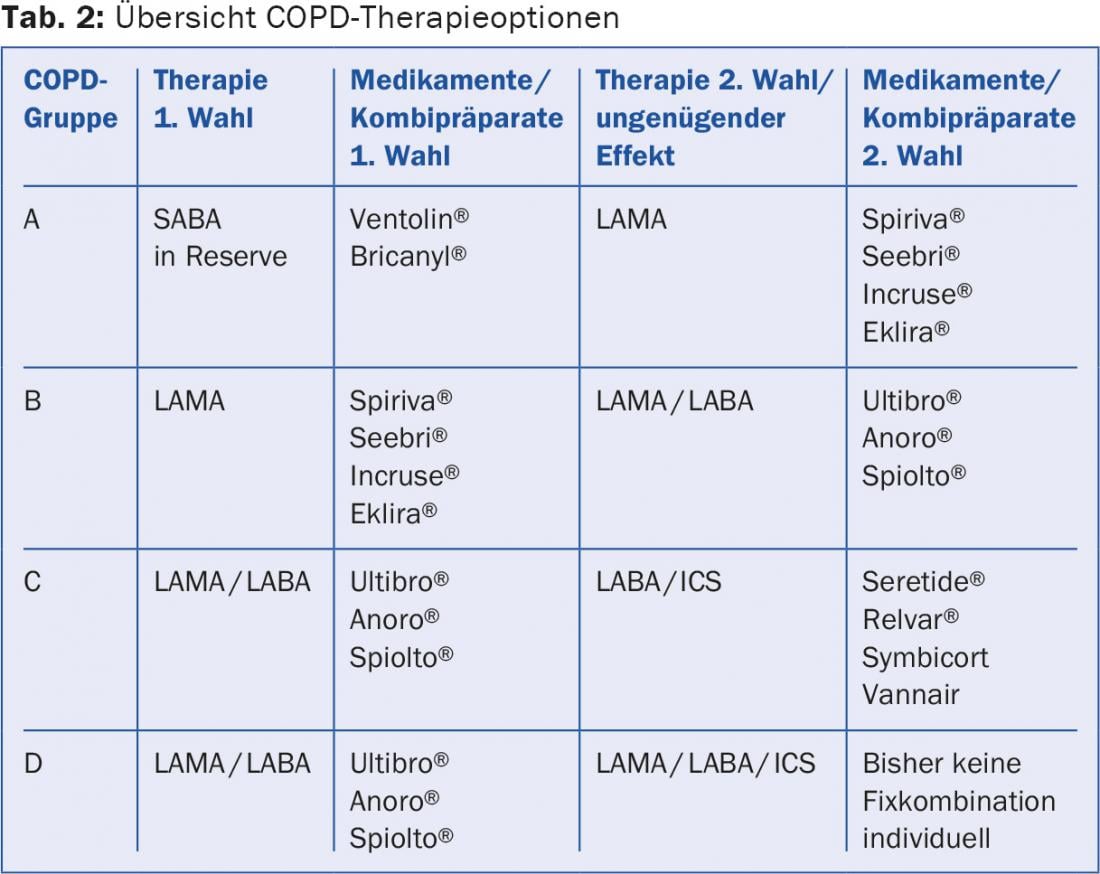
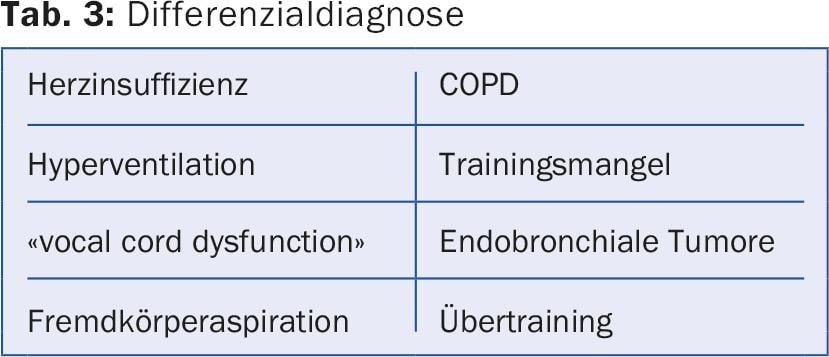
Todos los pacientes sintomáticos deben recibir un betamimético de acción corta (SABA) como medicación de urgencia. Esto es suficiente para los pacientes del grupo A. Los pacientes más sintomáticos con obstrucción moderada y sin exacerbaciones frecuentes (grupo B) reciben un LAMA como primera opción. Si el efecto es insuficiente o el paciente está muy sintomático, se utiliza directamente un preparado combinado LAMA/LABA. Múltiples estudios han demostrado que la combinación de LAMA/LABA es superior a la monoterapia y a la terapia combinada LABA/ICS en términos de mejora de la función pulmonar, capacidad de ejercicio y calidad de vida [11].
La importancia del SCI ha disminuido claramente en los últimos años. En cualquier caso, su uso sólo se discute en caso de un FEV1 <50 (-60)% del objetivo y exacerbaciones frecuentes. Todos los grandes estudios con CSI tuvieron que informar de un ligero aumento de la tasa de neumonía como efecto negativo. En los pacientes de los grupos C y D, la reducción de la tasa de exacerbaciones es un objetivo terapéutico importante. La combinación de LABA/ICS puede reducir la tasa de exacerbaciones a costa de una neumonía ligeramente más frecuente [12]. Pero no sólo los esteroides, también los LAMA y los LABA influyen favorablemente en el número de exacerbaciones. En una comparación directa, se demostró que la combinación LAMA/LABA (Ultibro®) no sólo era equivalente sino incluso superior a la combinación LABA/ICS (Seretide®) en términos de tasa de exacerbación [13]. Esto significa que se recomienda una combinación de LAMA/LABA como primera opción para los grupos 3 y 4. Los CSI están indicados si existen aspectos claros de asma bronquial adicional (alto grado de reversibilidad de la obstrucción, antecedentes de asma, eosinofilia), un denominado “síndrome de solapamiento asma EPOC” (SOC) o si no se tolera un broncodilatador. Los pacientes con un ligero aumento de los eosinófilos en sangre (>200 o 300/ μl) también pueden beneficiarse de los CSI. En los pacientes del grupo D gravemente sintomáticos, puede considerarse la terapia triple LAMA/LABA/ICS, además, por supuesto, de las medidas terapéuticas no inhalatorias. Se carece en gran medida de comparaciones directas dentro de las clases de sustancias, por lo que no se pueden formular preferencias claras.
Asma bronquial: A diferencia del tratamiento de la EPOC, el tratamiento del asma bronquial no ha cambiado significativamente en los últimos años. El objetivo de la terapia es lograr un control óptimo de los síntomas, una función pulmonar lo más normal posible y evitar las exacerbaciones [14,15]. Un cuestionario como el “Test de control del asma” (ACT) [16,17] ha demostrado su utilidad para evaluar el control de los síntomas.
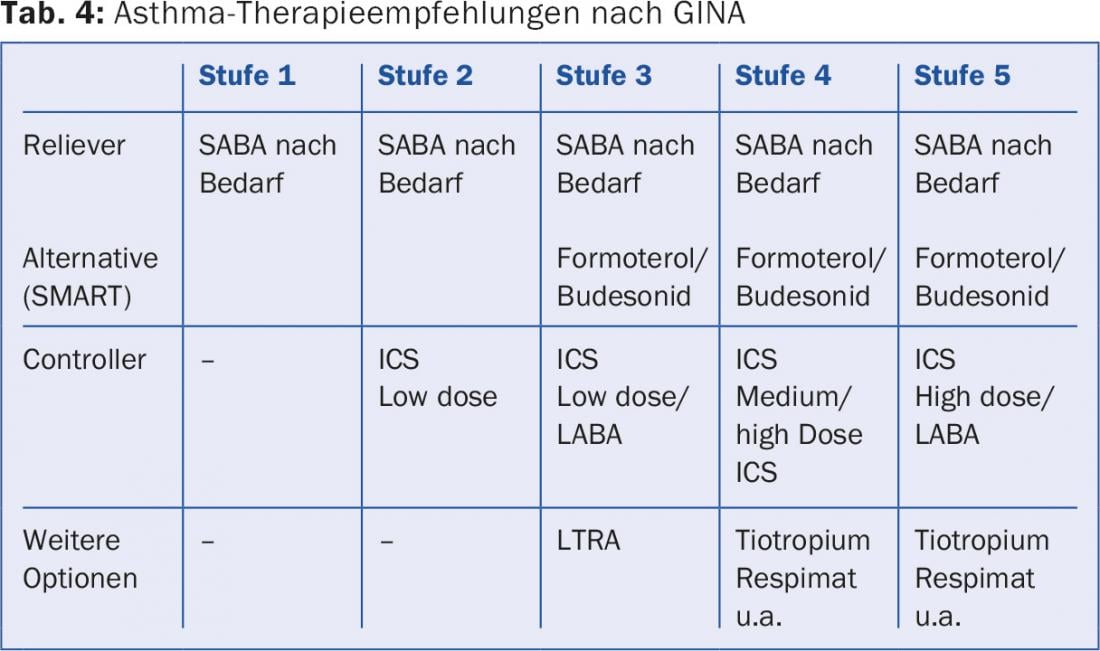
Todos los asmáticos reciben un SABA como medicación de emergencia (“aliviador”). Si no se necesita con una frecuencia superior a 2×/semana y con ella se alcanzan los objetivos de la terapia (nivel 1 de la GINA), no es necesaria más medicación. Si no es el caso, los ICS en dosis bajas (nivel GINA) se utilizan como controladores por el momento. 2) o, en caso de síntomas graves, como una combinación ICS/LABA (nivel GINA 3) con aumento de la dosis de CSI en caso de efecto insuficiente (nivel 4 de la GINA). Tácticamente, suele ser más inteligente empezar con una terapia intensiva para lograr rápidamente un buen control del asma y luego reducir la intensidad de la terapia: primero reducir la dosis de CSI y luego omitir el LABA (“step-up/step-down”). Una práctica de prescripción alternativa a partir de la fase 3 es el denominado principio SMART (“Terapia de mantenimiento y alivio con Symbicort “), que sólo es posible con un LABA de inicio de acción rápido como Symbicort® (formoterol/budesonida). Se prescribe una dosis base relativamente baja (Symbicort TH 200/6 2×1), con instrucciones para inhalar Symbicort adicional según sea necesario. Esto ajusta automáticamente la dosis de CSI a la necesidad del momento, y es posible un control idéntico del asma con una dosis de esteroides mayoritariamente moderada. El nuevo preparado combinado Relvar® (furoato de fluticasona/vilanterol) permite una dosis única. Spiriva®, previamente evaluado sólo para la EPOC, aplicado con Respimat®, puede añadirse como opción inhalada adicional (fuera de etiqueta) si el control del asma con LABA/ICS es insuficiente [18] (tab. 4).
Literatura:
- Braido F, et al: “Trying, But Failing” – The Role of Inhaler Technique and Mode of Delivery in Respiratory Medication Adherence. J Allerg Clin Immunol Pract 2016; 4: 823-832.
- Laube BL, et al: Lo que el especialista pulmonar debe saber sobre las nuevas terapias de inhalación. Eur Respir J 2011; 37: 1308-1331.
- Rothe T: Terapia inhalatoria – Parte 1: Física y sistemas. Foro Med Suiza 2014; 14: 402-406.
- Crompton GK, et al: La necesidad de mejorar la técnica de inhalación en Europa: un informe del Equipo de Mejora de la Gestión de Medicamentos en Aerosol. Respir Med 2006; 100: 1479-1494.
- Sanchis J, et al: Revisión sistemática de los errores en el uso de inhaladores. ¿Ha mejorado la técnica del paciente con el tiempo? PECHO 2016; 150(2): 394-406.
- Haidl P, et al: Requisitos de los dispositivos de inhalación para las maniobras de inhalación del paciente. Medicina respiratoria 2016; 118: 65-75.
- Soler-Cataluna JJ, et al: Exacerbaciones agudas graves y mortalidad en pacientes con enfermedad pulmonar obstructiva crónica. Tórax 2005; 60: 925-931.
- Jones PW: Prueba de evaluación de la EPOC: justificación, desarrollo, validación y rendimiento. J COPD 2013; 10(2): 269-271.
- www.catestonline.org
- www.goldcopd.org
- Vogelmeier CF, et al: Eficacia y seguridad de QVA149 una vez al día en comparación con salmeterol-fluticasona dos veces al día en pacientes con enfermedad pulmonar obstructiva crónica (ILLUMINATE): un estudio aleatorizado, doble ciego, de grupos paralelos. Lancet Respir Med 2013; 1: 51-60.
- Calverley PMA, et al: Salmeterol y propionato de fluticasona y supervivencia en la enfermedad pulmonar obstructiva crónica. N Engl J Med 2007; 356: 775-789.
- Wedzicha JA, et al: Indacaterol-glicopirronio frente a salmeterol-fluticasona para la EPOC. N Engl J Med 2016; 374: 2222-2234.
- www.ginasthma.org
- Reddel HK, et al: Resumen de la estrategia nex GINA: una hoja de ruta hacia el control del asma. Eur Respi J 2015; 46: 622-639.
- Schatz M, et al.: Prueba de control del asma: fiabilidad, validez y capacidad de respuesta en pacientes no seguidos previamente por especialistas en asma. J Allergy Clin Immunol 2006; 117: 549-556.
- www.asthmacontroltest.com/Europe/Switzerland/German
- Rodrigo GJ, et al: ¿Cuál es el papel del tiotropio en el asma?: una revisión sistemática con metaanálisis. Chest 2015; 147: 388-396.
PRÁCTICA GP 2016; 11(11): 24-30











