El Simposio sobre Esclerosis Múltiple celebrado en el Inselspital de Berna ofreció una amplia panorámica de la epidemiología, la etiología, el curso, la evaluación y la farmacoterapia actual de esta enfermedad. Existen hallazgos apasionantes procedentes de la investigación básica, que han identificado la citocina GM-CSF como una posible nueva diana terapéutica. La Encuesta sobre Discapacidades de la EM está estudiando actualmente herramientas electrónicas que puedan contribuir a la normalización en el futuro. La farmacoterapia sigue siendo un campo muy amplio: el perfil de efectos secundarios es el principal factor en la toma de decisiones.
El Dr. Christian Kamm, del Departamento Universitario de Neurología del Inselspital de Berna, hizo una breve introducción a la epidemiología de la esclerosis múltiple (EM). La EM es una enfermedad inflamatoria crónica del sistema nervioso central (enfermedad autoinmune). Suele constar de una fase inicial con reacciones inflamatorias que dan lugar a recaídas. Después, normalmente al cabo de 15-20 años, sigue la segunda fase secundaria progresiva y degenerativa (en parte todavía superpuesta por recaídas).
Por término medio, los afectados tienen unos 30 años (pico de incidencia entre los 20 y los 40 años). La prevalencia en Europa es de 83:100.000 – ha aumentado en los últimos años debido a la mayor esperanza de vida de las personas con EM y a los avances en el diagnóstico. Las mujeres suelen verse afectadas algo antes (de dos a cinco años) y también con mayor frecuencia. “La etiología exacta sigue sin estar clara, pero los factores ambientales y genéticos desempeñan un papel clave”, afirmó. Las influencias medioambientales se reflejan a veces en la diferente distribución de la enfermedad en función de la latitud: el riesgo de esclerosis múltiple disminuye a medida que aumenta la proximidad al ecuador, lo que a veces se explica por el metabolismo de la vitamina D [1]. El efecto de la sustitución de la vitamina D sigue sin estar claro, pero se está investigando actualmente en diversos estudios (el estudio SOLAR finalizará pronto).
Las comorbilidades vasculares (tabaquismo, etc.) también empeoran significativamente el curso. Cada vez más, su número se asocia a un mayor riesgo de progresión de la discapacidad, de pasar a la fase secundaria progresiva y de progresión y gravedad de la enfermedad en general. Las infecciones también desempeñan un papel. Un desencadenante bien conocido de la EM es el virus de Epstein-Barr. Los niños y los adolescentes están especialmente expuestos a los factores de riesgo medioambientales. Quienes contraen la fiebre glandular al final de la adolescencia tienen un mayor riesgo de padecer EM.
El componente genético se refleja a veces en el hecho de que los familiares de un paciente tienen más probabilidades de desarrollar la enfermedad en comparación con la población general (el riesgo relativo en los familiares de primer grado es de aproximadamente 9,2). Existen correlaciones con el denominado antígeno leucocitario humano (HLA). Los estudios de población también han demostrado que la incidencia de la enfermedad también difiere entre etnias expuestas a influencias medioambientales comparables.
¿El GM-CSF como nueva diana terapéutica?
Prof. Dr. rer. nat. Burkhard Becher, del Instituto de Inmunología Experimental de la Universidad de Zúrich, abordó, entre otros temas, el papel de la citocina proinflamatoria GM-CSF. Esto es esencial para el desarrollo de la EM en ratones. Para aclarar el papel del GM-CSF en la patogénesis de la EM humana, se analizó la sangre de pacientes con EM o de donantes sanos, se aislaron los glóbulos blancos y se analizaron las citocinas producidas. Los estudios ilustran que el número de células T productoras de GM-CSF está muy aumentado en los pacientes con EM. Y: cuanto más grave es la actividad de la enfermedad, más células producen GM-CSF. Ésta es inducida por la interleucina 2 (IL-2), lo que a su vez convierte al receptor de la IL-2 en un gen de riesgo de EM. Se ha demostrado que los donantes sanos con este gen de riesgo (polimorfismo en el gen del receptor IL-2-α) tienen más células T productoras de GM-CSF que los donantes con el gen sin riesgo [2]. Pero, ¿cómo puede trasladarse este hallazgo a la clínica? “Por ejemplo, con un anticuerpo contra el GM-CSF como el MOR103 [3]”, explicó el Prof. Becher. “El futuro mostrará si estamos ante un nuevo candidato para la terapia de la EM”.
Discapacidades en la EM: ¿cómo medirlas?
Las discapacidades en la EM fueron el tema de la conferencia del Dr. med. Christian Kamm, de la Clínica Universitaria de Neurología del Inselspital de Berna. La denominada “ausencia de evidencia de actividad de la enfermedad” (NEDA) se define actualmente mediante tres parámetros: ausencia de recaídas, ausencia de progresión de la EDSS, ausencia de actividad de la RM. A veces se discute la integración de los factores “atrofia cerebral” y “cognición” en este concepto. La Escala Expandida del Estado de Discapacidad (EDSS) sigue siendo el patrón oro para medir la discapacidad en la EM (normalizada electrónicamente en neurostatus.net). La gravedad de la discapacidad se evalúa en siete sistemas funcionales (visual, tronco encefálico, piramidal, cerebelo, sensorio, intestino/vejiga, función mental). Además, hay información sobre la capacidad de caminar. La escala empieza en 0 y llega hasta 10. Los puntos débiles de la EDSS son: Variabilidad en el examen neurológico, en la percepción del examinador y limitaciones naturales de la percepción humana. Actualmente se están probando herramientas de evaluación digital (por ejemplo, con la cámara Kinect®), con las que en el futuro se podrían evaluar las funciones motoras en la EM de forma más precisa y estandarizada (proyecto ASSESS-MS).
A partir de un valor de 4,5, la EDSS casi sólo tiene en cuenta la distancia caminada y, por tanto, presenta ciertas limitaciones que pueden subsanarse con pruebas adicionales. La capacidad funcional de las extremidades superiores, por ejemplo, debe probarse por separado, ya que cada vez está más limitada en EDSS avanzados. La llamada prueba de la clavija de nueve agujeros (9HPT) evalúa el tiempo que tarda el paciente en colocar nueve clavijas en los agujeros designados y volver a retirarlas. Según el ponente, esta prueba es fiable, válida y suficientemente sensible para evaluar la destreza manual en pacientes con EM. Existen datos normativos en función de la edad, el sexo y la condición de diestro o zurdo [4]. Mientras que el 9HPT sigue necesitando varios utensilios, la Tarea de Rotación de Monedas (CRT) desarrollada en Berna sólo requiere una moneda de 50 céntimos. Aquí, los pacientes tienen que girar la moneda lo más rápido posible entre el pulgar, el índice y el dedo corazón (más de 19 s para 20 medias inversiones es patológico) [5]. “El CRT es comparable al 9HPT y al Action Research Arm Test (ARAT), pero ya no es igual de factible para una EDSS de alrededor de 7”, explicó el Dr. Kamm.
La cognición también está infrarrepresentada en la EDSS, aunque alteraciones como los déficits de memoria, atención o concentración se encuentran entre los principales síntomas de la EM (prevalencia del 43-65%). La Prueba de Modalidades Digitales Simbólicas (SDMT) puede considerarse un complemento práctico [6].
Estado de la farmacoterapia
En las tablas 1 y 2 se ofrece una visión general de la terapéutica de la EM. Según el Prof. Dr. med. Heinrich Mattle, de la Clínica Universitaria de Neurología del Inselspital de Berna, los estudios controlados aleatorizados demuestran que las lesiones por RM son el principal motor de los déficits neurológicos, por lo que deben prevenirse terapéuticamente. En la EM remitente-recurrente, las lesiones se encuentran inicialmente sobre todo en la sustancia blanca, y en la forma secundaria progresiva cada vez más también en la sustancia gris [7]. Esto es entonces crucial para la discapacidad a largo plazo, como aclaró el Prof. Nicola De Stefano, médico de la Universidad de Siena, en su conferencia anterior [8].
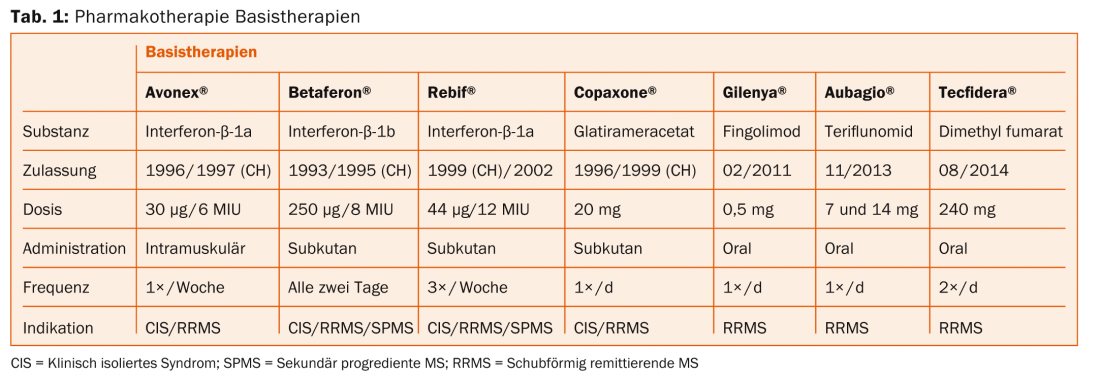
“Por lo tanto, la terapia debe realizarse lo antes posible para mejorar el resultado a largo plazo. Pero también se aplica el principio de “Primum nihil nocere” (“Primero no hacer daño”), es decir, encontrar el equilibrio óptimo entre efecto y efectos secundarios”, explicó el profesor Mattle.
Fármacos inyectables (Betaferon®, Rebif®, Avonex®, Copaxone®): Necesita inyecciones regulares. Los posibles efectos secundarios son reacciones cutáneas o sistémicas. Sin embargo, no existen efectos secundarios graves a largo plazo. “Aún no conocemos los efectos de los nuevos fármacos después de 20 años. Aquí es donde mejor se investigan los agentes inyectables”, subrayó el profesor Mattle. En un futuro próximo, también llegará al mercado suizo el β-interferón pegilado (peginterferón-β-1a) (estudio ADVANCE [9]), que debe inyectarse con menos frecuencia que los demás principios activos.
Fingolimod (Gilenya®): La administración es oral, una vez al día. El principio activo puede provocar efectos secundarios cardíacos (se requiere vigilancia en la primera administración). El edema macular y las infecciones por virus del herpes también son posibles pero poco frecuentes. El fármaco está contraindicado en el embarazo. Para los pacientes con riesgo de tumores cutáneos malignos, se aconseja precaución o un seguimiento dermatológico regular para estar seguros (aunque las preocupaciones a este respecto no están claramente establecidas).
Teriflunomida (Aubagio®): La administración es oral, una vez al día. En la primera mitad del año, se requiere un control de las enzimas hepáticas cada dos semanas, tras lo cual basta con un control cada ocho semanas. Los posibles efectos secundarios son náuseas, diarrea y alopecia. Un método anticonceptivo fiable es un requisito previo para la terapia.
Fumarato de dimetilo (Tecfidera®): El principio activo se administra por vía oral dos veces al día (lo que puede limitar la adherencia). Los análisis de sangre deben realizarse antes del inicio del tratamiento, a los tres y seis meses y después cada seis a doce meses. Los posibles efectos secundarios incluyen rubor, dolor abdominal y diarrea. También en este caso, la anticoncepción es un requisito previo.
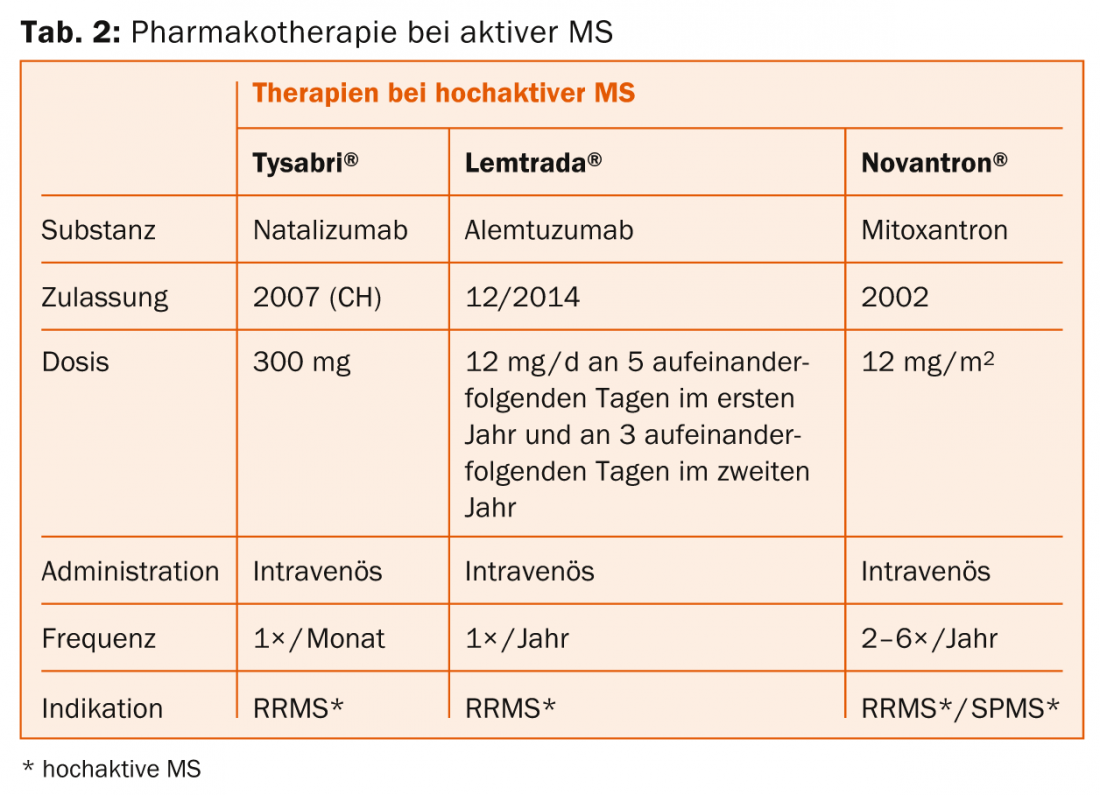
Natalizumab (Tysabri®): El principio activo se administra cómodamente una vez al mes mediante infusión. Un riesgo importante es la leucoencefalopatía multifocal progresiva (LMP) en pacientes con el virus JC, razón por la que es necesaria la detección de anticuerpos.
Alemtuzumab (Lemtrada®): La sustancia activa se administra convenientemente dos veces en dos años mediante series de infusión. Pueden producirse reacciones graves a la infusión. También hay que mencionar el riesgo de desarrollar otras enfermedades autoinmunes (incluidas las tiroideas o renales) o trombocitopenia inmunitaria.
Aplicación en la práctica
En el momento del suceso (enero de 2015), Berna seguía el siguiente régimen de tratamiento para la EM remitente-recidivante:
Primera línea: Dependiendo de los efectos secundarios y de la actividad de la enfermedad, se utiliza interferón-β, acetato de glatiramero, teriflunomida, dimetilfumarato o fingolimod. Para la EM muy activa, puede considerarse el natalizumab y el alemtuzumab.
Segunda línea: Si existe actividad, se elige entre dimetilfumarato, fingolimod, natalizumab o alemtuzumab (posiblemente también mitoxantrona).
Tercera línea: Natalizumab y alemtuzumab (posiblemente también mitoxantrona) están inicialmente disponibles aquí. Los fármacos que no están aprobados en Suiza para esta indicación, como el rituximab o el daclizumab, o el trasplante autólogo de células madre, son procedimientos experimentales (también para las formas muy activas).
Existen más datos sobre la EM secundaria progresiva que sobre la forma degenerativa primaria, pero en general la situación de la investigación es peor que en el caso de la EM recurrente-remitente. Rebif® ha demostrado ser más eficaz contra la EM secundaria progresiva en aquellos pacientes que siguen experimentando recaídas clínicas [10]. Betaferon® también beneficia más a los pacientes con actividad de recaída y progresión significativa de la discapacidad (cambio en la EDSS >1, dos años antes de la entrada en el estudio) [11].
Sativex® puede utilizarse como terapia sintomática. Se utiliza para la mejora de los síntomas en pacientes con espasticidad de moderada a grave.
Fuente: Simposio sobre esclerosis múltiple, 8 de enero de 2015, Berna
Literatura:
- Ascherio A, et al: La vitamina D como predictor precoz de la actividad y la progresión de la esclerosis múltiple. JAMA Neurol 2014 Mar; 71(3): 306-314.
- Hartmann FJ, et al: El polimorfismo IL2RA asociado a la esclerosis múltiple controla la producción de GM-CSF en las células TH humanas. Nat Commun 2014 Oct 3; 5: 5056. doi: 10.1038/ncomms6056.
- Korolkiewicz RP, et al: Estudio de fase Ib para evaluar MOR103 en la esclerosis múltiple. NCT01517282. En línea en: https://clinicaltrials.gov/ct2/show/study/NCT01517282.
- Oxford Grice K, et al: Adult norms for a commercially available Nine Hole Peg Test for finger dexterity. Am J Occup Ther 2003 Sep-Oct; 57(5): 570-573.
- Heldner MR, et al: Tarea de rotación de monedas: una prueba válida para la destreza manual en la esclerosis múltiple. Phys Ther 2014 Nov; 94(11): 1644-1651.
- Van Schependom J, et al: La prueba de modalidades de dígitos simbólicos como prueba centinela del deterioro cognitivo en la esclerosis múltiple. Eur J Neurol 2014 Sep; 21(9): 1219-1225, e71-72.
- Kutzelnigg A, et al: Desmielinización cortical y lesión difusa de la sustancia blanca en la esclerosis múltiple. Cerebro 2005 Nov; 128(Pt 11): 2705-2712.
- Filippi M, et al: El daño en la materia gris predice la acumulación de discapacidad 13 años después en la EM. Neurología 2013 Nov 12; 81(20): 1759-1767.
- Calabresi PA, et al: Interferón β-1a pegilado para la esclerosis múltiple remitente-recurrente (ADVANCE): un estudio aleatorizado, de fase 3 y doble ciego. Lancet Neurol 2014 jul; 13(7): 657-665.
- Secondary Progressive Efficacy Clinical Trial of Recombinant Interferon-Beta-1a in MS (SPECTRIMS) Study Group: Randomized controlled trial of interferon- beta-1a in secondary progressive MS: Clinical results. Neurología 2001 Jun 12; 56(11): 1496-1504.
- Kappos L, et al: Interferón beta-1b en la EM secundaria progresiva: un análisis combinado de los dos ensayos. Neurología 2004 Nov 23; 63(10): 1779-1787.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2015; 13(2): 36-39