Debido a su especial función protectora del organismo, la piel es una excepción en el proceso de envejecimiento: Como frontera mecánica y biológica entre los órganos internos y el medio ambiente, la piel está además expuesta diariamente a multitud de influencias exógenas, que no sólo actúan una vez y de forma directa (lesión), sino también de forma repetitiva y con gran latencia. Por ello, se distingue entre envejecimiento intrínseco y extrínseco de la piel.
El envejecimiento intrínseco suele denominarse también envejecimiento cronológico o genético, el extrínseco envejecimiento exógeno o prematuro y, si la luz ultravioleta es el agente nocivo exógeno, también envejecimiento lumínico. Morfológicamente, el envejecimiento intrínseco de la piel no siempre puede separarse claramente del envejecimiento extrínseco. Ambos procesos discurren en paralelo, y el envejecimiento extrínseco de la piel puede anular el intrínseco en distintos grados en diferentes partes del cuerpo.
Dado que los mecanismos subyacentes del envejecimiento intrínseco y extrínseco son similares y que las características bioquímicas, morfológicas y clínicas del envejecimiento cutáneo pueden derivarse directamente de los patomecanismos, se presentarán primero algunos aspectos específicos. Algunos factores extrínsecos se destacan por separado.
La importancia de las especies reactivas del oxígeno [1, 2].
Las especies reactivas del oxígeno (ROS) desempeñan un papel central en el envejecimiento de la piel. Según la teoría de los radicales libres del envejecimiento formulada por Harman [1], la formación de este tipo de moléculas se produce continuamente en el transcurso de la vida. Esto ocurre especialmente en los tejidos con un alto recambio de oxígeno, como el cerebro, los músculos y el hígado.
A nivel celular, las mitocondrias son el lugar con mayor recambio de ROS. En el curso de la producción de energía por la cadena respiratoria, se produce H2O2 en la membrana mitocondrial interna. También se produce durante el envejecimiento lumínico, donde se genera a partir de los aniones superóxido por las superóxido dismutasas. Un gran número de estudios han demostrado que, en el contexto del envejecimiento extrínseco, el H2O2 y el oxígeno singlete son las ERO más importantes inducidas por la luz UVA. Los radicales hidroxilo, por su parte, se forman en la reacción fisiológica de Fenton junto con el H2O2 y representan los radicales de oxígeno más importantes en el envejecimiento extrínseco de la piel en el contexto de la exposición a los rayos UVB.
Las ERO son, por tanto, fundamentales en el envejecimiento tanto intrínseco como extrínseco de la piel.
En el curso de la evolución, el organismo ha desarrollado varios mecanismos de defensa contra las ERO. Entre ellos se encuentran la catalasa, el citocromo p450, el glutatión, etc. Si se supera la capacidad de los sistemas del propio organismo para neutralizar las ERO, las moléculas altamente reactivas pueden reaccionar con diversos componentes de la célula y dañarlos. Por ejemplo, las macromoléculas celulares como el ADN, las proteínas y las lipoproteínas pueden sufrir daños directos. La sobrecarga de los mecanismos de defensa del propio organismo por la formación continua de ROS provoca mutaciones genéticas y prolonga el envejecimiento de la piel.
Basándose en la teoría de los radicales libres del envejecimiento, actualmente se está intentando limitar o incluso prevenir la formación de ROS de forma sistémica entre las grandes poblaciones -especialmente caucásicas- mediante suplementos dietéticos y de forma tópica mediante la aplicación de productos que contengan antioxidantes naturales y sintéticos. Desgraciadamente, se ha demostrado que los experimentos de Harman no pueden reproducirse en su totalidad y que, dependiendo del montaje experimental en gusanos y ratones, una mayor aparición de ROS puede incluso conducir a una prolongación de la vida útil [3]. Se postula que las ROS inician una red de reparación celular. Hoy en día, se asume incluso que la ingesta de altas dosis de antioxidantes en forma de vitaminas y otros complementos alimenticios puede no tener ningún efecto o incluso causar daños.
Mutación del ADN mitocondrial [4, 5]
La principal tarea de las mitocondrias es proporcionar energía en forma de ATP. Esto ocurre a través de la cadena respiratoria, que tiene lugar en la membrana mitocondrial interna. Este proceso no siempre está exento de errores. Los errores en la cadena respiratoria pueden conducir a la formación de ROS, por lo que la mitocondria es el lugar con mayor recambio de ROS en la célula.
Las mitocondrias contienen su propio material genético (ADNmt). El ADNmt está situado en las inmediaciones de la cadena respiratoria y, por tanto, muy cerca de las influencias dañinas de las ROS que se producen. Se ha demostrado que las mutaciones del ADNmt se acumulan en el proceso normal de envejecimiento y que la función de la cadena respiratoria disminuye en proporción inversa, lo que provoca una disminución del aporte energético (teoría mitocondrial del envejecimiento). Además, podría demostrarse que, más allá del envejecimiento intrínseco mencionado, las mutaciones del ADNmt también desempeñan un papel en el envejecimiento extrínseco de la piel (teoría mitocondrial del envejecimiento lumínico). La piel expuesta repetidamente a la luz UV mostró una inducción de mutaciones del ADNmt que conducen a trastornos funcionales de las mitocondrias (consumo de oxígeno, potencial de membrana del mt, metabolismo energético).
Metaloproteinasas de matriz [6, 7].
Las marxmetaloproteinasas (MMP) representan una familia de enzimas cuya función es degradar proteolíticamente las proteínas de la matriz dérmica. El principal sustrato de las MMP son las proteínas estructurales de la dermis, como los colágenos y la gelatina. La función de las MMP es importante en el contexto de la remodelación tisular que se produce en diversos procesos biológicos como la morfogénesis, la cicatrización de heridas, la angiogénesis o el crecimiento tumoral. Además, las MMP tienen otras funciones en el procesamiento de moléculas de señalización que controlan el comportamiento celular. Fisiológicamente, existen inhibidores de las metaloproteinasas de la matriz (TIMP) específicos de tejido para las MMP. Reducen la actividad de las MMP y frenan así, por ejemplo, la degradación excesiva de las proteínas. La interacción de la MMP y el TIMP aún no se conoce del todo.
Numerosos trabajos sugieren que las MMP desempeñan un papel importante en el envejecimiento extrínseco de la piel. Las MMP son inducidas directa e indirectamente por la luz ultravioleta. La degradación de las proteínas de la matriz dérmica inducida de este modo conduce a un cambio en la matriz extracelular que contribuye a los cambios clínica e histológicamente visibles característicos de la piel fotoenvejecida.
Los estudios indican que los retinoides tienen un efecto inhibidor sobre la expresión de las MMP. La acumulación de colágeno nuevo no fraccionado puede dar lugar posteriormente a una mejora significativa del aspecto de la piel.
Activación de factores de transcripción [8, 9].
La activación de los factores de transcripción por la luz ultravioleta conduce a la inducción de las MMP. La exposición de la piel humana a los rayos UV no sólo conduce directamente a la inducción de las MMP, sino también a la inducción de los factores de transcripción AP-1 y NF-κB. Estos factores son activadores de los genes MMP. Esta vía de activación indirecta de MMP en la piel envejecida extrínsecamente existe además de la inducción directa de MMP por ROS.
Los resultados de los experimentos en laboratorio y con animales indican que la inducción de los factores de transcripción puede inhibirse con extractos de plantas (magnolol).
“Productos finales de glicación avanzada” [10, 11].
Los “productos finales de glicación avanzada” (AGE) se forman en una reacción de Maillard a través de la glicación y la oxidación de diversas proteínas estructurales. En este proceso, las proteínas (grupos amino libres) o los lípidos reaccionan de forma no enzimática con los hidratos de carbono. Los AGE están implicados en diferentes enfermedades relacionadas con la edad. La glicación está implicada en el envejecimiento cutáneo tanto intrínseco como extrínseco (exposición a los rayos UV) y altera los procesos de crecimiento y diferenciación y las actividades enzimáticas (MMP) en la matriz extracelular de la piel. El aumento del contenido de AGE en la piel modifica las propiedades mecánicas. Se caracterizan por una menor elasticidad y una mayor rigidez.
Los resultados de las pruebas de laboratorio indican que la formación de AGE puede inhibirse con extractos de plantas (pomelo rojo).
Vitamina D [12–15]
La vitamina D es una vitamina liposoluble que se forma principalmente en la piel humana bajo la luz solar (especialmente la UV-B). Entre otras cosas, regula la absorción de calcio y fosfato del intestino y su incorporación a los huesos. La disminución del grosor de la piel relacionada con la edad provoca una reducción significativa de la síntesis de vitamina D en la piel. Además, en las personas mayores y con menos movilidad, la reducción de la exposición al sol tiene un impacto negativo en el estado de la vitamina D.
La importancia de la vitamina D ha recibido mucha atención en los últimos años y actualmente es objeto de un animado debate. La revisión sistemática de Philippe Autier [15] del 6.12.13 muestra claramente que las opiniones que circulan con frecuencia sobre la vitamina D deben diferenciarse. Muchos estudios prospectivos han demostrado una asociación entre las concentraciones bajas de 25(OH) vitamina D y una serie de enfermedades agudas y crónicas. Sin embargo, un número igualmente elevado de ensayos aleatorizados no pudo aportar pruebas de que el aumento de la concentración de vitamina D prevenga la aparición.
Senescencia inmunitaria [16]
Incluso en personas aparentemente sanas, el sistema inmunitario que envejece experimenta cambios profundos y a veces irreversibles que conducen a una reducción progresiva de la función inmunitaria, es decir, a la senescencia inmunitaria. Esto afecta a todos los órganos y células del sistema inmunitario innato y adquirido, incluidas las células madre hematopoyéticas (CMH), las células progenitoras linfoides (CLP) de la médula ósea y el timo, los linfocitos T y B maduros de los órganos linfoides secundarios, así como los fagocitos y las células presentadoras de antígenos (CPA) del sistema inmunitario innato. A nivel del organismo en su conjunto, estos cambios asociados a la edad conducen principalmente a una mayor tendencia a la infección y a una menor respuesta a las vacunas. También son más frecuentes los tumores y las enfermedades autoinmunes. Muchos de ellos conciernen al ámbito dermatológico, como los carcinomas epiteliales, el melanoma maligno, los linfomas cutáneos, las colagenosis, las dermatosis bullosas, el herpes zóster, los trastornos de cicatrización de heridas y otros.
Envejecimiento de la inmunidad innata: Las células del sistema inmunitario innato están a la vanguardia de la defensa contra los agentes patógenos. Entre ellas se encuentran, en particular, las células fagocíticas y/o presentadoras de antígenos, como los neutrófilos, los macrófagos y las células dendríticas (CD), pero también las que se encuentran en el límite de la inmunidad adquirida, como las células NK. Algunos de los cambios relacionados con la edad en el sistema inmunitario innato se resumen en la tabla 1 .
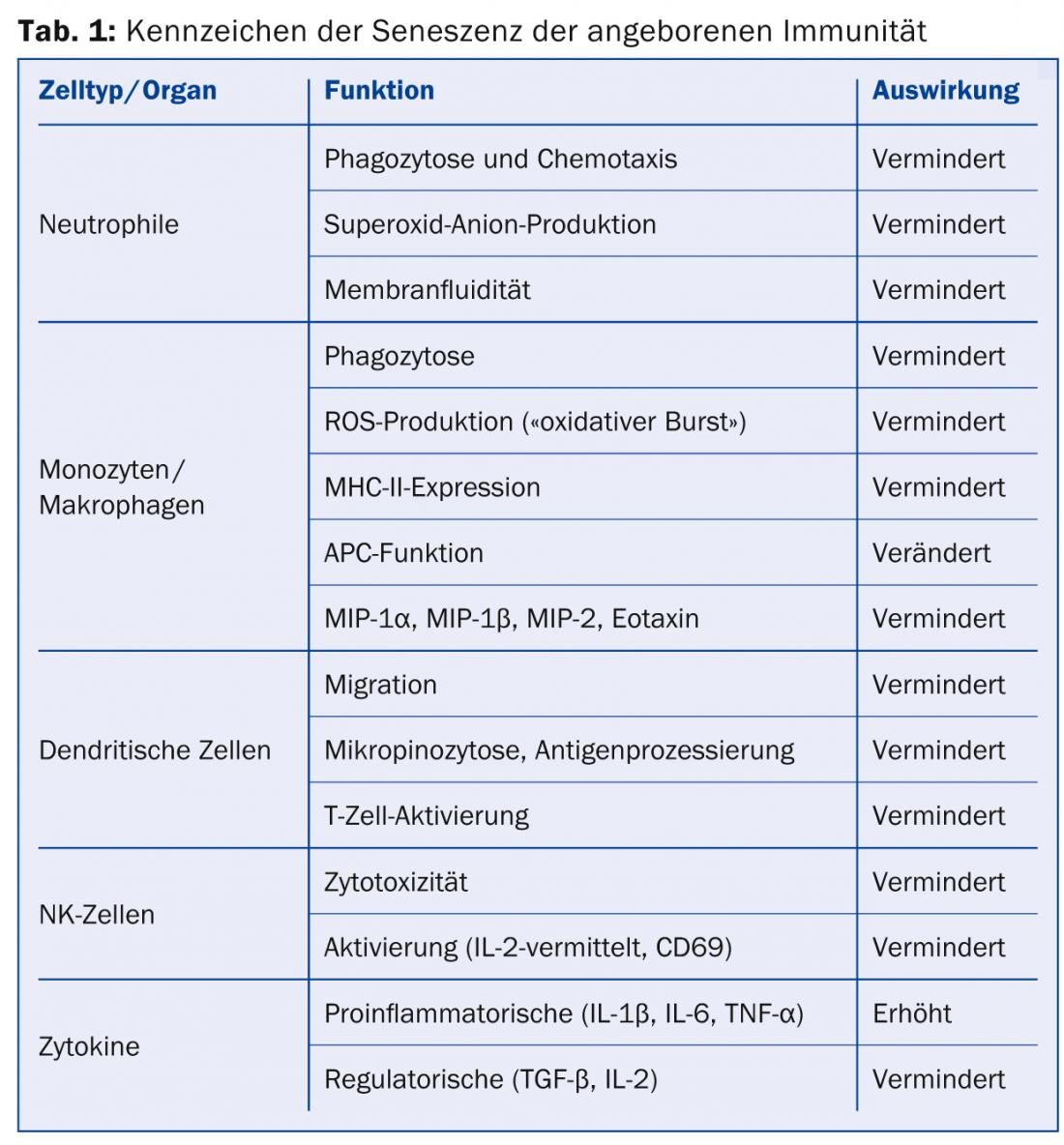
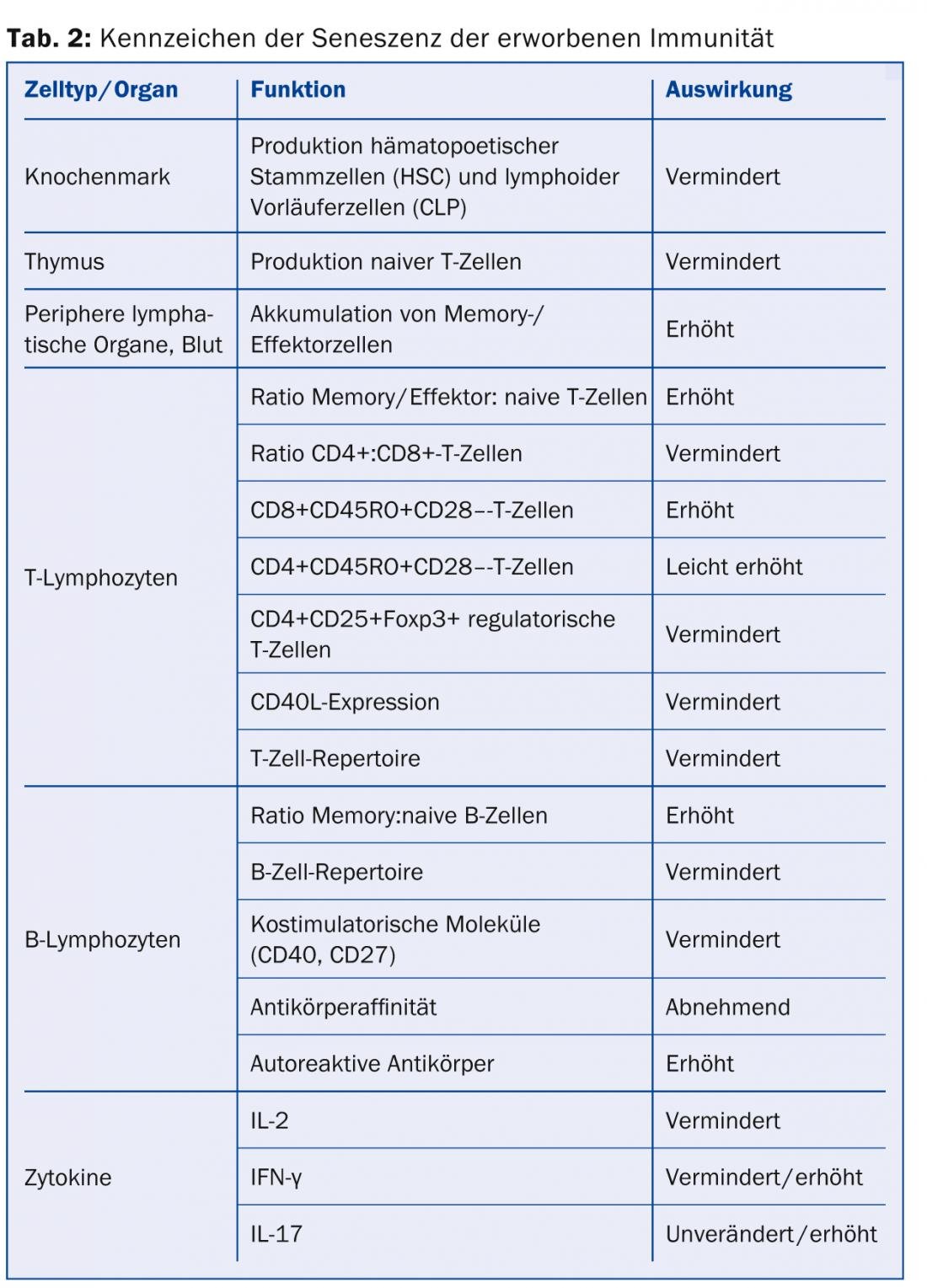
Envejecimiento de la inmunidad adquirida: A diferencia de la inmunidad innata, la inmunidad adquirida es capaz de dar respuestas inmunitarias antígeno-específicas, principalmente a través de las células T y B. Éstas también están sujetas a cambios relacionados con la edad que, al igual que ocurre con la inmunidad innata, conducen a una eficacia reducida (o mal dirigida) contra los patógenos. Además, la inmunidad adquirida también conduce a una menor variabilidad y, por tanto, a una menor adaptabilidad a los antígenos (Tabla 2).
Cambios ambientales en la piel
Hoy en día, los cambios ambientales en la piel están causados principalmente por el tabaco y la radiación ultravioleta (UV-S).
Fumar [17, 18]: La alteración de los procesos fisiológicos de la piel por el tabaquismo está bien estudiada. En general, fumar perjudica la circulación sanguínea de los tejidos, incluida la de la piel. La piel de los fumadores suele ser cetrina y grisácea, también es más seca y flácida y se arruga antes y con más severidad. Estos fenómenos han sido documentados de forma impresionante en algunos trabajos sobre gemelos idénticos. Estos fenómenos aparecen antes y de forma más clara en las mujeres que en los hombres. Varios procesos fisiológicos de la piel son responsables de la mayor formación de arrugas en los fumadores, que se ven perjudicados por los numerosos radicales libres del humo del tabaco. Por ejemplo, el humo del tabaco inhibe la formación de nuevas fibras de colágeno en la dermis y, al mismo tiempo, favorece la descomposición de las fibras de colágeno y elastina. El sistema finamente sintonizado de construcción y descomposición de las fibras queda así desequilibrado. La exposición a los rayos UV deteriora aún más estos procesos. Además, la nicotina del humo del tabaco contrae los vasos sanguíneos, por lo que la piel también recibe un aporte insuficiente de sangre, y el monóxido de carbono reduce el transporte de oxígeno a través de los eritrocitos.
Exposición a los rayos UV [19–22]: La alteración de los procesos fisiológicos de la piel, especialmente por una exposición prolongada a los rayos UV, también está bien estudiada (Fig. 1).

Esto se ilustró de forma particularmente impresionante el año pasado en un artículo de Jennifer Gordon en el New England Journal of Medicine [20]. La presentación clínica muestra a un camionero de 69 años cuya piel facial del lado izquierdo se engrosó y arrugó de forma asintomática durante un periodo de 25 años de trabajo y mostró signos típicos de lesiones cutáneas asociadas a la radiación UV-A. Hasta la fecha, se sabe poco sobre el envejecimiento epidérmico por la luz y aún no se conocen bien los procesos moleculares que conducen a los trastornos pigmentarios, típicos de la piel dañada por la luz. El envejecimiento dérmico por luz está mucho mejor estudiado. Debido al aumento de la actividad de la metaloproteinasa de la matriz, la colagenasa, la 92-kd-gelatinasa y la estromelisina, el colágeno se degrada cada vez más con la edad. Incluso cantidades pequeñas o intermitentes de luz ultravioleta activan la metaloproteinasa de la matriz y provocan una degradación del colágeno y una inhibición de la síntesis de colágeno. Aquí es también donde entra en juego el tratamiento con ácido retinoico para detener la activación de la metaloproteinasa de matriz inducida por los rayos UV. También se describen procesos similares para la elastina. La interacción de estos procesos da lugar a la típica arruga inducida por la luz.
Mientras tanto, también hay trabajos que describen de forma impresionante la importancia de la contaminación ambiental para el envejecimiento de la piel. Pero no sólo el tabaco y los rayos UV-S se consideran factores medioambientales. La gravedad, la expresión facial y la posición al dormir son también factores extrínsecos que contribuyen no poco a los cambios visibles en la piel envejecida: La gravedad tira sin cesar de nuestro cuerpo y sus signos se hacen especialmente evidentes a partir de los 50 años. La nariz, las orejas, los párpados y los labios se ven especialmente afectados. Las arrugas nasolabiales, de marioneta y del cuello se clasifican como arrugas gravitacionales y se producen debido a la flacidez de la piel y el tejido subcutáneo.
La expresión facial hace que se formen cada vez más arrugas a medida que envejecemos. Las arrugas mímicas pueden desarrollarse muy pronto como parte de una hiperactividad de los músculos faciales. A grandes rasgos, pueden dividirse en patas de gallo, arrugas del entrecejo, arrugas de la frente y arrugas de la boca, de los labios o del fumador, así como arrugas del mentón o de la nariz.
Ciertas posturas al dormir provocan las típicas arrugas del sueño, que suelen discurrir verticalmente en la zona de la mejilla y las sienes.
Se observan grandes diferencias étnicas en las arrugas relacionadas con la edad. En Japón y Corea del Sur, por ejemplo, las mujeres permanecen casi sin arrugas hasta los 50 años, mientras que en Francia las líneas de expresión se hacen visibles entre los 20 y los 30 años. Sin embargo, después de los 50 años, la situación vuelve a inclinarse a favor de las mujeres europeas.
Ingeniería genética y cuidado de la piel [23]
En los últimos años, los grandes avances de la ingeniería genética y el desarrollo de los “chips genéticos” nos han proporcionado una visión más profunda de los acontecimientos moleculares del envejecimiento cutáneo. Los análisis de la expresión génica permitieron identificar las vías de señalización implicadas en el proceso de envejecimiento, y este conocimiento puede contribuir sin duda al desarrollo de nuevas estrategias de prevención y terapia.
Sin embargo, los informes, a menudo entusiastas, sobre el efecto de nuevos ingredientes (a veces también conocidos) en el proceso de envejecimiento se han realizado in vitro, y aún está pendiente su transferencia a situaciones cotidianas “clínicas”. Sin embargo, estos candidatos a principios activos se ofrecen a menudo en dosis homeopáticas ricas en palabras y colores en los llamados cosméticos altamente eficaces e innovadores. La promoción de las células madre ha sido especialmente impresionante desde que Michelle Obama se trató el rostro con un suero que contenía células madre de la variedad de manzana suiza de larga duración “Uttwiler Spätlauber”. Así, se hace creer al consumidor -apoyado por un montón de celebridades- que con estos productos se vuelve a recordar a las células madre de la piel su tarea de hacerse útiles y rejuvenecer la piel.
Conclusión para la práctica
- El envejecimiento intrínseco suele denominarse envejecimiento cronológico o genético, mientras que el extrínseco suele denominarse envejecimiento exógeno o prematuro.
- Las especies reactivas del oxígeno (ROS) son fundamentales en el envejecimiento tanto intrínseco como extrínseco de la piel.
- Las mutaciones del ADN mitocondrial se acumulan en el proceso normal de envejecimiento. La función de la cadena respiratoria disminuye de forma inversamente proporcional, lo que provoca una disminución del aporte energético (teoría mitocondrial del envejecimiento).
- El tabaquismo, los rayos UV-S, la gravedad, la expresión facial y la posición al dormir se consideran factores ambientales del envejecimiento cutáneo.
Prof. Dr. phil. nat. Christian Surber
Literatura:
- Harman D: J Gerontol 1956; 11: 298-30000. PMID 13332224.
- Fortmann SP, et al: Ann Intern Med 2013; 159(12): 824-834. doi:10.7326/0003-4819-159-12-201312170-00729.
- Moyer MW: Sci Am 2013 Feb; 308(2): 62-67. PMID: 23367786.
- Berneburg M, et al: Photochem Photobiol Sci 2006; 5: 190-198. PMID: 16465305.
- Kazachkova N, et al: Aging Dis 2013; 4(6): 337-350. PMID: 24307967.
- Griffiths CE, et al: N Engl J Med 1993; 329(8): 530-535. PMID: 8336752.
- Hernández-Pérez M, et al: Am J Dermatopathol 2012; 34(6): 565-579. doi: 10.1097/DAD. 0b013e31821e8744.
- Muthusamy V, et al: Arch Dermatol Res 2010; 302(1): 5-17. doi: 10.1007/s00403-009-0994-y.
- Tanaka K, et al: Curr Drug Metab 2010; 11(5): 431-435. PMID: 20540695.
- Crisan M, et al: PLoS One 2013; 8(10): e75003. doi: 10.1371/journal.pone.0075003.
- Jariyapamornkoon et al: BMC Complement and Altern Med 2013; 13: 171. doi: 10.1186/1472-6882-13-171.
- Tang JY, et al: J Am Acad Dermatol 2012; 67(5): 803.e1-12, quiz 815-6. doi: 10.1016/j.jaad.2012.05.044.
- Tang JY, et al: J Am Acad Dermatol 2012; 67: 817.e1-11, quiz 827-8. doi: 10.1016/j.jaad.2012.07.022.
- Reid IR, et al: Lancet 2013 Oct 10. pii: S0140-6736(13)61647-5. doi: 10.1016/S0140-6736(13)61647-5.
- Autier P, et al: Estado de la vitamina D y mala salud: una revisión sistemática. The Lancet Diabetes & Endocrinology, Disponible en línea el 6 de diciembre de 2013. http://dx.doi.org/10.1016/S2213-8587(13)70165-7.
- Peters T: Dermatólogo 2011; 62(8): 598-606, doi: 10.1007/s00105-011-2134-9.
- Morita A, et al: J Invest Dermatol Symp Proc 2009; 14: 53-55, doi:10.1038/jidsymp.2009.13.
- Okada HC, et al: Plast Reconstr Surg 2013; 132: 1085-1092, doi: 10.1097/PRS.0b013e3182a4c20a.
- Gilchrest BA: J Invest Dermatol 2013; 133(E1): E2–E6, doi:10.1038/skinbio.2013.176.
- Gordon JRS, et al: N Engl J Med 2012; 366: e25, doi: 10.1056/NEJMicm1104059.
- Valacchi G, et al: Ann NY Acad Sci 2012; 1271: 75-81, doi: 10.1111/j.1749-6632.2012.06724.x.
- Dennerstein L, et al: Menopause Int 2011; 17(3): 96-101. doi: 10.1258/mi.2011.011028.
- Tiesman JP: J Drugs Dermatol 2009; 8(7 Suppl): s12-14. PMID: 19623779.
Práctica dermatológica 2014; 24(1): 4-8











