El tratamiento del cáncer de pulmón no microcítico es individualizado y se basa en el estadio tumoral, la histología y los marcadores moleculares predictivos, teniendo en cuenta el perfil del paciente. Para maximizar el resultado terapéutico de cada paciente, es esencial la coordinación de las distintas modalidades terapéuticas por parte de una junta tumoral. Esto se aplica a las situaciones curativas pero también a las paliativas.
El diagnóstico, la estadificación y el tratamiento del cáncer de pulmón no microcítico (CPNM) requieren la cooperación entre diferentes disciplinas. Las diferentes modalidades de terapia deben combinarse para obtener un régimen terapéutico individual. La junta de tumores es la plataforma central de coordinación para ello. Sería deseable que todos los pacientes fueran presentados y discutidos en una junta tumoral antes de iniciar una terapia curativa o paliativa, con el fin de determinar un concepto terapéutico individualizado y, por tanto, óptimo, mediante la coordinación de las distintas modalidades terapéuticas. Para ello, deben incluirse los factores estadio, histología, análisis moleculares, comorbilidades, calidad de vida y deseos y necesidades personales de la paciente. Neumólogos, cirujanos torácicos, oncólogos médicos, radioterapeutas, patólogos, radiólogos y especialistas en medicina nuclear elaboran una decisión conjunta que define la terapia. Esta estrecha colaboración también es importante en el curso de una enfermedad para poder volver a ofrecer la mejor terapia individual en una nueva situación de enfermedad, como una recaída.
La discusión de la junta tumoral en el caso de un nuevo diagnóstico de carcinoma bronquial de células no pequeñas puede describirse como sigue: Los tumores confinados en el pulmón se resecan principalmente. En caso de afectación de los ganglios linfáticos mediastínicos y/o infiltración en la zona circundante, siempre debe discutirse la terapia neo o adyuvante. En estadios locales avanzados, los pacientes son tratados con enfoques multimodales, es decir, quimioterapia combinada seguida de cirugía o quimioterapia y radioterapia. En el caso del cáncer de pulmón metastásico, la terapia se determina en función de la histología y las características moleculares.
Estadificación mediante PET-TC
Evaluación de los ganglios linfáticos mediastínicos: En fases tempranas del tumor, debe solicitarse una estadificación de los ganglios linfáticos del mediastino con alta sensibilidad y especificidad, ya que su resultado tiene una gran relevancia para el procedimiento posterior. La importancia clínica de la PET-TC para la estadificación de los ganglios linfáticos radica en su alto valor predictivo negativo. Si el PET-TAC es negativo, se puede prescindir de otros diagnósticos invasivos de los ganglios linfáticos.
En cambio, el valor predictivo positivo es inferior. Por lo tanto, los ganglios linfáticos mediastínicos positivos a la PET deben ser evaluados más a fondo. Hoy en día, se utilizan principalmente técnicas menos invasivas para este fin mediante punciones broncoscópicas (sonografía endobronquial [EBUS], endosonografía [EUS]) o, si es necesario, mediastinoscopia.
Manifestaciones extratorácicas: Otro punto fuerte de la PET-TC es la posibilidad de detectar metástasis extratorácicas. Para una estadificación adecuada del SNC, debe realizarse una IRM del cráneo en caso de sospecha clínica o de metástasis probada en los ganglios linfáticos mediastínicos [1].
Terapia de las primeras etapas
El cáncer de pulmón de células no pequeñas sin metástasis extratorácicas puede tratarse mediante resección quirúrgica con intención curativa. La supervivencia media tras la cirugía es de 46 meses -sin terapia sólo de 14 meses-, pero depende significativamente del tamaño inicial del tumor y de la afectación de los ganglios linfáticos. El criterio más importante para un buen resultado del tratamiento es la experiencia del equipo tratante. También se ha demostrado que los centros con muchas operaciones (>150 al año) pueden lograr una mejor supervivencia global que los que tienen menos casos (<70 al año) [2].
En los estadios I y II, el objetivo es la lobectomía, incluida la linfadenectomía mediastínica. La mortalidad a 30 días tras las lobectomías es baja (1%) y no aumenta ni siquiera en pacientes de edad avanzada con comorbilidades cuando se seleccionan cuidadosamente. La operación puede realizarse de forma mínimamente invasiva por toracoscopia.
Hoy en día, las neumonectomías sólo son necesarias en casos excepcionales, pero pueden desempeñar un papel en un concepto curativo global [3]. Pueden prevenirse resecando selectivamente los bronquios o arterias afectados como un manguito y reanastomosando el tejido pulmonar restante (resección en manguito, “resección en manga”). Estas resecciones son cada vez más frecuentes. Ejemplo: En el caso de un carcinoma del lóbulo superior central, los lóbulos medio e inferior restantes se reanastomosan al bronquio principal tras la resección.
Otras intervenciones para salvar tejido pulmonar, como las segmentectomías, sólo se recomiendan para tumores pequeños y periféricos (<2 cm) sin metástasis en los ganglios linfáticos (N0) [4].
La lobectomía mínimamente invasiva (toracoscópica) se considera una técnica quirúrgica para el carcinoma bronquial localizado y se utiliza en centros especializados en estadios tempranos. Los pacientes tras una lobectomía toracoscópica tienen una supervivencia a 5 años comparable (o en algunos estudios incluso mejor) que tras una lobectomía abierta [5]. Además, la quimioterapia adyuvante se tolera antes y mejor.
En pacientes con tumores pequeños y comorbilidades significativas, debe considerarse la radioterapia curativa intencionada, con un diagnóstico de dignidad previo siempre que sea posible. La recogida de tejidos es especialmente importante para poder ofrecer posteriormente una terapia óptima en función de las características moleculares del tumor. En este caso se utiliza la radioterapia estereotáctica (SBRT) y la tecnología de alta precisión (por ejemplo, Gamma Knife®, LINAC), que permite un buen control local del tumor con una toxicidad limitada de la radiación [6].
Terapia de estadios localmente avanzados con intención curativa
En los pacientes con tumores en estadio IIIA (N2), definidos por la presencia de metástasis en los ganglios linfáticos mediastínicos ipsilaterales, puede desarrollarse un concepto curativo multimodal si el paciente se encuentra en buen estado general.
La quimioterapia neoadyuvante puede recomendarse en el sentido de la quimioterapia de inducción si la situación se evalúa como potencialmente operable. Dado que la quimioterapia es una parte importante del concepto terapéutico en esta situación, la administración neoadyuvante garantiza que la terapia sistémica pueda administrarse sin reducción de dosis y con buena tolerabilidad [7, 8].
La radioquimioterapia definitiva puede recomendarse para pacientes con tumores primarios no operables, recomendándose la radioquimioterapia concomitante para pacientes en buen estado general [9].
Actualmente, un estudio en Suiza está investigando si la adición de radioterapia preoperatoria en combinación con cetuximab a la quimioterapia es beneficiosa en situaciones muy avanzadas y no metastásicas (IIIB) (SAKK 16/08).
Terapia adyuvante tras la cirugía
En pacientes tras una resección completa de un cáncer de pulmón de células no pequeñas en estadio II y III, cuatro ciclos de quimioterapia combinada adyuvante con cisplatino se consideran actualmente la terapia estándar. Basándose en análisis retrospectivos (CALGB 9633), la terapia adyuvante también puede recomendarse en el estadio IB y un tamaño tumoral superior a 4 cm.
En pacientes tras una resección tumoral completa en estadio IB-IIB, tres grandes ensayos aleatorizados muestran ahora una prolongación significativa de la supervivencia con quimioterapia combinada adyuvante basada en platino [10–12].
La radioterapia postoperatoria (RTPO) sigue siendo controvertida. También en este caso se están realizando estudios para describir mejor su significado. Por ejemplo, el ensayo LungART está probando PORT en pacientes con afectación N2 tras una resección completa (resumen 7658, ASCO 2007).
Sin embargo, sólo algunas de las tratadas se benefician del tratamiento adyuvante. Esto plantea la cuestión de las características biológicas que podrían permitir la identificación de estos pacientes con antelación. Actualmente se está investigando hasta qué punto las firmas de expresión génica pueden utilizarse para identificar subgrupos con pronósticos diferentes y si esto puede utilizarse para centrar las terapias adyuvantes en pacientes con un pronóstico desfavorable (CALGB-30506). Por otra parte, también se está intentando utilizar los estudios farmacogenómicos para predecir si el tumor puede verse influido por determinados agentes quimioterapéuticos. Sin embargo, aún no se ha caracterizado ningún marcador predictivo.
Terapia paliativa basada en la histología y la biología molecular
Las estrategias terapéuticas en la terapia paliativa han cambiado en los últimos años. Las nuevas estrategias se basan en la relevancia “redescubierta” de la morfología diferenciada y en nuevos hallazgos moleculares. El término genérico “carcinoma bronquial de células no pequeñas” ya no es suficiente para la decisión de tratamiento. El término “células no pequeñas” resume entidades extremadamente heterogéneas desde el punto de vista histológico y molecular. Ya no satisface las necesidades de la selección moderna de medicamentos, que se adapta individualmente a la morfología y la biología molecular.
La terapia dirigida en función de la histología exacta y, en el caso de los adenocarcinomas, del estado de mutación del “receptor del factor de crecimiento epidérmico” (EGFR) y del estado de translocación de la ALK (linfoma quinasa anaplásico) (EML4-ALK positivo) se ha establecido en la práctica oncológica diaria. Los inhibidores de la tirosina quinasa (TKI) pueden utilizarse en este caso con beneficio terapéutico.
Crucial: el estado de mutación de las células tumorales
Hoy en día, los carcinomas bronquiales de células no pequeñas deben someterse a pruebas para determinar su estado de mutación antes de iniciar una terapia paliativa. Todos los carcinomas pulmonares de células no escamosas deben desglosarse en función de la presencia de mutaciones del EGFR. Las mutaciones pueden conducir a la activación de la tirosina quinasa intracelular del EGFR, dando a las células tumorales una señal de crecimiento permanente. Esto se denomina mutación activadora. Estas mutaciones se dan con mayor frecuencia en los no fumadores [13]. Las más relevantes de las mutaciones del EGFR son una deleción en el exón 19 y la mutación puntual L858R (exón 21) y G719X (exón 18). Sin embargo, también existen mutaciones como la T790M (exón 20) que confieren resistencia a la terapia TKI. Los fármacos que pueden utilizarse son el gefitinib y el erlotinib, que inhiben la tirosina quinasa del EGFR [14]. El afatinib ya está aprobado como tratamiento de segunda línea en EE.UU. y la UE. El afatinib bloquea el “Receptor del factor de crecimiento epidérmico humano 2” (HER2/ErbB2) y el ErbB4, además del “Receptor del factor de crecimiento epidérmico” (EGFR/ErbB1). En pacientes con mutación activadora conocida del EGFR, debe utilizarse el inhibidor de la tirosina cinasa en primera línea.
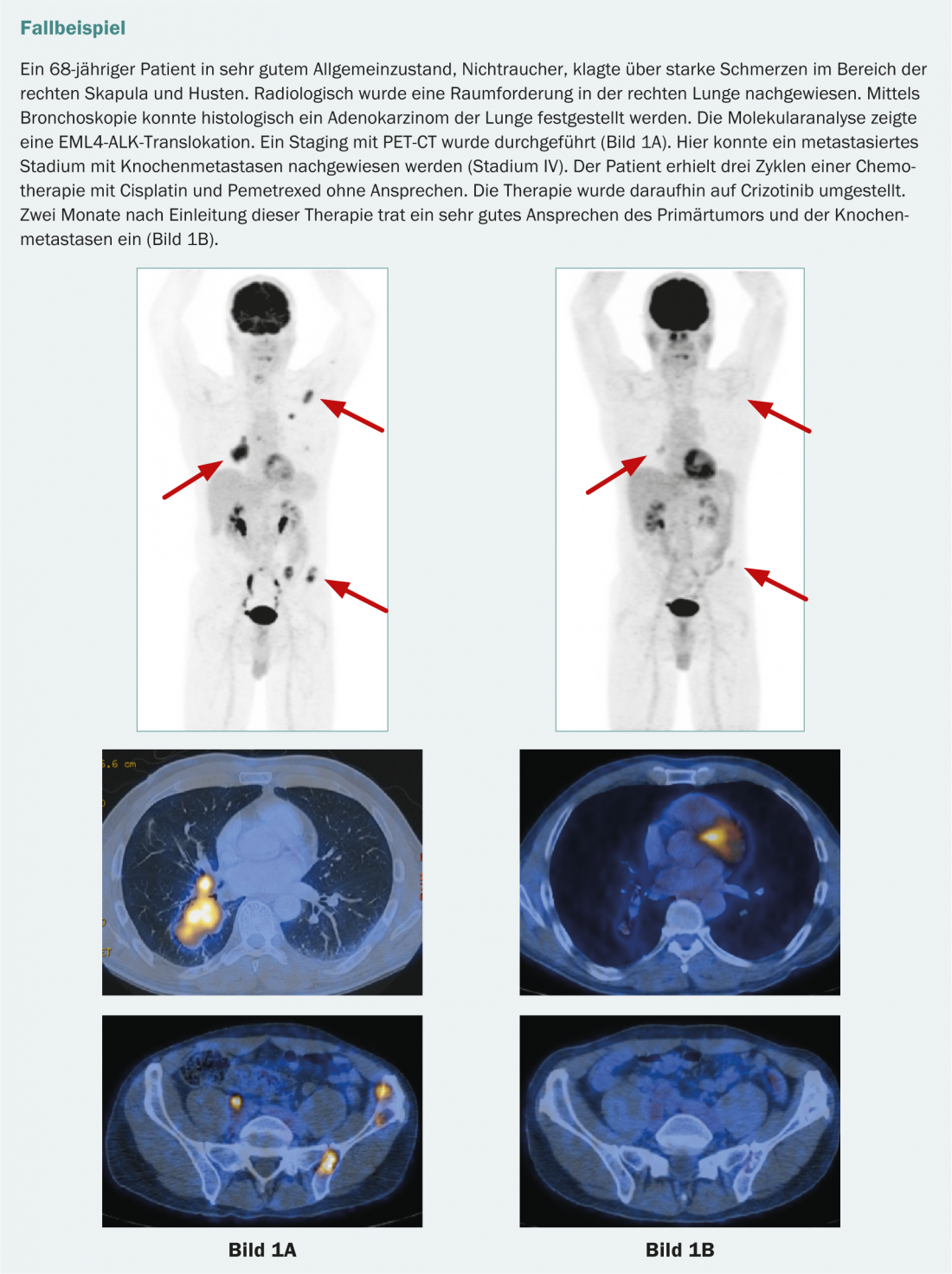
En el adenocarcinoma de pulmón, también puede existir una proteína de fusión patológica formada por la “quinasa del linfoma anaplásico” (ALK) y la “proteína similar a la 4 asociada a los microtúbulos del equinodermo” (EML4). Esto también conduce a una señal de crecimiento incontrolado en las células tumorales. Esta mutación se produce con mucha menos frecuencia (aprox. 4-7%). Afecta principalmente a los no fumadores y casi nunca se da en combinación con otras mutaciones [15]. Los pacientes con EML4-ALK positivo se benefician del tratamiento con crizotinib. Actualmente, el crizotinib está aprobado en Suiza como terapia de segunda línea para pacientes con una translocación ALK.
Otras mutaciones raras para las que existen inhibidores potenciales de la tirosina quinasa son las del receptor EGF-2 (HER2) y BRAF. Casi exclusivamente en los adenocarcinomas de fumadores, también se observan mutaciones del oncogén KRAS (transversión de G a T). La presencia de una mutación KRAS se correlaciona con un peor pronóstico global. Sin embargo, por el momento no se puede extraer ninguna consecuencia terapéutica de esta mutación [16].
La histología señala el camino de la quimioterapia
Se renovó la clasificación histológica del adenocarcinoma de pulmón y, por tanto, también se sustituyó el término poco definido de “carcinoma bronquioalveolar (BAC)”. Las pequeñas lesiones preinvasivas se denominan ahora “adenocarcinoma in situ”. Las lesiones invasivas >de 5 cm se denominan “carcinoma lepídico”. Los carcinomas de entre 3 y 5 cm se denominan “mínimamente invasivos” [17].
Además, la quimioterapia combinada que contiene platino -con sustancias como vinorelbina, gemcitabina, pemetrexed y paclitaxel- debe considerarse la terapia estándar o de primera línea para el carcinoma bronquial avanzado [18].
A pesar de los grandes esfuerzos realizados, aún no ha sido posible definir marcadores predictivos fiables para los agentes quimioterapéuticos 19, 20].
El pemetrexed está aprobado para el tratamiento del carcinoma de células no escamosas. El pemetrexed es un nuevo miembro de la familia de los antagonistas del ácido fólico. En 2008, un ensayo aleatorizado demostró que los pacientes con histología epitelial no laminar se beneficiaban más de la terapia combinada con pemetrexed y cisplatino que de la combinación gemcitabina/cisplatino. El perfil de efectos secundarios de la nueva combinación también demostró ser superior en términos de toxicidad hematológica y neutropenia febril [21].
El bevacizumab es un anticuerpo monoclonal contra el factor de crecimiento endotelial vascular (VEGF). El bevacizumab en combinación con quimioterapia está aprobado en Suiza para el tratamiento del cáncer de pulmón de células no pequeñas con histología no escamosa. Esto se basó en dos ensayos aleatorizados: por un lado, la adición de bevacizumab a la combinación de carboplatino y paclitaxel mejoró la respuesta tumoral y prolongó la supervivencia media en 12,3 meses, es decir, más que la quimioterapia sola (10,3 meses) [22]. Por otro lado, el bevacizumab en combinación con cisplatino/gemcitabina logró una respuesta tumoral significativamente mayor [23]. Sin embargo, esto no condujo a una prolongación de la supervivencia global [24].
Terapia de mantenimiento
El tratamiento del carcinoma bronquial de células no pequeñas avanzado solía consistir en cuatro (hasta un máximo de seis) ciclos de quimioterapia con platino. Los resultados de nuevos ensayos aleatorios mostraron por primera vez que, en determinadas situaciones, continuar el tratamiento con una terapia de mantenimiento posterior puede prolongar la supervivencia. Se distinguen dos formas de terapia de mantenimiento (Tabla 1) . Para el “mantenimiento de continuación”, se dispone de datos sobre gemcitabina [25] y pemetrexed más bevacizumab [26], que pudieron demostrar una ventaja en términos de supervivencia sin progresión. El mantenimiento del cambio dio positivo para pemetrexed [27], docetaxel [28], erlotinib [25] y gefitinib [29].

Cirugía de metástasis
En el cáncer de pulmón no microcítico metastásico, es decir, en estadio IV, la cirugía sólo tiene un papel limitado y siempre es una decisión que debe tomarse caso por caso. En el caso de una metástasis cerebral singular de un carcinoma bronquial operable, se realiza una resección neuroquirúrgica en los casos adecuados. A continuación, se administra radiación a todo el cerebro y se procede a la resección quirúrgica del tumor primario si no hay otras metástasis en otros lugares. Con la resección radical, este procedimiento logra una tasa de supervivencia a 5 años de aproximadamente el 40%.
En situaciones especiales con metástasis en órganos aislados, especialmente metástasis suprarrenales, también se ha evaluado la resección quirúrgica con intención curativa [30]. Estas intervenciones suelen combinarse con una terapia sistémica adyuvante o neoadyuvante.
CONCLUSIÓN PARA LA PRÁCTICA
- Una estadificación precisa, el diagnóstico histológico y el análisis molecular son la clave para una terapia individualizada y, por tanto, para optimizar el resultado terapéutico.
- El término “cáncer de pulmón de células no pequeñas” engloba morfológica y molecularmente muchas entidades diferentes que deberían describirse con precisión en un solo diagnóstico.
- Hoy en día, es posible una terapia de primera línea individualizada y paliativa en función de una diferenciación histológica exacta y según el estado de la mutación. Tras completar cuatro ciclos de terapia de primera línea con platino, la terapia de mantenimiento mejora la supervivencia libre de progresión y puede dar lugar a una mejora de la supervivencia global. Los pacientes con una enfermedad estabilizada y un buen estado general parecen ser los más beneficiados en este caso.
- Para el carcinoma bronquial localizado, hoy en día se prefieren las lobectomías mínimamente invasivas (toracoscópicas). Para los tumores situados en el centro, cada vez se opta más por la resección con manguito/manguito que preserva el tejido pulmonar.
- La quimioterapia combinada adyuvante con cisplatino es ahora una parte fija de la terapia tras la resección de los estadios tumorales IB (>4 cm), II y IIIA.
PD Ulf Petrausch, MD
Dra. Alessandra Curioni-Fontecedro
Literatura:
- Silvestri GA, et al: Methods for staging non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013; 143(5 Suppl): e211S-50S.
- Luchtenborg M, et al: Un alto volumen de procedimientos se asocia fuertemente con una mejor supervivencia tras la cirugía del cáncer de pulmón. J Clin Oncol 2013; 31(25): 3141-3146.
- Riquet M, et al: Revisión de 250 supervivientes a diez años tras neumonectomía por cáncer de pulmón no microcítico. Revista europea de cirugía cardiotorácica: revista oficial de la Asociación Europea de Cirugía Cardiotorácica 2013.
- Yendamuri S, et al: Tendencias temporales en los resultados tras resecciones sublobares y lobares para cánceres de pulmón de células no pequeñas (≤2 cm) – un análisis de la base de datos Surveillance Epidemiology End Results. Revista de investigación quirúrgica 2013; 183(1): 27-32.
- Lee PC, et al: Supervivencia a largo plazo tras lobectomía por cáncer de pulmón de células no pequeñas mediante cirugía torácica asistida por vídeo frente a toracotomía. Anales de cirugía torácica 2013; 96(3): 951-960; discusión 960-961.
- Powell JW, et al: Avances en el tratamiento del cáncer de pulmón no microcítico médicamente inoperable: énfasis en los ensayos prospectivos. The Lancet Oncology 2009; 10(9): 885-894.
- Scagliotti GV, et al: Estudio aleatorizado de fase III de cirugía sola o cirugía más cisplatino preoperatorio y gemcitabina en cáncer de pulmón no microcítico en estadios IB a IIIA. J Clin Oncol 2012; 30(2): 172-178.
- Strauss GM: Quimioterapia de inducción y cirugía para el cáncer de pulmón no microcítico en estadio inicial: ¿qué hemos aprendido de los ensayos aleatorizados? J Clin Oncol 2012; 30(2): 128-131.
- Auperin A, et al.: Metaanálisis de la radioquimioterapia concomitante frente a la secuencial en el cáncer de pulmón no microcítico localmente avanzado. J Clin Oncol 2010; 28(13): 2181-2190.
- 10 Winton TL, et al: Ensayo prospectivo aleatorizado de vinorelbina (VIN) y cisplatino (CIS) adyuvantes en cáncer de pulmón no microcítico (CPNM) en estadios 1B y II completamente resecado Intergroup JBR.10. J Clin Oncol 2004; 22(14): 621s-621s.
- 11 Le Chevalier T, et al: Quimioterapia adyuvante basada en cisplatino en pacientes con cáncer de pulmón no microcítico completamente resecado. NEJM 2004; 350(4): 351-360.
- Pignon JP, et al: Evaluación del cisplatino adyuvante pulmonar: un análisis conjunto del grupo de colaboración LACE. J Clin Oncol 2008; 26(21): 3552-3559.
- Rosell R, et al: Detección de mutaciones del receptor del factor de crecimiento epidérmico en el cáncer de pulmón. The New England journal of medicine 2009; 361(10): 958-967.
- Rosell R, Bivona TG, Karachaliou N: Genética y biomarcadores en la personalización del tratamiento del cáncer de pulmón. Lancet 2013; 382(9893): 720-731.
- Shaw AT, et al: Características clínicas y resultados de los pacientes con cáncer de pulmón no microcítico portadores de EML4-ALK. J Clin Oncol 2009; 27(26): 4247-4253.
- Roberts PJ, Stinchcombe TE: Mutación KRAS: ¿Debemos hacer la prueba y tiene importancia? J Clin Oncol 2013; 31(8): 1112-1121.
- Travis WD, Brambilla E, Riely GJ: Nueva clasificación patológica del cáncer de pulmón: relevancia para la práctica clínica y los ensayos clínicos. J Clin Oncol 2013; 31(8): 992-1001.
- Schiller JH, et al: Comparación de cuatro regímenes de quimioterapia para el cáncer de pulmón no microcítico avanzado. NEJM 2002; 346(2): 92-98.
- Cobo M, et al: Personalización del cisplatino basada en la expresión del ARNm de la reparación por escisión cuantitativa del complemento cruzado 1: un ensayo de fase III en el cáncer de pulmón no microcítico. J Clin Oncol 2007; 25(19): 2747-2754.
- Bepler G, et al: Ensayo internacional aleatorizado de fase III de quimioterapia basada en la expresión de ERCC1 y RRM1 frente a gemcitabina/carboplatino en el cáncer de pulmón no microcítico avanzado. J Clin Oncol 2013; 31(19): 2404-2412.
- Scagliotti GV,et al.: Estudio de fase III que compara cisplatino más gemcitabina con cisplatino más pemetrexed en pacientes sin quimioterapia con cáncer de pulmón no microcítico en estadio avanzado. J Clin Oncol 2008; 26(21): 3543-3551.
- Sandler A, et al: Paclitaxel-carboplatino solo o con bevacizumab para el cáncer de pulmón no microcítico. NEJM 2006; 355(24): 2542-2550.
- Reck M, et al.: Ensayo de fase III de cisplatino más gemcitabina con placebo o bevacizumab como tratamiento de primera línea del cáncer de pulmón no microcítico no escamoso: AVAil. J Clin Oncol 2009; 27(8): 1227-1234.
- Reck M, et al.: Supervivencia global con cisplatino-gemcitabina y bevacizumab o placebo como tratamiento de primera línea del cáncer de pulmón no microcítico no escamoso: resultados de un ensayo aleatorizado de fase III (AVAiL). Anales de oncología: revista oficial de la Sociedad Europea de Oncología Médica/ESMO 2010; 21(9): 1804-1809.
- Perol M, et al: Randomized, phase III study of gemcitabine or erlotinib maintenance therapy versus observation, with predefined second-line treatment, after cisplatin-gemcitabine induction chemotherapy in advanced non-small-cell lung cancer. J Clin Oncol 2012; 30(28): 3516-3524.
- Barlesi F, et al.: Ensayo aleatorizado de fase III de bevacizumab de mantenimiento con o sin pemetrexed tras la inducción de primera línea con bevacizumab, cisplatino y pemetrexed en el cáncer de pulmón no microcítico no escamoso avanzado: AVAPERL (MO22089). J Clin Oncol 2013; 31(24): 3004-3011.
- Belani CP, et al: Calidad de vida en pacientes con cáncer de pulmón no microcítico avanzado que reciben tratamiento de mantenimiento con pemetrexed frente a placebo (H3E-MC-JMEN): resultados de un estudio aleatorizado, doble ciego, de fase 3. Lancet Oncology 2012; 13(3): 292-299.
- Fidias PM, et al: Estudio de fase III del docetaxel inmediato comparado con el diferido tras la terapia de primera línea con gemcitabina más carboplatino en el cáncer de pulmón no microcítico avanzado. J Clin Oncol 2009; 27(4): 591-598.
- Zhang L, et al: Gefitinib frente a placebo como terapia de mantenimiento en pacientes con cáncer de pulmón no microcítico localmente avanzado o metastásico (INFORM; C-TONG 0804): un ensayo multicéntrico, doble ciego aleatorizado de fase 3. Lancet Oncology 2012; 13(5): 466-475.
- Salah S, Tanvetyanon T, Abbasi S: Metastatectomía para metástasis solitarias extracraneales de cáncer de pulmón no microcítico extraadrenal: Revisión sistemática y análisis de los casos notificados. Cáncer de pulmón-J Iaslc 2012; 75(1): 9-14.
InFo Oncología y Hematología 2013; 1(1): 16-21