Además de la clamidia y los gonococos, existen numerosos patógenos que pueden causar uretritis. Ocasionalmente, las características clínicas pueden apuntar al germen responsable, como el dolor marcado y la meatitis en los adenovirus y herpesvirus o la balanopostitis concomitante en el Mycoplasma genitalium. El diagnóstico microscópico del flúor permite diferenciar la gonorrea de la UNG, posibilita una terapia inmediata y puede proporcionar indicios adicionales de uretritis vírica. Especialmente en las formas crónicas o recurrentes, debe realizarse un amplio esclarecimiento de patógenos, teniendo en cuenta el Mycoplasma genitalium y el Trichomonas vaginalis. En caso de fracaso del tratamiento con la terapia estándar (especialmente M. genitalium y U. urealyticum), debe utilizarse azitromicina prolongada.
Tras descartar una infección urinaria, hay que distinguir entre una forma no infecciosa y una forma infecciosa de uretritis (tab. 1) . Las causas típicas de la uretritis no infecciosa son los desencadenantes mecánico-traumáticos; las causas químicas (por ejemplo, desinfectantes, jabones) o locales como anomalías congénitas, fimosis, neoplasia también pueden ir acompañadas de uretritis no infecciosa. Tradicionalmente, la uretritis infecciosa se divide en dos grupos: La uretritis gonocócica (UG) y la denominada uretritis no gonocócica (UNG). Esta clasificación surgió históricamente para distinguir la UNG -un grupo de infecciones de sintomatología similar con una etiología, en aquel momento, poco clara, heterogénea y difícil de determinar- de la uretritis gonorreica, mucho mejor investigada y más grave. La UNG, que antes se denominaba uretritis inespecífica, era comparativamente rara junto con la gonorrea, pero ahora supera con creces su incidencia y no es infrecuentemente asintomática. A continuación, sin embargo, sólo se abordan las uretritis infecciosas no gonorreicas y su espectro patógeno, los pasos necesarios para su esclarecimiento y las medidas terapéuticas.

La prevalencia del espectro de patógenos causantes se notifica de forma diferente según las regiones (Tab. 1). La proporción de pacientes en los que no se ha podido aislar ningún patógeno depende de los diagnósticos realizados y del hecho de que, por ejemplo, las uretritis víricas son más frecuentes de lo que se suponía, pero rara vez se buscan. La UNG está presente si la preparación del frotis teñido de la uretra contiene más de cinco leucocitos polimorfonucleares.
por campo visual (aumento total 400x) en ausencia de diplococos intracelulares.
Clamidia
La Chlamydia trachomatis comprende un total de 15 serotipos definidos por diferentes antígenos proteicos, designados por las letras A-C, D-K y L1-L3, que causan diferentes enfermedades. Los serovares D-K son causantes de uretritis, cervicitis, endometritis y salpingitis. Estos patógenos no infectan el epitelio escamoso, sino sólo el cilíndrico, y tienen una prevalencia del 4-5% en las mujeres de Europa.
C. trachomatis se encuentra en el 15-41% de todos los casos de uretritis en hombres. Sin embargo, en la bibliografía de los últimos diez años, no se informa sistemáticamente de la frecuencia de la clamidia como agente patógeno. La transmisión se produce por contacto sexual sin protección, siendo la edad inferior a 20 años, la promiscuidad y la falta o incorrecta utilización del preservativo los factores de riesgo. Se recomienda realizar un cribado anual a las pacientes sexualmente activas menores de 25 años, así como a las mujeres mayores de 25 años con factores de riesgo (múltiples parejas, nuevas parejas). Sin embargo, las infecciones genitales por clamidia afectan por igual a todos los grupos sociales.
La infección por clamidia en los hombres se hace perceptible tras un periodo de incubación de siete días a tres semanas con secreción serosa. Además, se ha informado de sensación de quemazón y alguria. En la exploración, aparte de un discreto enrojecimiento del orificio uretral y la adhesión del orificio uretral, no suele haber otros hallazgos (Fig. 1) . En el 30-50% de los hombres infectados, la infección es asintomática. El lugar más común de infección por clamidia en las mujeres es el cuello uterino, siendo la infección asintomática hasta en un 70%. Si no se trata, una infección genital por clamidia en la mujer persiste una media de dos años. Esta infección crónica asintomática parece ser la causa principal de la oclusión tubárica bilateral, que es la causa más común de infertilidad en las mujeres y se calcula que afecta a más de 100.000 mujeres en Alemania. Las manifestaciones clínicas son flujo genital blanquecino-amarillento con picor y ardor en el introito vaginal. No es infrecuente que las infecciones faríngeas se presenten además de forma asintomática, pero no requieren una terapia diferente.
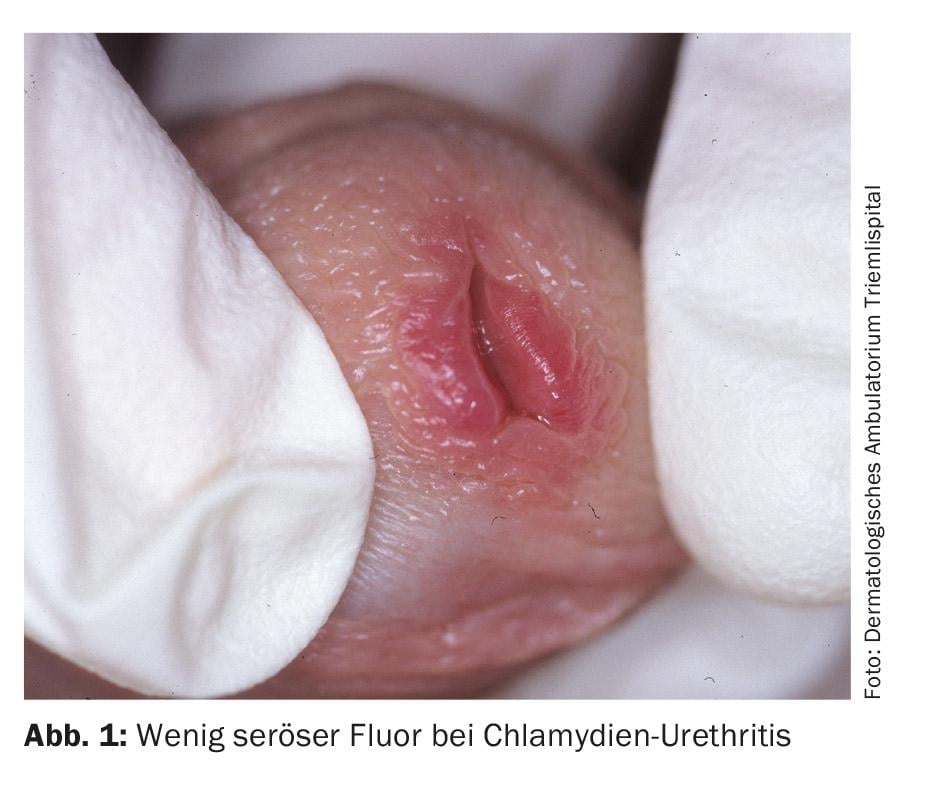
Diagnóstico: En las mujeres, los agentes patógenos se detectan mediante frotis del cuello uterino o la vagina o análisis de orina (algo menos sensibles) mediante PCR. En los hombres, también puede realizarse un análisis de orina o un frotis de la uretra.
Debido a su pequeño tamaño y a su escasa afinidad por el colorante, las clamidias no pueden verse de forma nativa ni mediante tinción. Como bacterias intracelulares obligadas, su cultivo también es difícil, por lo que ya casi no se realizan cultivos.
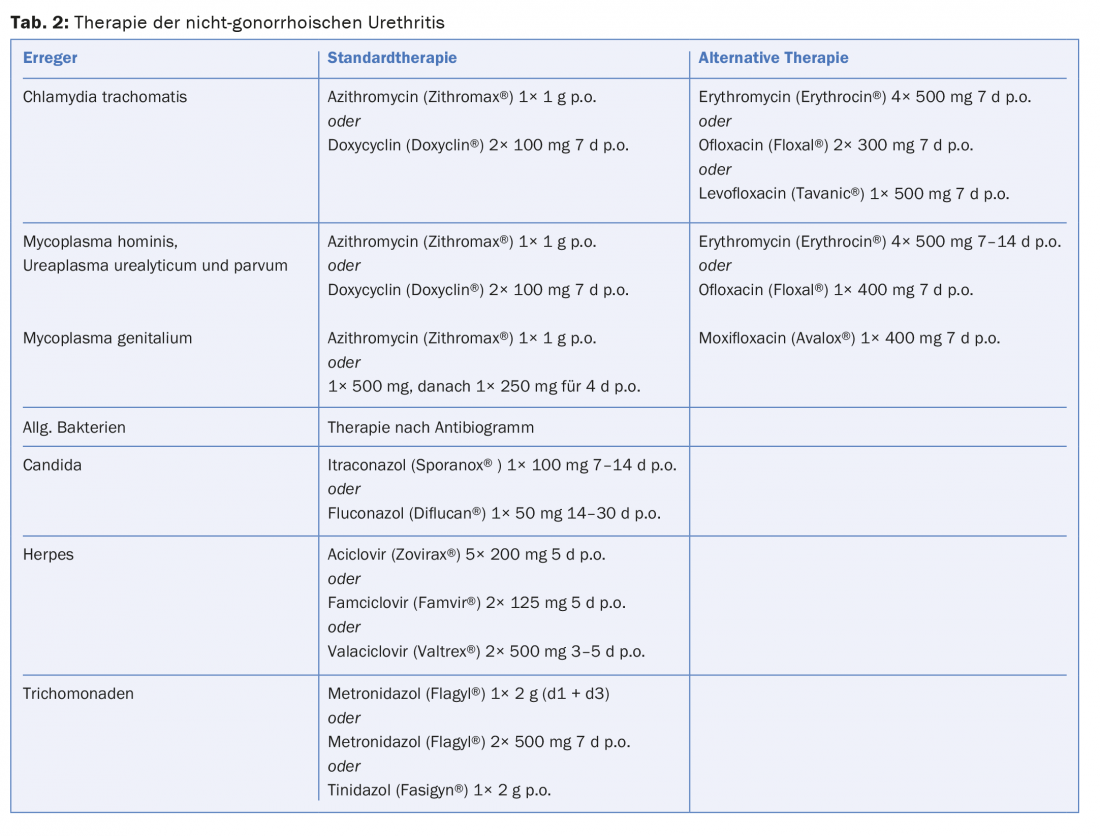
Terapia: Las infecciones urogenitales no complicadas pueden tratarse con doxiciclina 2× 100 mg durante siete días o azitromicina 1 g una vez. La eficacia de los dos antibióticos es casi equivalente, con una respuesta ligeramente mejor con la doxiciclina pero un mejor cumplimiento con la azitromicina. Como se ha documentado recientemente, las tasas de curación en la UNG parecen estar disminuyendo algo con estas terapias estándar, pero no se recomienda cambiar a otros fármacos. Basándose en los datos actuales, la azitromicina, al igual que la eritromicina, puede considerarse segura en el embarazo. Como alternativa, puede administrarse amoxicilina 3× 500 mg/día durante siete días durante el embarazo.
Micoplasma
Los micoplasmas son bacterias gramnegativas inmóviles. Se diferencian de otras bacterias por su pequeño tamaño celular, su pequeño genoma y la ausencia de pared celular. En medios de cultivo especiales, pueden distinguirse los ureaplasmas (Ureaplasma urealyticum) y los micoplasmas no ureaplasmáticos (Mycoplasma hominis). Posteriormente, U. urealyticum se dividió en Biovar 1 y Biovar 2. En 1999, la biovar 1 se clasificó como una nueva especie bacteriana independiente con el nombre de U. parvum, mientras que la biovar 2 se designó como U. urealyticum. En 1981 se descubrió otra variante, el Mycoplasma genitalium, que posteriormente se describió en varios estudios como el agente causante de la uretritis aguda y, cada vez más, también de la uretritis crónica, pero también de la cervicitis, la endometritis y en la infertilidad femenina.
La importancia de los micoplasmas genitales para el desarrollo de enfermedades de transmisión sexual es controvertida. M. hominis no parece ser responsable de la UNG en los varones, a pesar de su detección en el tracto urogenital. El U. urealyticum (Biovar 2) también puede aislarse con frecuencia del tracto genital de mujeres y hombres sanos; se han postulado posibles manifestaciones clínicas en pacientes más jóvenes, con alta concentración bacteriana, con el serotipo específico Biovar 2 y con infección inicial. La importancia del U. parvum sigue sin estar clara.
Las infecciones por micoplasma pueden causar síntomas clínicos de uretritis en los hombres, además de cursos silenciosos. Las infecciones por U. urealyticum y M. genitalium, en particular, se manifiestan en forma de uretritis aguda, pero también crónica, con disuria y fluorosis. Una característica clínica especial de la uretritis causada por M. genitalium es la asociación significativamente frecuente con balanitis y/o postitis, que no se observa con la clamidia y el ureaplasma.
Diagnóstico: Debido a su tamaño y a su escasa afinidad por los colorantes, no es posible la detección de micoplasmas en preparaciones de Gram. U. urealyticum, U. parvum y M. hominis se detectan por PCR o cultivo, M. genitalium exclusivamente por PCR. Las pruebas serológicas carecen de importancia para el diagnóstico de las infecciones por micoplasmas en la práctica clínica diaria.
Terapia: Las tetraciclinas, los antibióticos macrólidos y las quinolonas son los fármacos de elección. Doxiciclina 2× 100 mg/día durante siete días o azitromicina 1× 1 g se consideran la terapia estándar para M. hominis, U. parvum y U. urealyticum (Tab.2). En las formas crónicas de uretritis, puede ser necesaria una terapia de mayor duración. La azitromicina se recomienda para el tratamiento de la uretritis genital porque su efecto es claramente superior al de las tetraciclinas. Últimamente se observan cada vez más fracasos del tratamiento, por lo que, si no hay respuesta de 1 g de azitromicina, se favorece un tratamiento de varios días. (Tab.2). La moxifloxacina se considera el fármaco de reserva absoluto; sin embargo, recientemente también se han descrito fracasos del tratamiento inicial en casos de resistencia a macrólidos y quinolonas. Con el aumento del desarrollo de resistencias, debe seguir investigándose la importancia de otros fármacos como la sitafloxacina o la gatifloxacina para evitar la amenaza de que el M. genitalis se vuelva intratable.
Bacterias de la flora oral y anal
Las uretritis pueden estar causadas por otras numerosas bacterias. El Staphylococcus aureus puede provocar uretritis, cistitis o prostatitis, sobre todo en pacientes con sondas uretrales. Los estreptococos y especialmente los enterococos también pueden provocar uretritis. En raras ocasiones, E. coli puede causar uretritis, cistitis, prostatitis o epididimitis y pielonefritis en los hombres tras el coito anal. En raras ocasiones, una infección por Pseudomonas también puede cursar con uretritis.
Los patógenos de la flora bucal como el haemophilus influenzae y el parainfluenzae, pero también los meningococos, pueden ser causantes con no poca frecuencia, sobre todo porque el sexo oral es considerado hoy en día por muchos como supuestamente poco problemático en cuanto a la transmisión de infecciones y, en consecuencia, se utilizan pocos preservativos durante el sexo oral. Se desconoce la prevalencia real de las uretritis causadas por Haemophilus porque, por un lado, no hay obligación de informar y, por otro, el patógeno no suele incluirse en la exploración.
Diagnóstico: Siempre debe buscarse la evidencia bacteriológica del patógeno mediante cultivo para establecer el diagnóstico.
Terapia: La terapia depende del patógeno y del antibiograma.
Cándida
Candida albicans puede provocar uretritis secundaria a balanitis o vulvovaginitis, especialmente en presencia de diabetes mellitus o inmunodeficiencia.
Diagnóstico: La detección se realiza en la preparación directa y mediante cultivo micológico.
Terapia: Para la terapia se utilizan derivados del imidazol como el itraconazol 100 mg/día durante 7-14 días o el fluconazol 50 mg/día durante 14-30 días (Tab. 2).
Virus
Debe sospecharse una uretritis viral si los esclarecimientos bacteriológicos fueron infructuosos. En la uretritis por el virus del herpes simple (VHS), se produce una secreción serosa dolorosa, a menudo acompañada de erupciones herpetiformes en los genitales externos. Más raramente, se produce una infección por VHS exclusivamente intrauretral (Fig. 2).
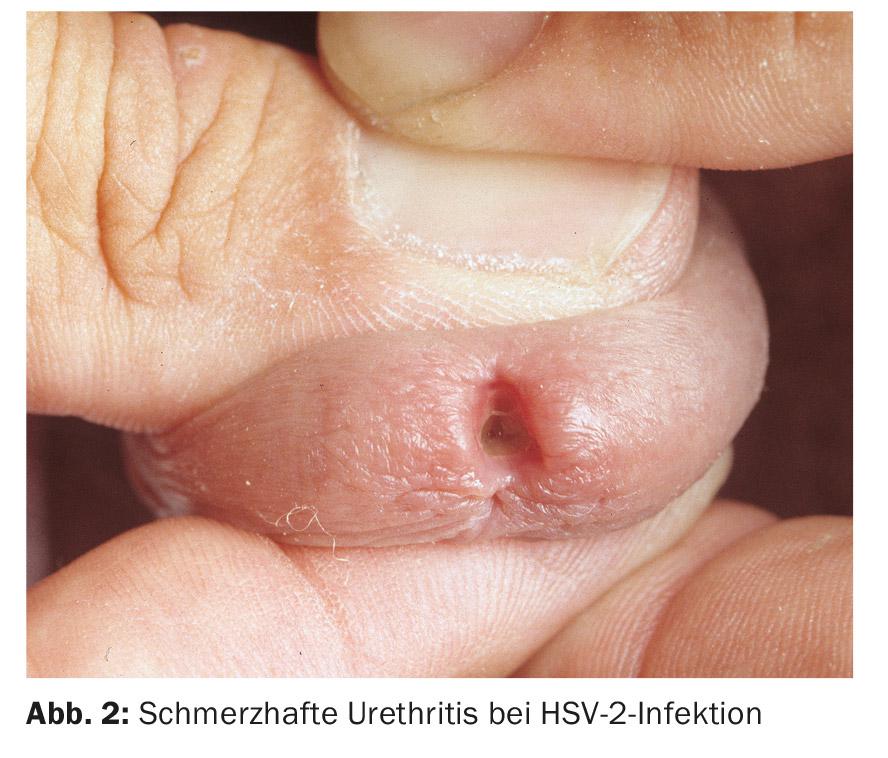
Estudios recientes han demostrado que el VHS de tipo 1 causa UNG con mayor frecuencia que el VHS de tipo 2. La proporción de VHS en la UNG se notifica de forma diferente, pero en un estudio representó hasta el 12%. Los adenovirus también pueden causar uretritis. Suele caracterizarse por una marcada meatitis y dolor (Fig. 3); en la mayoría de los casos también va acompañada de una conjuntivitis muy contagiosa (Fig. 4) . Los montones de células mononucleares en la preparación directa pueden ser innovadores desde el punto de vista del diagnóstico. Especialmente tras un contacto oral sin protección, los virus adeno y herpes simple deben considerarse la causa en ausencia de detección de patógenos, dolor pronunciado y meatitis. Los virus de Epstein-Barr también parecen tener un papel.
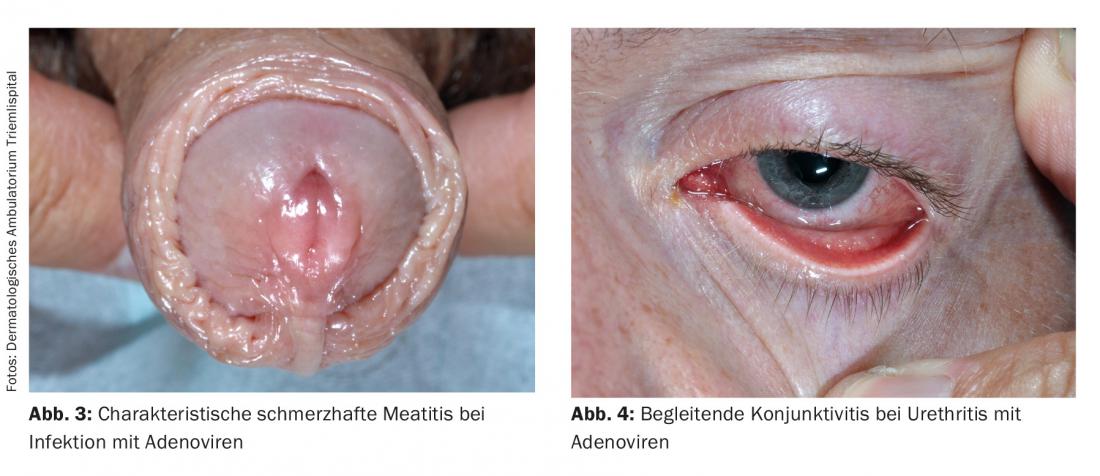
Diagnóstico: En el caso de las infecciones por herpes, se recomienda realizar una citología. La detección cultural del VHS requiere unas 48 horas. Los virus sólo pueden obtenerse de lesiones frescas para su cultivo. El material del frotis puede analizarse en pocas horas mediante PCR. Tanto el cultivo como la PCR pueden realizarse también a partir de la orina. La detección de antígenos mediante inmunofluorescencia también es adecuada para el diagnóstico. La detección de adenovirus por PCR puede realizarse por frotis o a partir de la orina.
Terapia: La terapia de la uretritis herpética se lleva a cabo con análogos de nucleósidos si es necesario.
Tricomonas
Trichomonas vaginalis es un flagelado de forma ovalada con cuatro flagelos y una membrana ondulante. La tricomoniasis es una infección de transmisión sexual que se da en todo el mundo y su prevalencia depende del comportamiento sexual de riesgo. En las estadísticas, existen diferencias considerables en las tasas de infección entre los distintos grupos de población y entre los países industrializados y los países en vías de desarrollo. En Suiza, por ejemplo, esta infección desempeña un papel menor, en contraste con Seattle, donde hasta el 20% de los casos de UNG en hombres están causados por este patógeno.
Diagnóstico: El examen microscópico de la preparación nativa con NaCl al 0,9% de la cúpula vaginal, el cuello uterino y la uretra arroja tasas de acierto de hasta el 75%. La polarización o la microscopía de campo oscuro aumentan la tasa de aciertos.
Existe una gama de medios de cultivo adecuados con una sensibilidad de alrededor del 95%. El cultivo sólo se ofrece en muy pocos laboratorios. La PCR, que tiene la mayor sensibilidad, tampoco está aún muy extendida.
Terapia: La tricomoniasis puede tratarse con metronidazol 1× 2 g con posible repetición al cabo de dos días o con 2× 500 mg/día durante siete días, pero tenga en cuenta el efecto antabústico. En raras ocasiones, puede observarse resistencia al metronidazol. También puede utilizarse tinidazol 1× 2 g como opción de tratamiento. El tinidazol tiene una semivida más larga, menos efectos secundarios y una tasa de curación ligeramente superior.
En la tabla 3 figura un ejemplo de un posible enfoque de la uretritis.

Literatura del autor
PRÁCTICA DERMATOLÓGICA 2015; 25(4): 5-10











