El tratamiento sistémico adyuvante mejora la supervivencia y la ausencia de recidiva en el cáncer de mama precoz. Los exámenes genéticos del tumor pueden ayudar en la elección de la terapia. Los cuidados de apoyo también son útiles años después de finalizar la terapia adyuvante.
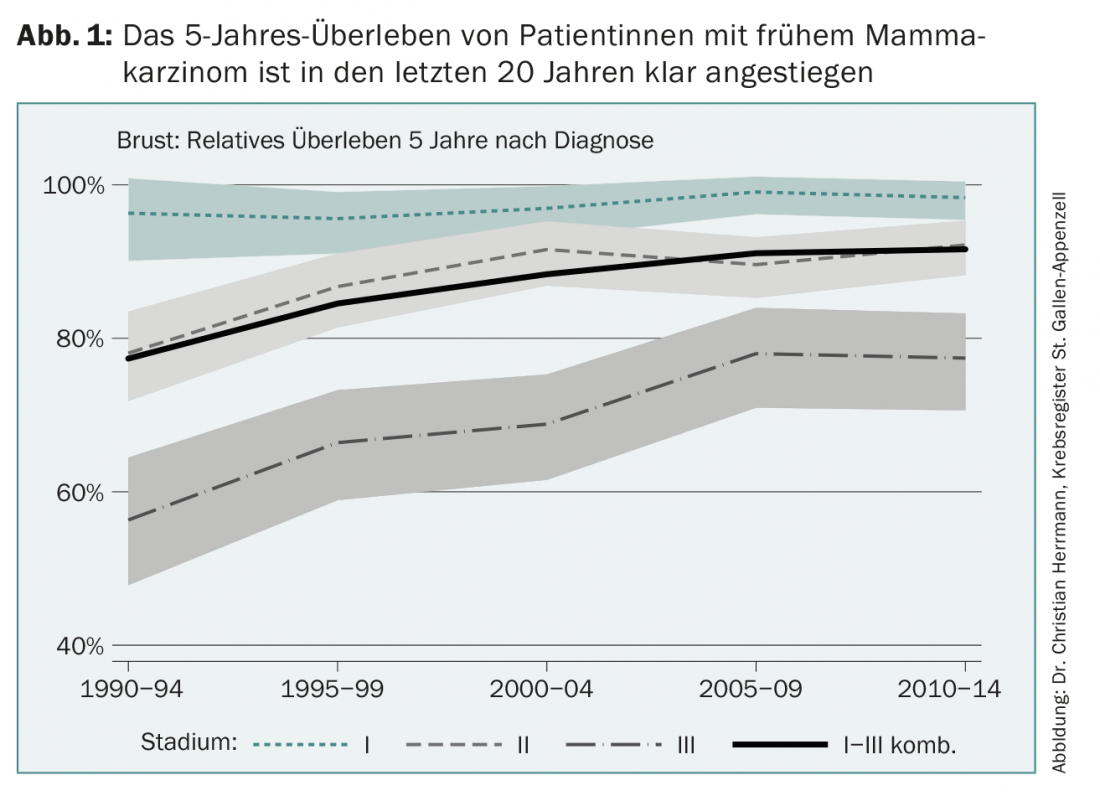
La terapia adyuvante para el cáncer de mama precoz ha avanzado mucho desde su creación hace poco más de 40 años. Hoy en día, más del 80% de las mujeres con cáncer de mama en Europa pueden curarse (Fig. 1). Este progreso tiene varias causas, como la mejora de la detección precoz, los programas de cribado mamográfico, las nuevas opciones quirúrgicas y de radiación, pero también el desarrollo continuo de las terapias adicionales del sistema farmacológico denominadas adyuvantes. Esta historia de éxito es el resultado de ensayos aleatorios internacionales y su posterior aplicación en la práctica clínica diaria, un proceso que no es en absoluto evidente. En algunos países asiáticos, por ejemplo, la tasa de supervivencia a largo plazo tras un cáncer de mama recién descubierto es ahora sólo de alrededor del 40% por diversas razones.
Las conferencias periódicas de St. Gallen sobre el tratamiento del cáncer de mama precoz, que en la actualidad se celebran cada dos años, ilustran bien la evolución científica desde los años ochenta. Estos congresos siempre van acompañados de un consenso de expertos en cáncer de mama de renombre internacional, que recibe atención mundial y se publica de forma destacada.
En los debates interdisciplinarios de las juntas de tumores habituales, se aplican directrices reconocidas en la planificación terapéutica optimizada individualizada, un procedimiento institucionalizado en los centros de mama que contribuye significativamente a la mejora de los resultados terapéuticos.
El XV Congreso de St. Gallen sobre el tema de la terapia primaria del carcinoma de mama precoz tuvo lugar por segunda vez en Viena del 15 al 18 de marzo de 2017 y se celebró bajo el lema de la planificación terapéutica individualizada. Éste debe ser lo menos invasivo posible, pero tan fuerte como sea necesario (“de-escalating and escalating treatments for early stage breast cancer”). Las recomendaciones de consenso formuladas posteriormente pueden leerse en los Anales de Oncología [1]. En años anteriores se había señalado la personalización de la terapia en adaptación a la diferente biología de los tumores. Las recomendaciones generales también deben adaptarse a los valores, deseos y posibilidades individuales de los pacientes afectados, así como a las posibilidades económicas. El grupo de expertos también señala en el consenso que los ensayos aleatorios no pueden proporcionar respuestas adecuadas en todos los casos individuales y a todas las preguntas clínicas relevantes.
Con el aumento de la supervivencia a largo plazo de las pacientes con cáncer de mama (“supervivientes”), otros aspectos están cobrando importancia, por ejemplo, las consecuencias a largo plazo de las terapias y cuestiones sociales como la reinserción profesional.
La posibilidad y utilidad de una terapia sistémica adicional depende principalmente de la biología del carcinoma, pero también de la estadificación y, por tanto, de la probabilidad de recidiva o metástasis.
Los distintos tipos de carcinomas de mama se distinguen en función de la biología molecular, una clasificación que, sin embargo, puede realizarse de forma similar en la práctica según recomendaciones consensuadas anteriores utilizando métodos inmunohistoquímicos ampliamente disponibles [2]. Estos subtipos se denominan Luminal A, Luminal B, HER 2-positivo y tripel-negativo y muestran un comportamiento diferente con las correspondientes recomendaciones terapéuticas.
Terapias de base hormonal
En el caso de que se detecten inmunohistoquímicamente receptores de estrógenos en las células tumorales, se recomienda la terapia hormonal adyuvante, en el caso de los tumores luminales A a menudo como única terapia del sistema o también como complemento de la quimioterapia, dependiendo de la constelación. Incluso una baja expresión de receptores de estrógenos es suficiente para esta indicación.
En las mujeres posmenopáusicas, uno de los inhibidores de la aromatasa letrozol, anastrozol o exemestano es preferible al tamoxifeno por su eficacia ligeramente superior. En caso de problemas de tolerancia o comorbilidades, el tamoxifeno puede utilizarse como alternativa debido al diferente perfil de efectos secundarios, especialmente si el riesgo de recidiva es menor.
Los ensayos clínicos demostraron que diez años de terapia hormonal adyuvante, ya sea con tamoxifeno [3], un inhibidor de la aromatasa [4] o una secuencia, es ligeramente superior a un periodo de tratamiento de cinco años, que ha sido la norma. Esta mayor duración de la terapia tiene importancia clínica, especialmente para las mujeres con un mayor riesgo de recaída.
En las mujeres premenopáusicas, la monoterapia con tamoxifeno sigue siendo una buena opción de tratamiento reconocida. La terapia adicional con agonistas de la LHRH o un inhibidor de la aromatasa y un agonista de la LHRH son ligeramente más eficaces -como han demostrado los ensayos aleatorizados- pero se asocian a efectos secundarios considerablemente más graves [5]. Esto suele estar justificado en los casos de mayor riesgo de recidiva, como en las mujeres menores de 35 años, en los tumores con un grado de diferenciación más pobre y en los casos de afectación de al menos cuatro ganglios linfáticos axilares; situaciones que habitualmente también han llevado a la elección de quimioterapia adyuvante adicional.
Quimioterapia para el carcinoma de mama con receptores positivos
La quimioterapia adyuvante adicional para los tumores con receptores positivos está indicada cuando el riesgo de recaída es mayor; por lo general, éste ya es el caso del tipo Luminal B.
El riesgo de recidiva puede deducirse de la biología y también depende del estadio del tumor, especialmente del número de ganglios linfáticos axilares afectados. Factores importantes son el grado de diferenciación y la tasa de proliferación, que pueden medirse inmunohistoquímicamente con el marcador Ki-67. La normalización y reproducibilidad de este factor cuantitativo supuso un reto para los patólogos.
Otro parámetro pronóstico interesante es el grado de infiltración del tumor por linfocitos. Un mayor número de TIL (linfocitos infiltrantes tumorales) indica una respuesta inmunitaria antitumoral más pronunciada y se asocia a un mejor pronóstico. Sin embargo, en la actualidad este factor no está lo suficientemente normalizado como para utilizarlo en las decisiones terapéuticas de rutina.
También existen posibilidades basadas en Internet para obtener una indicación del pronóstico con un algoritmo basado en datos clínicos/patológicos, que puede ser una ayuda en el asesoramiento de los pacientes (www.adjuvantonline.com o Predict www.predict.nhs.uk). Este último algoritmo también tiene en cuenta el nivel de proliferación Ki-67 y el estado HER 2.
Las pruebas genéticas validadas y reproducibles en el material tumoral pueden influir aún más en la decisión a favor o en contra de la quimioterapia adyuvante adicional. Esto se aplica en particular a los carcinomas de mama con receptores positivos sin afectación de los ganglios linfáticos axilares o con una afectación limitada, si el resultado de la prueba indica un pronóstico muy bueno y permite, por tanto, prescindir de la quimioterapia adicional. Existen varias pruebas competidoras establecidas a disposición de los médicos, como Oncotype®, Endopredict® o Mammaprint®. El uso de estas pruebas en estas situaciones está respaldado explícitamente por el Consenso de San Gall.
Tumores HER 2-positivos
Un año de tratamiento con trastuzumab, que actualmente también está disponible en forma subcutánea, además de quimioterapia y posiblemente terapia antihormonal, mejora sustancialmente la supervivencia libre de recidivas. La quimioterapia puede consistir en un tratamiento con antraciclinas y taxanos; en el caso de tumores pequeños con menor riesgo de recidiva, también puede limitarse a taxanos solos.
En la situación preoperatoria, la administración combinada de los anticuerpos anti-HER-2 trastuzumab y pertuzumab también puede mejorar sustancialmente la respuesta [6]. Esto también sugirió el uso postoperatorio adyuvante. Los esperados datos de los ensayos Aphinity se presentaron en el Congreso de la ASCO de 2017 y mostraron una mejora estadísticamente significativa en la ausencia de recidiva, pero en términos absolutos en un pequeño rango del 1% [7]. Por lo tanto, es probable que este costoso tratamiento adicional sólo aporte un beneficio adicional clínicamente relevante en la situación adyuvante en un grupo restringido de pacientes con un mayor riesgo de recaída.
Carcinomas triple negativos
Estos tumores que carecen de la expresión de los receptores de estrógeno y progesterona y de la sobreexpresión de los receptores HER 2 constituyen biológicamente un grupo heterogéneo. Si se opta por la terapia adyuvante, sólo se considera la quimioterapia, normalmente una combinación de antraciclinas/alquilantes y taxanos.
Los carcinomas de mama con mutaciones BRCA 1 o 2 son frecuentes, pero no siempre son carcinomas triples negativos. Para estas pacientes, puede optarse por la quimioterapia con platino. Fuera de los ensayos actualmente en curso, el uso de inhibidores de PARP no está (¿todavía?) justificado en esta situación.
Terapias neoadyuvantes
Aunque no existe una ventaja de supervivencia si se realiza una terapia sistémica necesaria antes de la cirugía para el carcinoma de mama (es decir, neoadyuvante). Sin embargo, en ese caso la operación sólo debe cubrir la zona tumoral residual, es decir, no la extensión tumoral original. Si un examen del ganglio centinela realizado después de la quimioterapia no muestra afectación tumoral, puede evitarse una escisión axilar. La ventaja del tratamiento neoadyuvante es, por tanto, la posibilidad de una terapia quirúrgica menos invasiva, que posiblemente pueda incluso llevarse a cabo conservando la mama a pesar de un tumor inicialmente grande.
La terapia neoadyuvante también da tiempo para la planificación quirúrgica, que puede ser importante para las mujeres con sospecha de mutaciones BRCA, con el fin de llevar a cabo el asesoramiento genético y el análisis del gen y, posteriormente, discutir la opción de la mastectomía, posiblemente incluso bilateral.
El consenso recomienda terapias neoadyuvantes para los carcinomas de mama HER 2 positivos y triple negativos.
Terapias antirresortivas
Basándose en los estudios austriacos que afirman que el zoledronato o el denosumab no sólo protegen contra la osteoporosis sino que también reducen el riesgo de recaída [8,9], el panel de consenso aceptó que el tratamiento adicional con bifosfonatos (aún no denosumab) estaba indicado en el estado hormonal posmenopáusico.
Terapias de apoyo
Muchos pacientes son muy receptivos a las recomendaciones dietéticas. Es motivador poder contribuir a la recuperación en un área que suele ser objeto de mucha discusión y conservar el control sobre el tratamiento, al menos en algunos aspectos. Aunque no existe una dieta real que los pacientes esperen que tenga efecto sobre un tumor existente, el asesoramiento nutricional es útil. Tanto la quimioterapia como los tratamientos (anti)hormonales pueden provocar ocasionalmente un marcado aumento de peso. Por este motivo, resulta útil un asesoramiento proactivo que incluya información equilibrada sobre el hecho de que una dieta sin azúcar, lactosa o gluten es una medida no probada en el tratamiento del cáncer. Sin embargo, la obesidad tiene una eficacia demostrada en el desarrollo del cáncer y las pacientes con cáncer de mama sin obesidad pueden esperar una mortalidad [10] y una tasa de recidiva menores.
Otro aspecto importante es realizar suficiente ejercicio físico. Cada vez hay más datos de que la actividad física puede reducir la tasa de recurrencia [11]. Hay que orientarse adecuadamente y hacer referencia a las ofertas regionales.
En 2010 ya había en Suiza casi 300.000 de las llamadas “supervivientes” de diversos tipos de tumores, de los cuales el cáncer de mama es el grupo más importante [12]. Debido al continuo aumento de las cifras, hoy habrá unos 350.000. Existen programas especiales, según la Krebsliga Ostschweiz (Liga contra el Cáncer de la Suiza Oriental), que asesoran a las mujeres de estas zonas una vez finalizado el tratamiento contra el tumor. Otro servicio importante es el apoyo psico-oncológico. También es importante prevenir activamente la osteoporosis, especialmente cuando se toman inhibidores de la aromatasa (determinación de la densidad ósea, ingesta suficiente de calcio y vitamina D, si es necesario también Prolia®).
Tras un tratamiento adyuvante intensivo, un número considerable de pacientes suele sufrir síntomas duraderos de fatiga, así como una disminución de la concentración, dificultad para encontrar palabras y olvidos (“quimiocerebro”). Estas quejas no deben descartarse simplemente como psicógenas. Existen pruebas que apuntan a cambios orgánicos y mensurables en el cerebro y han demostrado que los procesos inflamatorios cerebrales son causales [13].
Outlook
Otros fármacos nuevos se abrirán camino en la terapia adyuvante, posiblemente los inhibidores de la quinasa dependiente de ciclinas 4 y 6 (palbociclib) y los inhibidores de PARP en pacientes con mutaciones BRCA. El tratamiento de pacientes con neratinib tras el trastuzumab en carcinomas HER 2 positivos dio lugar a una menor tasa de recidiva [14]. Una posible esperanza para los carcinomas de mama tripel-negativos son las nuevas inmunoterapias.
Con las modernas terapias neoadyuvantes para el cáncer de mama HER 2 positivo, se puede observar una respuesta completa sin tumor residual en la cirugía en más de la mitad de las situaciones. Si se puede prescindir totalmente de la cirugía en estas situaciones será objeto de ensayos clínicos. En este caso, la farmacoterapia ya no sería adyuvante, sino la terapia principal para el carcinoma de mama precoz.
Mensajes para llevarse a casa
- El tratamiento sistémico adyuvante mejora significativamente la supervivencia y la ausencia de recidiva en el cáncer de mama precoz.
- Un equipo de tratamiento interdisciplinar con juntas tumorales regulares es un factor importante para la recomendación de una terapia óptima.
- Los exámenes genéticos del tumor pueden ayudar en la elección de la terapia adyuvante o conducir a una omisión de la quimioterapia.
- Los cuidados de apoyo incluso años después de finalizar la terapia adyuvante son una parte importante del tratamiento (“programa de supervivencia”).
Literatura:
- Curigliano G, et al: Tratamientos de desescalada y escalada para el cáncer de mama en fase inicial: Conferencia internacional de consenso de expertos de St. Gallen sobre la terapia primaria del cáncer de mama precoz 2017 Anales de Oncología 2017; 28(8): 1700-1712.
- Goldhirsch A, et al: Strategies for subtypes – dealing with the diversity of breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011; 22(8): 1736-1747.
- Davies C, et al: Efectos a largo plazo de continuar con el tamoxifeno adyuvante hasta los 10 años frente a suspenderlo a los 5 años tras el diagnóstico de cáncer de mama con receptores de estrógeno positivos: ATLAS, un ensayo aleatorizado. Lancet 2013; 381(9869): 805-816.
- Goss PE, et al: Ampliación de la terapia adyuvante con inhibidores de la aromatasa a 10 años. N Engl J Med 2016; 375(3): 209-219.
- Pagani O, et al: Exemestano adyuvante con supresión ovárica en el cáncer de mama premenopáusico. N Engl J Med 2014; 371: 107-118.
- Gianni L, et al: Análisis a 5 años del pertuzumab neoadyuvante y el trastuzumab en pacientes con cáncer de mama HER2-positivo localmente avanzado, inflamatorio o en fase inicial (NeoSphere): un ensayo aleatorizado de fase 2, abierto y multicéntrico. Lancet Oncol 2016; 17(6): 791-800.
- von Minckwitz G, et al: Pertuzumab y trastuzumab adyuvantes en el cáncer de mama precoz HER2-positivo. N Engl J Med 2017; 377: 122-131.
- Gnant M, et al: Ácido zoledrónico combinado con terapia endocrina adyuvante de tamoxifeno frente a anastrozol más supresión de la función ovárica en cáncer de mama premenopáusico precoz: análisis final del ensayo 12 del Austrian Breast and Colorectal Cancer Study Group Ann Oncol 2015; 26: 313-320.
- Gnant M, et al: Denosumab adyuvante en el cáncer de mama (ABCSG-18): un ensayo multicéntrico, aleatorizado, doble ciego y controlado con placebo. Lancet 2015; 386: 433-443.
- Chan DS, et al: Índice de masa corporal y supervivencia en mujeres con cáncer de mama – revisión bibliográfica sistemática y metaanálisis de 82 estudios de seguimiento. Anales de Oncología 2014; 25(10): 1901-1914.
- Dieli-Conwright CM: Reducción del riesgo de recurrencia del cáncer de mama: una evaluación de los efectos y mecanismos de la dieta y el ejercicio. Curr Breast Cancer Rep 2016; 8(3): 139-150.
- Herrmann C: Supervivientes de cáncer en Suiza: una población en rápido crecimiento a la que atender. BMC Cancer 2013; 13: 287.
- Morant R: Deterioro cognitivo asociado a la quimioterapia. Info @ oncología 2016; 6: 14-17.
- Chan A, et al: Neratinib tras la terapia adyuvante basada en trastuzumab en pacientes con cáncer de mama HER2-positivo (ExteNET): un ensayo multicéntrico, aleatorizado, doble ciego, pl acebo-controlado, de fase 3. Lancet Oncology 2016; 17: 367-377.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2017; 5(4): 10-13