El síndrome del intestino irritable es el trastorno funcional más común del tracto gastrointestinal. El artículo ofrece una actualización sobre la fisiopatología, el diagnóstico y la terapia de este complejo de síntomas.
El síndrome del intestino irritable (SII) es el trastorno funcional más común del tracto gastrointestinal, con una prevalencia estimada del 7-30% en Europa [1]. La enfermedad representa un complejo sintomático descrito por los criterios de Roma IV (Tab. 1) [2]. Se describen tres subtipos según la consistencia de las heces: SII de tipo diarrea (SII-D/SII-D), SII de tipo estreñimiento (SII-O/SII-C)-SII de tipo mixto (SII-M/SII-M).

El diagnóstico suele realizarse antes de los 50 años, y las mujeres se ven afectadas con más frecuencia que los hombres (2:1). Sólo una cuarta parte de los pacientes buscan tratamiento médico, lo que significa que el número de casos no denunciados es elevado. Los pacientes con SII tienen una calidad de vida significativamente reducida en comparación con la población normal, lo que ocasiona considerables costes directos (visitas al médico, medicación, enfermedades concomitantes) e indirectos (bajas laborales, menor rendimiento). De las comorbilidades, los trastornos psiquiátricos, especialmente la depresión, son los más comunes en los pacientes con SII, con hasta un 30% frente al 18% en la población normal [3]. También existe una alta asociación con enfermedades como la fibromialgia, la migraña y el síndrome de fatiga crónica.
Fisiopatología
El SII es una enfermedad multifactorial compleja que, a pesar de los numerosos nuevos descubrimientos de los últimos años, aún está lejos de ser comprendida (Fig. 1) . El eje cerebro-intestino implica la interacción de los sistemas autónomo, neuroendocrino y neuroinmunológico con el sistema nervioso central. El tracto gastrointestinal está muy inervado y una multitud de fibras nerviosas aferentes generan información sobre el contenido intestinal y los procesos reguladores de la digestión, la absorción y la defensa inmunitaria [4]. En el SII, hay pruebas de que tanto el procesamiento central de esta información como la respuesta a las señales intestinales están alterados [5]. La característica común de las enfermedades funcionales del tracto gastrointestinal es la hipersensibilidad visceral. Los pacientes con SII tienen un umbral perceptivo y de dolor más bajo ante los estímulos intestinales, lo que puede favorecer aún más la sensibilización nerviosa central [6]. En última instancia, la causa de esta sensibilización no está clara. En el SII también se conocen alteraciones sutiles de la motilidad gastrointestinal, posiblemente como efector de la hipersensibilidad visceral, que pueden provocar un tiempo de tránsito prolongado o acelerado, según la gravedad.
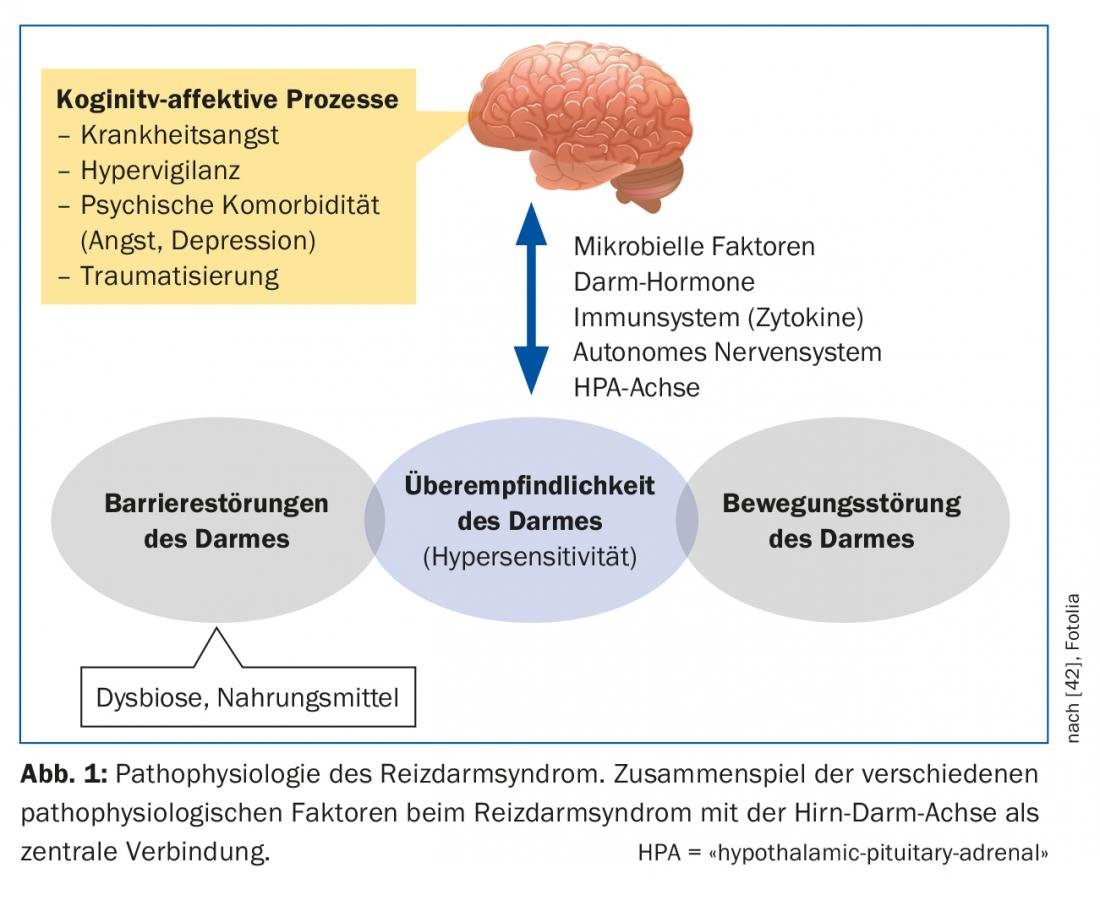
La mucosa del intestino tiene una superficie enorme con la que estamos en contacto diario con el mundo exterior. Esta interacción puede estar alterada de varias maneras en los pacientes con SII. La llamada barrera intestinal consiste en una capa singular de conexiones celulares (“uniones estrechas”). Si no funcionan correctamente, pueden aumentar la permeabilidad intestinal (“intestino permeable”). Así, los antígenos pueden penetrar en el epitelio y desencadenar y mantener procesos inmunológicos o inflamatorios [7]. El microbioma intestinal también desempeña un papel en este sentido. Está formada por un gran número de especies bacterianas diferentes y es parte integrante de muchos procesos en la zona de la barrera intestinal. Si se altera el equilibrio natural, se produce una disbiosis intestinal, que puede ocurrir por diversas razones (por ejemplo, la terapia con antibióticos). Existen pruebas de que los pacientes con SII presentan una disbiosis cuantitativa y cualitativa que puede afectar a la función del eje intestino-cerebro. También se discute si una inflamación persistente y de bajo grado de la mucosa, por ejemplo tras infecciones gastrointestinales agudas, puede alterar la permeabilidad intestinal. En estudios individuales, se encontró un aumento de las células inflamatorias en la mucosa de los pacientes con SII [8].
El papel del estrés crónico, especialmente tras experiencias traumáticas en la infancia, puede favorecer la probabilidad de una reacción excesiva al dolor en la edad adulta [9]. El estrés también puede influir en el eje hipotalámico del cortisol y, por tanto, en los procesos inflamatorios de la mucosa.
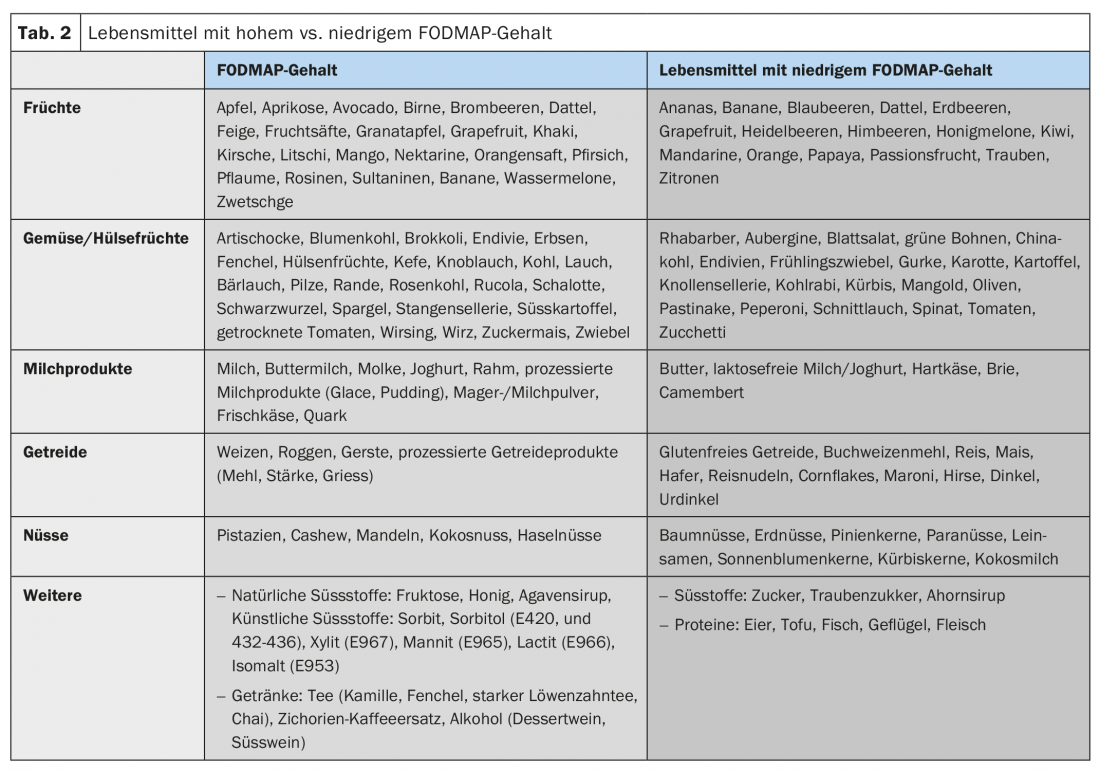
La mayoría de los pacientes describen un aumento de sus síntomas después de las comidas y la mayoría de los pacientes saben qué alimentos deben evitar [10]. Debido a los efectos osmóticos y a la fermentación bacteriana, los componentes alimentarios poco absorbibles en particular, incluidos los denominados FODMAP (oligo-, di- y monosacáridos y polioles fermentables), pueden agravar las molestias abdominales relacionadas con el SII (Tab. 2). Sin embargo, la fermentación de estos FODMAP también depende de la composición del microbioma intestinal. Además, se sospechan interacciones bioactivas directas con la mucosa y activaciones inmunitarias por los alimentos. Los factores cognitivos (la anticipación del dolor después de las comidas) también desempeñan un papel en este caso.
El SII se da en familias, lo que sugiere un trasfondo genético además de factores sociales. Los gemelos monocigóticos tienen más probabilidades de padecer SII que los dicigóticos (33% frente a 13%) y los antecedentes familiares positivos son más frecuentes en el SII que en la población normal (33% frente a 2%) [11].
Diagnóstico
El SII no es un diagnóstico de exclusión, pero puede establecerse con la ayuda de los criterios de Roma IV y un número limitado de exámenes. Si no hay signos de alarma – edad >50 años, pérdida de peso, fiebre, secreción de sangre ab ano, disfagia, vómitos, fiebre, anemia, antecedentes familiares positivos de tumores colorrectales, enfermedad inflamatoria intestinal y enfermedad celíaca – el SII puede diagnosticarse con bastante certeza si se cumplen los criterios de Roma [12]. Sólo en el 5% de todos los pacientes con SII se encuentra una enfermedad orgánica durante el curso de la enfermedad, pero especialmente en el primer año tras la aparición de los síntomas del SII es importante excluir enfermedades sistémicas relevantes [13]. Después de los 50 años, la probabilidad de padecer cáncer de colon tras un (supuesto) diagnóstico de SII es del 1%, una cifra significativamente superior a la de la población normal. En las mujeres, siempre debe considerarse la posibilidad de un cáncer de ovario, ya que los síntomas similares a los del SII suelen aparecer como primer síntoma [14].
En los pacientes con SDR-D, se recomienda excluir serológicamente la enfermedad celíaca y determinar los anticuerpos IgA transglutaminasa e IgA total. La prevalencia de la deficiencia de IgA en la enfermedad celíaca es del 1,7-3%, significativamente mayor que en la población general (0,2%). Los HLA-DQ2 y -DQ8 no deben utilizarse como prueba de cribado.
convertirse.
Hasta un 40% de los pacientes con enfermedad inflamatoria intestinal cumplen también los criterios del SII, por lo que debe descartarse la inflamación intestinal con la determinación no invasiva y rentable de la calprotectina fecal. El riesgo de enfermedad inflamatoria intestinal con una calprotectina <40 ug/g es inferior al 1% [15]. La desventaja es que la calprotectina no es muy específica, por lo que deben realizarse más aclaraciones si los valores son elevados.
En presencia de síntomas típicos del SII sin signos de alarma, la probabilidad de cáncer de colon o enfermedad inflamatoria intestinal es de alrededor del 1%, por lo que las directrices estadounidenses recomiendan la colonoscopia sólo en pacientes mayores de 50 años [16]. Las directrices europeas recomiendan la colonoscopia para el SDR-D incluso antes de los 50 años, sobre todo para excluir la colitis microscópica [17].
En los casos que siguen sin estar claros, pueden ser útiles investigaciones de laboratorio más amplias: Marcadores inflamatorios sistémicos (PCR, hemograma diferenciado), parámetros de malabsorción (estado del hierro, vitaminas, albúmina), TSH, elastasa pancreática en heces, prueba de aliento de lactosa H2, parasitología en heces).
Suele realizarse una ecografía en la evaluación inicial de las molestias abdominales para descartar patología macroscópica porque está fácilmente disponible y es barata. Sin embargo, no existen pruebas positivas sobre su beneficio en el diagnóstico del SII.
En resumen, el diagnóstico del SII se basa en cuatro factores: la historia clínica, la exploración física, un número limitado de pruebas de laboratorio y la endoscopia en casos seleccionados. Además, debe mencionarse el examen ginecológico en las mujeres.
Terapia
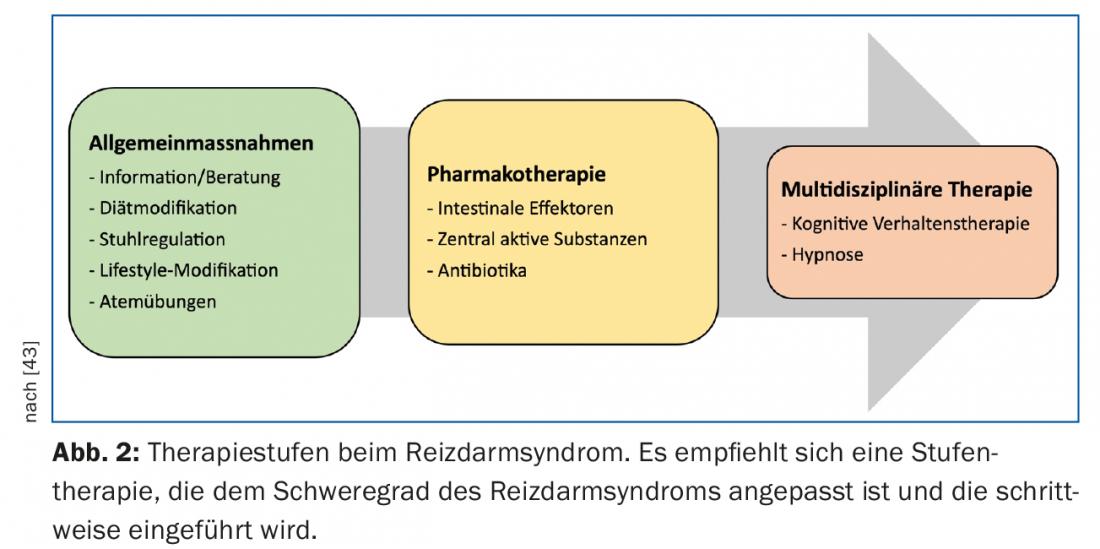
En el tratamiento del SII se recomienda un enfoque escalonado, teniendo en cuenta la gravedad de los síntomas descritos (Fig. 2) . La mayoría de los pacientes pueden ser tratados con éxito en la consulta del médico de familia. Sólo una pequeña proporción con un curso difícil y refractario de la enfermedad se beneficia de la atención de una consulta especializada de gastroenterología.
Un componente central en el tratamiento del SII es una relación médico-paciente estable e intacta. Los pacientes con SII se quejan a menudo de una falta de empatía y comprensión hacia los síntomas que describen, lo que, además de quejas persistentes, conduce también a consultas repetidas, demandas de más aclaraciones y no pocas veces también a cambios regulares de médico. La terapia básica consiste en un diagnóstico detallado con una explicación comprensible y orientada al paciente de la fisiopatología y las opciones terapéuticas sin terminología médica. La autenticidad de las quejas debe partir de la credibilidad del paciente y los temores deben tomarse en serio. Es especialmente importante preguntar sobre la comprensión de la enfermedad y las expectativas, pero al mismo tiempo deben fijarse objetivos realistas (“una certeza diagnóstica del 100% no es posible”). Los pacientes deben participar en las decisiones sobre el tratamiento, de modo que se pueda influir positivamente en la satisfacción/calidad de vida y en la evolución de la enfermedad.
Modificación de la dieta: La mayoría de los pacientes ya informan de autodietas de exclusión en el pasado durante la consulta inicial, sin embargo, un ajuste estructurado de la dieta suele ser el primer paso en el tratamiento de los síntomas del SII. Los componentes de los alimentos poco absorbibles y osmóticamente activos, especialmente los llamados FODMAP, desempeñan un papel en este sentido. La eficacia de una dieta baja en FODMAP en el SII ha quedado demostrada en varios estudios (en torno a un 70% de respuesta clínica), por lo que las modificaciones dietéticas deben ser siempre uno de los primeros pasos terapéuticos en el SII [18]. Según los datos actuales, no se puede recomendar una dieta sin gluten a prueba por sí sola.
Terapia analgésica: Los espasmolíticos anticolinérgicos se utilizan muy a menudo en el SII, aunque la evidencia sobre el efecto de estos fármacos es pobre [19]. En Suiza se utilizan principalmente las siguientes sustancias: Butilescopalamina (Buscopan®), Mebeverina (Duspatalin®), Bromuro de pinaverina (Dicetel®), Trimebutina (Debridat®) y Metixen (Spasmocanulase®). Los posibles efectos secundarios pueden incluir sequedad de boca y alteraciones visuales.
Los fitoterapéuticos son bien aceptados por los pacientes; el más utilizado en Suiza es Iberogast®, una mezcla a base de alcohol de nueve extractos de plantas. Un ensayo aleatorizado controlado con placebo mostró una mejora significativa del dolor abdominal asociado al SII [20]. También se ha demostrado una reducción significativa de los síntomas del SII con las cápsulas de aceite de menta piperita (Colpermin®), de uso frecuente [21,22]. En este caso, el efecto es probablemente multifactorial, incluyendo efectos antagonistas sobre los canales de calcio (relajación muscular) y efectos agonizantes sobre los receptores opioides. Otro preparado es el concentrado de alcachofa Hepa-S®, pero aquí los limitados datos no muestran ningún beneficio definitivo [23].
Los antidepresivos como los inhibidores de la recaptación de serotonina (ISRS) y los antidepresivos tricíclicos tienen como objetivo corregir un déficit serotoninérgico con un efecto sobre el eje intestino-cerebro. En una revisión Cochrane [24], se obtuvieron efectos positivos tanto en el bienestar general como específicamente en las molestias abdominales (número necesario a tratar (NNT) = 4 resp. 5). Sin embargo, los pacientes con SII sin depresión como comorbilidad no parecen beneficiarse de la terapia con ISRS.
Tratamiento del SII con estreñimiento: El uso de agentes aumentadores de volumen como la esterculia (Colosan®, Normacol®) y el psilio/linaza (Metamucil®, Mucilar®, Linomed®) o laxantes isoosmóticos a base de polietilenglicol (Transipeg®, Movicol®) puede mejorar la frecuencia y consistencia de las deposiciones, pero estos preparados no tienen efecto sobre el dolor abdominal asociado al SII ni sobre la flatulencia [19]. Deben evitarse los laxantes estimulantes debido a su escasa tolerancia.
La linaclotida (Constella®) es un agonista de la guanilato ciclasa que actúa localmente en el intestino y está aprobado para el tratamiento del SII con estreñimiento. La acción del receptor local conduce a la activación de los canales iónicos en el intestino y, por tanto, a la secreción de cloruro, bicarbonato y agua en la luz intestinal. Además, también tiene un efecto analgésico sobre los nociceptores del intestino. La linaclotida aumenta significativamente el número de defecaciones completas y reduce el número y la gravedad del dolor abdominal [25,26].
La lubiprostona (Amitiza®) es un activador de los canales de cloruro que actúa localmente en el intestino y está aprobado en Suiza para el tratamiento del estreñimiento crónico idiopático y el estreñimiento inducido por opiáceos. En dosis más bajas, el fármaco también está aprobado en EE.UU. y Japón para el SII-O, donde ha mostrado buenos resultados para los síntomas del SII (dolor, hinchazón) [27].
La prucaloprida (Resolor®) es un agonista selectivo de alta afinidad de los receptores de serotonina (5-HT4) aprobado en Suiza para el tratamiento del estreñimiento crónico idiopático. Existen datos para su uso en el SII-O que han demostrado un efecto positivo sobre los síntomas del SII [28].
Tratamiento del SII con diarrea: La loperamida (Imodium®) se utiliza a menudo en el SII-D para regular las heces, pero no tiene ningún efecto sobre los síntomas de dolor. En combinación con un agente hinchante, se puede mejorar el efecto antidiarreico. Para el tratamiento de la diarrea, también puede utilizarse a modo de prueba el aglutinante de ácidos biliares colestiramina (Quantalan®), ya que alrededor del 25% de todos los pacientes con SII-D muestran evidencias de un síndrome de pérdida de ácidos biliares [29]. En estudios no aleatorizados, se ha demostrado que la colestiramina reduce la frecuencia de las deposiciones y las molestias abdominales [30].
La eluxadolina (Truberzi®) es un agonista de los receptores μ-opioides y κ-opioides y antagonista de los receptores δ-opioides que actúa localmente en el intestino, por lo que tiene propiedades antidiarreicas y analgésicas. En febrero de 2018, el fármaco fue aprobado por Swissmedic para el tratamiento del SII-D, pero aún no está disponible en Suiza. En un ensayo aleatorizado, Truberzi mostró un mejor control del dolor y la diarrea que el placebo tras 12 semanas de terapia durante el periodo posterior de 1 año [31]. Esto también se aplicó a los pacientes que habían sido tratados previamente con la loperamida del receptor μ-opioide [32].
El ondansetrón (Zofran®) es un antagonista de los receptores de serotonina (5-HT3) aprobado en Suiza para el tratamiento de las náuseas asociadas a la quimioterapia. En los pacientes con SII-D también se observó una ralentización del peristaltismo intestinal y una reducción de la hipersensibilidad visceral y del dolor abdominal [33]. Está previsto realizar más estudios para confirmar estos prometedores resultados.
La rifaximina (Xifaxan®) es un antibiótico intestinal específico aprobado en Suiza para la prevención de las recaídas en la encefalopatía hepática. En EE.UU., el fármaco también puede utilizarse para el tratamiento del SII-D. Se demostró que la rifaximina tenía un efecto positivo sobre los síntomas del SII durante las diez semanas siguientes tras dos semanas de terapia (entre un 8 y un 10% más a menudo que el placebo) [34]. La terapia antibiótica parece provocar un cambio positivo en el microbioma intestinal, pero los mecanismos exactos no están claros. Si es necesario, el ciclo terapéutico puede repetirse como se desee. Las preocupaciones iniciales sobre el desarrollo de resistencias no se han confirmado y el perfil de efectos secundarios es bajo.
Las pruebas del uso de probióticos en el SII no son concluyentes, los estudios son heterogéneos, con resultados positivos en la mayoría de los estudios más pequeños. Lactobacillus spec., Bifidobacterius spec. y Saccharomyces boulardii parecen dar los mejores resultados. En una reciente revisión sistemática, se demostró que los probióticos son eficaces en determinados pacientes con síndrome del intestino irritable. [35].
Terapias no farmacológicas: Parece existir cierto beneficio de la terapia cognitivo-conductual y la hipnosis en el tratamiento del SII, pero sigue sin estar claro si la mejora de los síntomas del SII está relacionada con una reducción efectiva del dolor visceral o simplemente refleja un mejor procesamiento del dolor. En dos análisis Cochrane de 2009, el efecto de estas terapias se evaluó con cautela [36,37]. En una reciente revisión sistemática, se valoró positivamente el efecto de estas terapias, pero la forma de contacto, la duración del tratamiento y el tipo de comunicación aún no están claramente definidos [38].
Tratamiento del SII con síntomas de distensión abdominal: La distensión abdominal con o sin aumento visible del perímetro abdominal es una característica de diversas enfermedades funcionales del tracto gastrointestinal y suele resultar muy molesta para los pacientes. Aparte de las modificaciones dietéticas (dieta baja en FODMAP) y el uso de rifaximina, existen pocas opciones terapéuticas. No existen pruebas del uso de sustancias antiespumantes como la simeticona (Flatulex®) o la dimeticona (Spasmocanulase®) para las quejas de flatulencia de origen funcional. Su utilidad es mayoritariamente decepcionante. Varios estudios elegantes han demostrado que la flatulencia en los pacientes con SII no está causada por un aumento del volumen de gas intestinal, sino por desplazamientos caudo-ventrales del contenido intraabdominal. Más bien, debido a un reflejo viscero-somático, se produce una reacción muscular anormal del diafragma (contracción) y de los músculos abdominales inferiores (relajación), que da lugar a la protrusión del abdomen [39]. A continuación, el mismo grupo de investigación fue capaz de lograr una reducción significativa de los síntomas y también del perímetro abdominal en pacientes con SII con síntomas agudos de distensión abdominal con la ayuda de una terapia respiratoria específica asistida por biorretroalimentación [40]. En un ensayo aleatorio posterior, los síntomas de flatulencia siguieron disminuyendo con el ejercicio regular durante un periodo de observación de seis meses [41].
Resumen
El síndrome del intestino irritable sigue siendo un complejo sintomático que sólo se está empezando a comprender, y las opciones de tratamiento son aún limitadas. Con una mayor comprensión de la fisiopatología, probablemente será posible caracterizar más subtipos en el actualmente muy heterogéneo pozo de las enfermedades funcionales intestinales. No sobre la base de los síntomas clínicos, como intentan hacer hoy los criterios de Roma IV, sino con la ayuda de biomarcadores que, en el mejor de los casos, permitirán un diagnóstico positivo de este cuadro clínico en el futuro. Una mejor comprensión de la fisiopatología conduciría entonces inevitablemente al desarrollo de nuevos enfoques terapéuticos que vayan más allá del tratamiento actual puramente orientado a los síntomas.
Mensajes para llevarse a casa
- El síndrome del intestino irritable no es un diagnóstico de exclusión, pero puede establecerse con la ayuda de los criterios de Roma IV y un número limitado de exámenes.
- El tratamiento del SII se basa en un enfoque gradual que tiene en cuenta la gravedad.
- Las modificaciones de la dieta, especialmente de los FODMAP (oligo-, di- y monosacáridos fermentables), y una dieta baja en polioles deben ser uno de los primeros pasos terapéuticos.
- Los síntomas de flatulencia funcional pueden aliviarse con fisioterapia y terapia respiratoria.
Literatura:
- Saha L: Síndrome del intestino irritable: patogenia, diagnóstico, tratamiento y medicina basada en la evidencia. World J Gastroenterol 2014; 20(22): 6759-6773.
- Lacy BE, et al: Trastornos intestinales. Gastroenterología 2016; 150(6): 1393-1407e5.
- Grundmann O, Yoon SL: Síndrome del intestino irritable: epidemiología, diagnóstico y tratamiento: actualización para profesionales sanitarios. J Gastroenterol Hepatol 2010; 25(4): 691-699.
- Brookes SJH, Spencer NJ, Costa M, Zagorodnyuk VP: Señalización aferente primaria extrínseca en el intestino. Nat Rev Gastroenterol Hepatol 2013; 10(5): 286-296.
- Lee YJ, Park KS: Síndrome del intestino irritable: paradigma emergente en fisiopatología. World J Gastroenterol 2014; 20(10): 2456-2469.
- Soares RLS: Síndrome del intestino irritable: una revisión clínica. World J Gastroenterol 2014; 20(34): 12144-12160.
- Matricon J, et al.: Artículo de revisión: Asociaciones entre la activación inmunitaria, la permeabilidad intestinal y el síndrome del intestino irritable. Aliment Pharmacol Ther 2012; 36(11-12): 1009-1031.
- Katiraei P, Bultron G: Necesidad de un enfoque médico integral de la neuroinmunogastroenterología del síndrome del intestino irritable. World J Gastroenterol 2011; 17(23): 2791-27800.
- Larauche M, Mulak A, Taché Y: Alteraciones de la sensación visceral relacionadas con el estrés: estudio de modelos animales para el síndrome del intestino irritable. J Neurogastroenterol Motil 2011; 17(3): 213-234.
- Heizer WD, Southern S, McGovern S: El papel de la dieta en los síntomas del síndrome del intestino irritable en adultos: una revisión narrativa. J Am Diet Assoc 2009; 109(7): 1204-1214.
- El-Salhy M: Síndrome del intestino irritable: Diagnóstico y patogénesis. World J Gastroenterol 2012; 18(37): 5151-5163.
- Whitehead WE, Palsson OS, Simrén M: Síndrome del intestino irritable: ¿qué significan las nuevas directrices diagnósticas Roma IV para el tratamiento de los pacientes? Expert Rev Gastroenterol Hepatol 2017; 11(4): 281-283.
- El-Serag HB, Pilgrim P, Schoenfeld P: Revisión sistemática: Historia natural del síndrome del intestino irritable. Aliment Pharmacol Ther 2004; 19(8): 861-870.
- Hamilton W, Peters TJ, Bankhead C, Sharp D: Riesgo de cáncer de ovario en mujeres con síntomas en atención primaria: Estudio de casos y controles basado en la población. BMJ 2009; 339(7721): 616.
- Menees SB, et al: Un metaanálisis de la utilidad de la proteína C reactiva, la velocidad de sedimentación globular, la calprotectina fecal y la lactoferrina fecal para excluir la enfermedad inflamatoria intestinal en adultos con SII. Am J Gastroenterol 2015; 110(3): 444-454.
- AGA: Declaración de posición médica de la Asociación Americana de Gastroenterología: Síndrome del intestino irritable. Gastroenerología 2002; 123(6): 2105-2107.
- Layer P, et al.: Síndrome del intestino irritable S3-Leitlinie: Definición, fisiopatología, diagnóstico y terapia. Directriz conjunta de la Sociedad Alemana de Enfermedades Digestivas y Metabólicas (DGVS) y la Sociedad Alemana de Neurogastroenterología y Motilidad. Revista de Gastroenterología 2011; 49(2): 237-293.
- Halmos EP, et al: Una dieta baja en FODMAP reduce los síntomas del síndrome del intestino irritable. Gastroenterología 2014; 146(1): 67-75.
- Ruepert L, et al: Agentes de carga, antiespasmódicos y antidepresivos para el tratamiento del síndrome del intestino irritable. Cochrane Database Syst Rev 2011; (8): CD003460.
- Madisch A, Holtmann G, Plein K, Hotz J: Tratamiento del síndrome del intestino irritable con preparados a base de plantas: Resultados de un ensayo multicéntrico doble ciego, aleatorizado y controlado con placebo. Aliment Pharmacol Ther 2004; 19(3): 271-279.
- Merat S, et al.: Efecto del aceite de menta de liberación retardada con recubrimiento entérico en el síndrome del intestino irritable. Dig Dis Sci 2010; 55(5): 1385-1390.
- Khanna R, MacDonald JK, Levesque BG: Aceite de menta para el tratamiento del síndrome del intestino irritable: revisión sistemática y metaanálisis. J Clin Gastroenterol 2014; 48(6): 505-512.
- Liu J, et al: Hierbas medicinales para el tratamiento del síndrome del intestino irritable (Revisión). Cochrane Database Syst Rev 2006; (1): CD004116.
- Kaminski A, et al: Antidepresivos para el tratamiento de los trastornos gastrointestinales funcionales relacionados con el dolor abdominal en niños y adolescentes. Cochrane Database Syst Rev 2011; (7): CD008013.
- Chey WD, et al: Linaclotida para el síndrome del intestino irritable con estreñimiento: un ensayo aleatorizado, doble ciego y controlado con placebo de 26 semanas de duración para evaluar la eficacia y la seguridad. Am J Gastroenterol 2012; 107(11): 1702-1712.
- Rao S, et al: Ensayo aleatorizado y controlado de 12 semanas con un periodo de retirada aleatorizado de 4 semanas para evaluar la eficacia y la seguridad de la linaclotida en el síndrome del intestino irritable con estreñimiento. Am J Gastroenterol 2012; 107(11): 1714-1724.
- Drossman DA, et al: Ensayo clínico: Lubiprostona en pacientes con síndrome del intestino irritable asociado a estreñimiento – Resultados de dos estudios aleatorizados controlados con placebo. Aliment Pharmacol Ther 2009; 29(3): 329-341.
- Malagelada C, et al.: Efecto de la prucaloprida sobre la tolerancia intestinal a los gases en pacientes con trastornos funcionales intestinales y estreñimiento. J Gastroenterol Hepatol 2017; 32(8): 1457-1462.
- Wedlake L, et al: Revisión sistemática: Prevalencia de la malabsorción idiopática de ácidos biliares diagnosticada mediante la exploración SeHCAT en pacientes con síndrome del intestino irritable con diarrea predominante. Aliment Pharmacol Ther 2009; 30(7): 707-717.
- Camilleri M: Opciones de tratamiento del síndrome del intestino irritable. Mayo Clin Proc 2018; 93(12): 1858-1872.
- Lembo AJ, et al: Eluxadoline para el síndrome del intestino irritable con diarrea. N Engl J Med 2016; 374(3): 242-253.
- Lacy BE, et al: Eficacia de la eluxadolina en pacientes con SII-D que informan del uso previo de loperamida. Am J Gastroenterol 2017; 112(6): 924-932.
- Garsed K, et al: Ensayo aleatorizado del ondansetrón para el tratamiento del síndrome del intestino irritable con diarrea. Gut 2014; 63(10): 1617-1625.
- Pimentel M, et al: Terapia con rifaximina para pacientes con síndrome del intestino irritable sin estreñimiento. N Engl J Med 2011; 364(1): 22-32.
- Hungin APS, et al: Revisión sistemática: probióticos en el tratamiento de los síntomas gastrointestinales bajos en la práctica clínica — una guía internacional basada en la evidencia. Aliment Pharmacol Ther 2013; 38(8): 864-886.
- Webb AN, Kukuruzovic RH, Catto-Smith AG, Sawyer SM: Hipnoterapia para el tratamiento del síndrome del intestino irritable. Base de datos Cochrane Syst Rev 2007; (4): CD005110.
- Zijdenbos IL, et al: Tratamientos psicológicos para el manejo del síndrome del intestino irritable. Cochrane Database Syst Rev 2009; (1): CD006442.
- Radziwon CD, Lackner JM: Terapia cognitivo-conductual para el SII: ¿hasta qué punto es útil, con qué frecuencia y cómo funciona? Curr Gastroenterol 2017; 19(10): 49.
- Accarino A, et al: La distensión abdominal es el resultado de la redistribución caudoventral del contenido. Gastroenterología 2009; 136(5): 1544-1551.
- Barba E, et al: Mecanismos abdominotorácicos de la distensión abdominal funcional y corrección mediante biorretroalimentación. Gastroenterología 2015; 148(4): 732-739.
- Barba E, Accarino A, Azpiroz F: Corrección de la distensión abdominal mediante el control guiado por biorretroalimentación de la actividad muscular abdominotorácica en un ensayo aleatorizado controlado con placebo. Clin Gastroenterol Hepatol 2017; 15(12): 1922-1929.
- Van Oudenhove LV, et al: Aspectos biopsicosociales de los trastornos gastrointestinales funcionales: cómo contribuyen los procesos centrales y ambientales al desarrollo y la expresión de los trastornos gastrointestinales funcionales. Gastroenterología 2016; 150(6): 1355-1367.e2.
- Jaynk GS, Gyawali CP: Síndrome del intestino irritable: conceptos modernos y opciones de tratamiento. The American journal of Medicine 2015; 128(8): 817-827.
PRÁCTICA GP 2019; 14(1): 11-18











