La terapia del CPNM ALK-positivo o ROS1-positivo se ha desarrollado considerablemente en los últimos años con la disponibilidad de varios inhibidores de ALK o ROS1. En esta CME se resumen y discuten las directrices actuales de la ESMO y los datos de los estudios más importantes.
Con 4300 nuevos diagnósticos al año, el carcinoma bronquial es uno de los tipos de cáncer más frecuentes en Suiza [1]. La enfermedad también está asociada a la mortalidad más alta (21,6%) relacionada con el cáncer en los hombres y la segunda más alta (15,7%) en las mujeres, después del cáncer de mama [1]. El cáncer de pulmón no microcítico (CPNM) está presente en el 85% de los pacientes, con mayor frecuencia con histología de adenocarcinoma (40%). Además, pueden detectarse fusiones de la quinasa del linfoma anaplásico (ALK) en aproximadamente el 5% de los tumores y fusiones del protooncogén 1, receptor tirosina quinasa (ROS1) en aproximadamente el 4,5% [2]. En comparación con el resto de la población, los pacientes con CPNM positivo para ALK o ROS1 son más jóvenes y, con mayor frecuencia, nunca han fumado o han fumado poco [3,4]. Mientras tanto, la prueba de biomarcadores ALK/ROS1 es un componente establecido en el diagnóstico del CPNM y constituye una base necesaria para las decisiones terapéuticas [5]. Para los pacientes con enfermedad metastásica (estadio IV), el tratamiento se sitúa en el ámbito paliativo y tiene como objetivo mejorar los síntomas, al menos mantener la calidad de vida y prolongar la supervivencia global [6]. Con la aprobación de los inhibidores de ALK del 1. (Crizotinib), 2. (alectinib, ceritinib) y 3ª generación (lorlatinib), se revolucionó y personalizó la terapia [7]. En esta CME se resumen y discuten las directrices actuales de la ESMO y los datos de los estudios más importantes. Aquí nos centraremos en los medicamentos aprobados en Suiza [8].
Terapia de primera línea
Las directrices de la ESMO recomiendan el uso de crizotinib, alectinib, ceritinib o brigatinib** en la primera línea de tratamiento (Tab. 1) [5]. En el ensayo PROFILE-1014, se observó una prolongación significativa de la mediana de la supervivencia libre de progresión (SLP) con crizotinib en comparación con la quimioterapia con cisplatino o carboplatino en combinación con pemetrexed (10,9 frente a 7,0 meses, HR 0,45, p>0,001) [13]. Las tasas de respuesta objetiva (ORR) fueron del 74% con crizotinib y del 45% en el brazo de quimioterapia [13]. Tras un periodo de observación de unos 46 meses, la mediana de la SG en el brazo de crizotinib aún no se había alcanzado y era de 47,5 meses con quimioterapia (HR 0,76; p=0,0978). Aunque el crizotinib fue numéricamente superior, no hubo diferencias estadísticamente significativas en la SG entre los brazos de tratamiento, muy probablemente debido a efectos cruzados o a terapias de seguimiento muy eficaces tras la progresión [14].
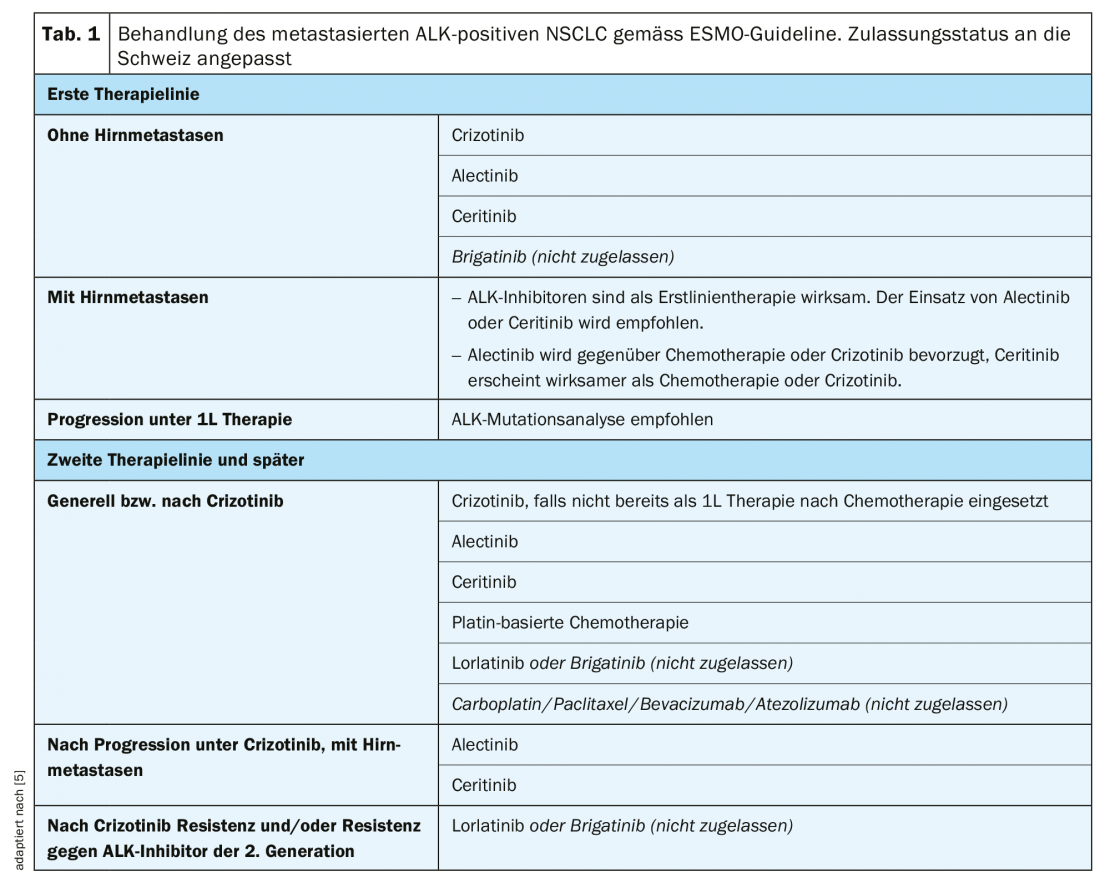
Como otra opción en la terapia de primera línea, el ceritinib mostró una mejora significativa de la mediana de la SLP (16,6 frente a 8,1 meses, HR 0,55, p<0,00001) en comparación con la quimioterapia basada en platino (cisplatino o carboplatino más pemetrexed seguido de terapia de mantenimiento con pemetrexed) en el ensayo ASCEND-4 [15]. La mediana de la SG aún no se había alcanzado con ceritinib y fue de 26,2 meses con quimioterapia (HR 0,73, p=0,056) [15].
El ensayo ALEX comparó el inhibidor ALK de 2ª generación alectinib con crizotinib en pacientes no tratados previamente [16]. El alectinib mostró una mediana de SLP significativamente mejorada en comparación con el crizotinib (no alcanzada frente a 11,1 meses, HR 0,47, p<0,001) [16]. También se obtuvo un resultado similar en el ensayo japonés J-ALEX (alectinib, no alcanzado frente a crizotinib, 10,2 meses, HR 0,34, p>0,001) [17]. El alectinib fue mejor tolerado en ambos ensayos, con menos interrupciones, reducciones de dosis o discontinuaciones que el crizotinib [16,17].
Desarrollo de mutaciones de resistencia
Prácticamente todos los pacientes con CPNM ALK-positivo experimentan una progresión en el plazo de uno a dos años tras la terapia de primera línea con un inhibidor de ALK debido a una resistencia primaria o adquirida [5,18]. En este contexto, la resistencia puede deberse a cambios específicos de ALK (on-target), como mutaciones de ALK o amplificaciones del gen ALK, o a otros mecanismos (off-target), como la activación de vías de señalización alternativas [18].
Alrededor del 20% de los pacientes en tratamiento con crizotinib y más de la mitad con un inhibidor de ALK de 2ª generación (alectinib, ceritinib) desarrollan mutaciones de resistencia [18]. El espectro de resistencia tras la progresión con crizotinib difiere significativamente del de los inhibidores de ALK de 2ª generación [18] . Por ejemplo, la mutación ALK p.G1202R sólo puede detectarse en el 2% de las biopsias resistentes al crizotinib, pero se presenta como la mutación de resistencia más común entre los inhibidores ALK de 2ª generación, confiriendo así resistencia tumoral a todos los inhibidores ALK de 2ª generación [18]. Cada inhibidor de ALK también parece estar asociado a un espectro específico de mutaciones de resistencia [18]. Los inhibidores de ALK de 3ª generación (lorlatinib y brigatinib) cubren un campo más amplio de mutaciones de resistencia a ALK (incluida ALK p.G1202R) que los inhibidores de ALK más antiguos [18].
Terapia de segunda línea
La elección de la terapia a partir de la segunda línea está muy influida por las mutaciones de resistencia presentes. Por tanto, debe utilizarse un análisis de mutaciones en el ADN tumoral circulante libre (ADNtc; la llamada biopsia líquida) o en una nueva biopsia de tejido para determinar el mecanismo de resistencia en caso de progresión bajo un inhibidor de ALK de 1ª o 2ª generación [19]. Este procedimiento también se sugiere en las directrices de la ESMO como parte del proceso de toma de decisiones para elegir la siguiente línea de terapia [5].
En comparación con la quimioterapia, el crizotinib mejoró significativamente la mediana de la SLP (7,7 frente a 3,0 meses, HR 0,49, p<0,001) y la ORR (65% frente a 20%) en el ensayo PROFILE-1007 en pacientes naïve al inhibidor ALK pero pretratados con un régimen basado en platino [20]. El crizotinib se recomienda como siguiente línea de tratamiento si no se ha utilizado antes [5].
En pacientes pretratados con quimioterapia y crizotinib, se observó una mejora significativa de la mediana de la SLP de 3,8 meses con ceritinib en comparación con la quimioterapia en el ensayo ASCEND-5 (5,4 frente a 1,6 meses, HR 0,49, p<0,0001) [21]. El alectinib también logró una mediana de SLP significativamente prolongada de 9,6 meses en comparación con 1,4 meses con quimioterapia en el ensayo ALUR en pacientes tras quimioterapia y pretratamiento con crizotinib (HR 0,15, p<0,001) [22]. Basándose en estos datos, se recomienda ceritinib o alectinib como terapia de segunda línea tras la progresión o intolerancia con crizotinib [5].
Terapia en líneas posteriores
En las últimas líneas de terapia, la elección de los inhibidores de ALK disponibles suele estar limitada debido a las mutaciones de resistencia existentes. En un estudio de fase II, se probó el inhibidor de ALK de 3ª generación lorlatinib en pacientes que habían sido tratados previamente con dos o tres inhibidores de ALK (lorlatinib de 1ª generación). o de 2ª generación , crizotinib, alectinib, ceritinib) con o sin quimioterapia lograron una ORR del 38,7% y una mediana de SLP de 6,9 meses [23]. En un análisis adicional, se investigó la eficacia del lorlatinib en el contexto de diferentes mutaciones de resistencia ALK. Tras el fracaso del tratamiento con crizotinib, el lorlatinib demostró ser muy eficaz en pacientes con y sin mutaciones de resistencia ALK [24]. Por el contrario, en pacientes que habían recibido previamente al menos un inhibidor de ALK, se observó una eficacia significativamente mayor del lorlatinib en presencia de mutaciones de resistencia de ALK que en ausencia de mutaciones de resistencia de ALK [24]. Por lo tanto, las mutaciones de resistencia ALK podrían utilizarse como biomarcador de respuesta al tratamiento con lorlatinib tras el fracaso con un inhibidor ALK de 2ª generación [24] . Tras el desarrollo de resistencia al crizotinib o a los inhibidores de ALK de 2ª generación, la terapia secuencial con lorlatinib* o brigatinib** es el enfoque preferido según las directrices de la ESMO [5].
Pacientes con metástasis cerebrales
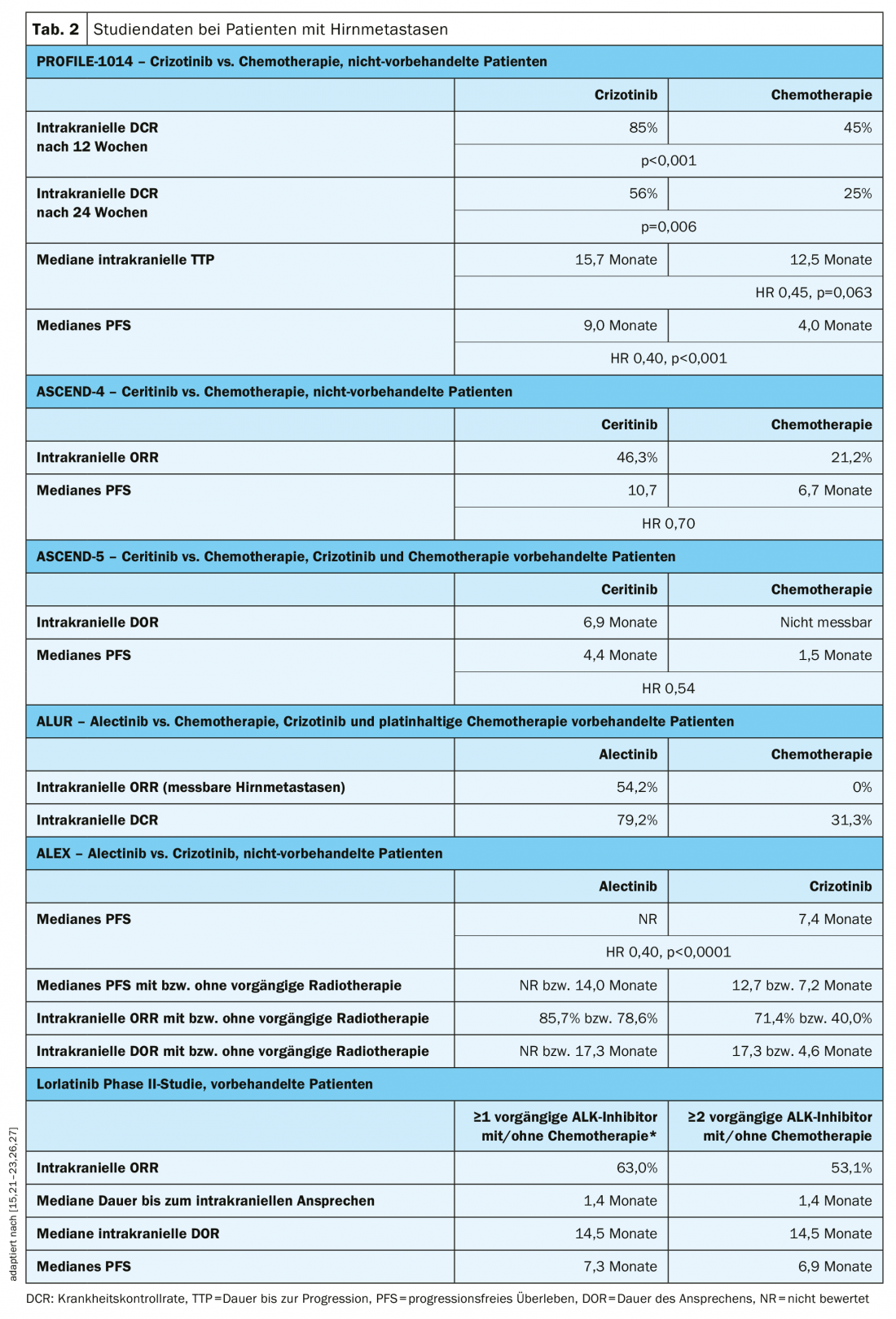
A más del 20% de los pacientes con CPNM ALK-positivo se les diagnostican metástasis cerebrales en el momento del diagnóstico inicial y la incidencia aumenta a más del 50% a medida que progresa la enfermedad [25]. Un reto en el tratamiento de las metástasis cerebrales es superar la barrera hematoencefálica. Los inhibidores de ALK de la 2ª y 3ª generación mostraron propiedades significativamente mejores a este respecto en comparación con el crizotinib [5,6].
Todos los ensayos de inhibidores de ALK incluyeron pacientes con metástasis cerebrales. Un análisis prospectivo de datos de pacientes con metástasis cerebrales en el ensayo PROFILE-1014 demostró que el crizotinib mejoraba significativamente las tasas de control de la enfermedad intracraneal en comparación con la quimioterapia (Tabla 2) [26]. La duración hasta la progresión tumoral intracraneal se prolongó con crizotinib, pero la diferencia con el brazo de quimioterapia no fue estadísticamente significativa (Tab. 2) [26]. El ceritinib mejoró la respuesta intracraneal y la mediana de la SLP en pacientes con metástasis cerebrales existentes en comparación con la quimioterapia basada en platino en el contexto de primera línea (ensayo ASCEND-4) o tras un tratamiento previo con crizotinib y quimioterapia (ensayo ASCEND-5) (Tabla 2) [15,21]. En el estudio ALUR, los pacientes con metástasis cerebrales mensurables tras la preterapia con crizotinib lograron una ORR intracraneal significativamente mayor con alectinib en comparación con la quimioterapia (tab. 2) [22]. También como terapia de primera línea, el alectinib condujo a una mejora significativa de la mediana de la SLP en pacientes con metástasis cerebrales en comparación con el crizotinib en el ensayo ALEX, independientemente de si ya se había administrado radioterapia (tab. 2) [27]. En el estudio pivotal de fase II, se observó una ORR intracraneal de 53,1 meses y una mediana de SLP de 6,9 meses con lorlatinib en pacientes con metástasis cerebrales tras un tratamiento previo con al menos dos inhibidores de ALK (tab. 2) [23].
Perfiles de seguridad de los inhibidores de ALK
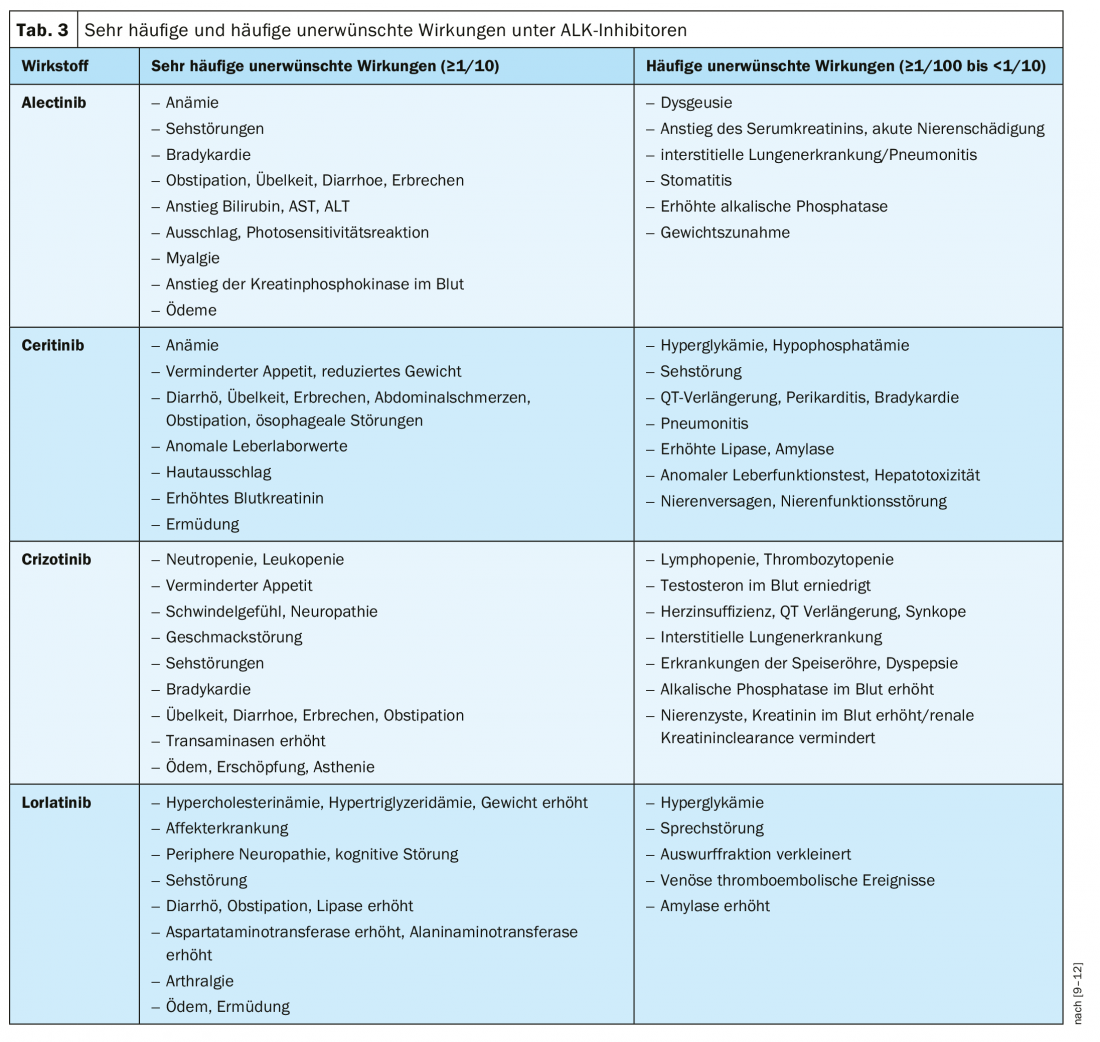
Aunque, en general, todos los inhibidores de ALK pueden clasificarse como seguros, el perfil de seguridad de los agentes disponibles también desempeña un papel importante en la elección de la terapia, sobre todo si se encuentra en el ámbito paliativo, como en el CPNM ALK-positivo avanzado [28]. La tabla 3 resume los aspectos de seguridad más importantes de los inhibidores de ALK aprobados en Suiza según la información especializada.
Secuencia de los inhibidores de ALK
Con la multitud de inhibidores de ALK disponibles, determinar una secuencia terapéutica óptima sigue siendo un reto [29]. Cada inhibidor de ALK tiene características únicas, que incluyen la penetración en el sistema nervioso central, el perfil de seguridad y el espectro de actividad en diferentes mutaciones de resistencia [29].
Además del estado de aprobación de los distintos inhibidores de ALK, los perfiles de toxicidad y los factores individuales de cada paciente también influyen en la elección del tratamiento de primera línea [7]. Dado que el crizotinib fue el primer inhibidor de ALK disponible, la mayoría de los datos están disponibles para secuencias que comienzan con crizotinib [29]. Según los ensayos clínicos disponibles, cabe esperar que el crizotinib seguido de alectinib o ceritinib tenga una mediana de SLP de 5,4 a 15,6 meses, una mediana de SG de 14,9 a 26,0 meses y una ORR de 33,0% a 80,0% [29]. Aún no se dispone de estudios que comparen directamente diferentes secuencias de inhibidores de ALK [29].
El CPNM ROS1-positivo
ROS1 codifica un receptor tirosina quinasa muy similar a ALK [30]. Por ello, algunos de los inhibidores de ALK disponibles muestran una alta afinidad por ROS1 y, en consecuencia, actividad antitumoral en pacientes con CPNM ROS1-positivo [31].
El crizotinib fue el primer inhibidor de ALK aprobado también para el tratamiento del CPNM ROS1-positivo y su eficacia en este entorno ha quedado demostrada en varios estudios prospectivos y retrospectivos [30,32–39]. En el estudio de fase I PROFILE-1001, se observó una ORR del 72% con crizotinib, con un 11% de pacientes que mostraron una respuesta completa y un 60% que mostraron una respuesta parcial [38]. La mediana de la SLP fue de 19,3 meses y la de la SG de 51,4 meses [38]. El perfil de seguridad del crizotinib fue comparable al de los pacientes con CPNM ALK-positivo [38]. El crizotinib también mostró una actividad antitumoral significativa en el ensayo METROS de fase II. La mediana de la SLP fue de 22,8 meses con una ORR del 65% [32]. En las directrices de la ESMO, se recomienda la monoterapia con crizotinib como terapia de primera o segunda línea para pacientes con CPNM estadio IV ROS1-positivo [5]. Tras la terapia de primera línea con crizotinib, puede ofrecerse quimioterapia basada en platino en segunda línea [5].
Debate y perspectivas de futuro
Las opciones de tratamiento para el CPNM ALK-positivo avanzado se amplían constantemente. Los inhibidores de ALK del Los fármacos de 2ª generación se han establecido en el entorno resistente al crizotinib y se utilizan cada vez más en la primera línea de tratamiento en pacientes con enfermedad avanzada [5]. Con lorlatinib como inhibidor de ALK del La 3ª generación es ahora otra opción disponible para los pacientes tras el fracaso del tratamiento con dos inhibidores de ALK [24]. Además, hay más inhibidores de ALK en desarrollo clínico o a punto de ser aprobados.
El brigatinib aún no está aprobado en Suiza, pero se menciona en las directrices de la ESMO como una opción en la primera línea de tratamiento. En el estudio ALTA-1L, se observó una mayor tasa de SLP con brigatinib en primera línea de tratamiento (HR 0,49, p<0,001) que con crizotinib [40]. Los pacientes resistentes al crizotinib también mostraron una ORR del 45% y del 54% y una mediana de SLP de 9,2 y 12,9 meses, respectivamente, en el ensayo ALTA de brigatinib (90 mg o 180 mg al día) [41]. La ORR intracraneal fue del 42% y del 67% y la mediana de la SLP intracraneal fue de 15,6 y 12,8 meses, respectivamente [41].
In vitro, el inhibidor ALK ensartinib inhibió el crecimiento de las células NSCLC ALK-positivas 10 veces más que el crizotinib [42]. Además, en un primer estudio de determinación de dosis, los pacientes tratados con una dosis ≥200 mg mostraron una tasa de respuesta (TR) del 60% y una mediana de SLP de 9,2 meses. En pacientes no tratados previamente con inhibidores ALK, se observó un RR del 80% y una mediana de SLP de 26,2 meses [42]. Desde 2016, se ha investigado la eficacia y la seguridad del ensartinib en comparación con el crizotinib en el ensayo abierto de fase III eXalt3 (NCT02767804) en pacientes con CPNM ALK positivo naïve a inhibidores de ALK [43].
Además de las diversas monoterapias con inhibidores de ALK, también se están debatiendo opciones de combinación con inhibidores de puntos de control inmunitarios como opciones de tratamiento para el CPNM ALK-positivo. Los datos iniciales de fase 1b del ensayo JAVELIN-101 mostraron una prometedora actividad antitumoral (ORR del 46,6%) y un perfil de seguridad aceptable con el anticuerpo monoclonal IgG1 anti-PD-L1 avelumab en combinación con lorlatinib [44]. La combinación de alectinib con el anticuerpo anti-PD-L1 atezolizumab también obtuvo los primeros resultados positivos en un estudio de fase 1b con toxicidad tolerable en pacientes no tratados previamente (mediana de seguimiento de 13 meses, ORR del 81%, mediana de SLP de 21,7 meses). Sin embargo, en el momento del análisis, sólo 6 de los 21 pacientes eran progresivos [45].
Actualmente también se están investigando otros inhibidores de ALK/ROS1 en ensayos clínicos para el CPNM ROS1-positivo. En un estudio de fase I/II, se alcanzó una ORR del 41% (IC del 95%: 29-53) con lorlatinib en pacientes ROS1-positivos, no tratados con TKI o tratados previamente (n=69) con o sin metástasis en el SNC [46]. Se observó una respuesta objetiva en el 62% de los pacientes sin TKI (10% respuesta completa, 52% respuesta parcial), en el 45% de los pacientes con metástasis en el SNC y en el 80% del grupo sin metástasis en el SNC. La mediana del tiempo hasta la primera respuesta tumoral (TTR) fue de 1,4 meses y la mediana de la duración de la respuesta (DOR) fue de 25,3 meses (IC 95%: 7,5-31,9) [46]. El ensayo pivotal de fase II de lorlatinib incluyó una cohorte ROS1-positiva (EXP-6) además de pacientes ALK-positivos (EXP1-5) [23,47]. Con lorlatinib, se observó una respuesta rápida y sostenida en este grupo de pacientes, independientemente de la terapia previa con crizotinib [47]. La ORR global y la mediana de la SLP fueron del 36,2% y 9,9 meses, respectivamente, en los pacientes no tratados con crizotinib del 61,5% y 21,0 meses, y tras la preterapia con crizotinib del 26,5% y 8,5 meses, respectivamente [47]. El lorlatinib sólo está aprobado en Suiza para el tratamiento del CPNM ALK-positivo [9].
Otro compuesto que se está evaluando es el potente inhibidor de ROS1 entrectinib como opción de tratamiento en el CPNM avanzado ROS1-positivo. El análisis integrado de tres ensayos de fase I/II (ALKA-372-001, STARTRK-1, STARTRK-2) mostró una ORR del 77% y una mediana de SLP de 26 y 14 meses en pacientes sin y con metástasis cerebrales, respectivamente [48]. El entrectinib mostró una buena tolerabilidad y un perfil de seguridad manejable [48].
En general, la situación del tratamiento de los pacientes con CPNM ALK-positivo o ROS1-positivo ha mejorado mucho en los últimos años. Sin embargo, son necesarios más estudios, por ejemplo para responder a las preguntas sobre la secuencia óptima de los inhibidores de ALK. Con las aprobaciones previstas de otras sustancias, las opciones terapéuticas también se ampliarán en el futuro.
Mensajes para llevarse a casa
- En Suiza, los inhibidores de ALK crizotinib (1ª generación), alectinib y ceritinib (2ª generación) y lorlatinib (3ª generación) están aprobados para el tratamiento del CPNM avanzado ALK-positivo.
- Se recomienda el uso de crizotinib, alectinib o ceritinib como terapia de primera línea para el CPNM ALK-positivo. El alectinib o el ceritinib son preferibles para las metástasis cerebrales existentes.
- Aproximadamente el 20% de los pacientes en tratamiento con crizotinib y más del 50% con alectinib o ceritinib desarrollan mutaciones de resistencia. El espectro de resistencia de los inhibidores de ALK varía.
- Tras el desarrollo de resistencia bajo crizotinib, se recomienda alectinib o ceritinib como siguiente línea de terapia.
- El lorlatinib cubre un campo más amplio de mutaciones de resistencia que los inhibidores de ALK del 1. y 2ª generación y, por tanto, se utiliza tras la progresión bajo alectinib o ceritinib.
- El crizotinib se recomienda como terapia de primera o segunda línea para el CPNM ROS1-positivo.
* El lorlatinib está aprobado en Suiza tras la progresión con al menos dos inhibidores de ALK.
** El brigatinib no está aprobado en Suiza.
Literatura:
- Krebsliga Schweiz – El cáncer en Suiza: cifras importantes. A partir de diciembre de 2018.
- Carcinoma pulmonar de células no pequeñas. Mi genoma del cáncer www.mycancer genome.org/content/disease/non-small-cell-lung-carcinoma. Último acceso: 15.10.2019.
- Shaw AT, et al: Características clínicas y resultados de los pacientes con cáncer de pulmón no microcítico portadores de EML4-ALK. Revista de oncología clínica: revista oficial de la Sociedad Americana de Oncología Clínica, 2009. 27(26): 4247-4253.
- Davare MA, et al: Structural insight into selectivity and resistance profiles of ROS1 tyrosine kinase inhibitors. Actas de la Academia Nacional de Ciencias de los Estados Unidos de América, 2015. 112(39): E5381-E5390.
- Planchard D, et al: Cáncer de pulmón metastásico de células no pequeñas: Guía de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimiento. Ann Oncol, 2019. 30(5): 863-870.
- Griesinger F, et al.: Metástasis cerebrales en el CPNM ALK-positivo: es hora de ajustar los algoritmos de tratamiento actuales. Oncotarget, 2018. 9(80): 35181-35194.
- Ziogas DC, et al: Tratamiento del cáncer de pulmón de células no pequeñas ALK-positivo. Anales de medicina traslacional, 2018. 6(8): 141-141.
- Lista de medicamentos autorizados para uso humano. www.swissmedic.ch/swissmedic/de/home/services/listen_neu.html#-257211596. Visitado el 02.03.2020.
- Información técnica actual Lorviqua® (lorlatinib). Estado de la información: enero de 2020. www.swissmedicinfo.ch.
- Resumen actual de las características del producto Xalkori® (crizotinib). Estado de la información: octubre de 2018. www.swissmedicinfo.ch.
- Información técnica actual Alecensa® (alectinib). Estado de la información: abril de 2018. www.swissmedicinfo.ch.
- Información técnica actual Zykadia® (ceritinib). Estado de la información: mayo de 2019. www.swissmedicinfo.ch.
- Solomon, BJ, et al: Crizotinib de primera línea frente a quimioterapia en cáncer de pulmón ALK-positivo. New England Journal of Medicine, 2014. 371(23): 2167-2177.
- Solomon BJ, et al: Análisis final de supervivencia global de un estudio que compara crizotinib en primera línea frente a quimioterapia en cáncer de pulmón no microcítico con mutación ALK positiva. J Clin Oncol, 2018. 36(22): 2251-2258.
- Soria JC, et al: Ceritinib de primera línea frente a quimioterapia basada en platino en cáncer de pulmón no microcítico avanzado con ALK reordenado (ASCEND-4): un estudio aleatorizado, abierto, de fase 3. Lancet, 2017. 389(10072): 917-929.
- Peters S, et al: Alectinib frente a crizotinib en el cáncer de pulmón no microcítico ALK-positivo no tratado. New England Journal of Medicine, 2017. 377(9): 829-838.
- Hida T, et al: Alectinib frente a crizotinib en pacientes con cáncer de pulmón no microcítico ALK-positivo (J-ALEX): un ensayo de fase 3 abierto y aleatorizado. Lancet, 2017. 390(10089): 29-39.
- Gainor JF, et al: Mecanismos moleculares de la resistencia a los inhibidores ALK de primera y segunda generación en el cáncer de pulmón con reordenamiento ALK. Cancer discovery, 2016. 6(10): 1118-1133.
- McCusker MG, et al: Cómo trato el cáncer de pulmón de células no pequeñas ALK-positivo. ESMO Open, 2019. 4(Suppl 2): e000524.
- Shaw AT, et al: Crizotinib frente a quimioterapia en cáncer de pulmón avanzado ALK-positivo. N Engl J Med, 2013. 368(25): 2385-2394.
- Shaw, A.T., et al: Ceritinib frente a quimioterapia en pacientes con cáncer de pulmón no microcítico con ALK previamente tratados con quimioterapia y crizotinib (ASCEND-5): un ensayo aleatorizado, controlado, abierto, de fase 3. Lancet Oncol, 2017. 18(7): 874-886.
- Novello S, et al: Alectinib frente a quimioterapia en el cáncer de pulmón no microcítico positivo a la quinasa del linfoma anaplásico (ALK) tratado con crizotinib: resultados del estudio de fase III ALUR. Anales de oncología : revista oficial de la Sociedad Europea de Oncología Médica, 2018. 29(6): 1409-1416.
- Solomon BJ, et al: Lorlatinib en pacientes con cáncer de pulmón no microcítico ALK-positivo: resultados de un estudio global de fase 2. Lancet Oncol, 2018.
- Shaw AT, et al: Mutaciones de resistencia ALK y eficacia del lorlatinib en el cáncer de pulmón no microcítico anaplásico quinasa-positivo avanzado. Revista de Oncología Clínica, 2019. 37(16): 1370-1379.
- Rangachari D, et al.: Metástasis cerebrales en pacientes con cánceres de pulmón no microcíticos con mutación EGFR o ALK. Cáncer de pulmón (Ámsterdam, Países Bajos), 2015. 88(1): 108-111.
- Solomon BJ, et al: Eficacia intracraneal del crizotinib frente a la quimioterapia en pacientes con cáncer de pulmón no microcítico avanzado ALK positivo: resultados del estudio PROFILE 1014. J Clin Oncol, 2016. 34(24): 2858-2865.
- Gadgeel S, et al: Alectinib frente a crizotinib en el cáncer de pulmón no microcítico anaplásico linfoma quinasa-positivo (ALK+) sin tratamiento: resultados de eficacia en el SNC del estudio ALEX. Anales de oncología: revista oficial de la Sociedad Europea de Oncología Médica, 2018. 29(11): 2214-2222.
- Zhu Q, et al: Análisis agrupados de seguridad del inhibidor ALK-TKI en el CPNM ALK-positivo. BMC cáncer, 2017. 17(1): 412-412.
- Barrows SM, et al: Revisión sistemática de la secuenciación de los inhibidores de ALK en el cáncer de pulmón no microcítico ALK-positivo. Cáncer de pulmón (Auckland, N.Z.), 2019. 10: 11-20.
- Michels S, et al: Seguridad y eficacia del crizotinib en pacientes con cáncer de pulmón avanzado o metastásico reordenado ROS1 (EUCROSS): Un ensayo clínico europeo de fase II. Revista de Oncología Torácica, 2019. 14(7): 1266-1276.
- Sehgal K, et al: Targeting ROS1 rearrangements in non-small cell lung cancer with crizotinib and other kinase inhibitors. Investigación traslacional del cáncer, 2018. 7(Suppl 7): S779-S786.
- Landi L, et al: Crizotinib in MET deregulated or ROS1 rearranged pretreated non-small-cell lung cancer (METROS): a phase II, prospective, multicentre, two-arm trial. Investigación clínica del cáncer, 2019.
- Liu C, et al: Crizotinib in Chinese Patients with ROS1-Rearranged Advanced Non-Small-Cell Lung Cancer in Routine Clinical Practice. Oncología dirigida, 2019: 1-9.
- Masuda K, et al: Eficacia y seguridad del crizotinib en pacientes con cáncer de pulmón no microcítico reordenado ROS1: un análisis retrospectivo. Revista de enfermedades torácicas, 2019. 11(7): 2965.
- Mazières J, et al: Terapia con crizotinib para el adenocarcinoma de pulmón avanzado y un reordenamiento ROS1: resultados de la cohorte EUROS1. Revista de oncología clínica, 2015. 33(9): 992-999.
- Moro-Sibilot D, et al: Crizotinib en CPNM c-MET- o ROS1-positivo: resultados del ensayo de fase II AcSé. Anales de Oncología, 2019.
- Park S, et al: Características y resultados de los pacientes con cáncer de pulmón de células no pequeñas ROS1-positivo en la práctica clínica habitual. Revista de Oncología Torácica, 2018. 13(9): 1373-1382.
- Shaw A, et al: Crizotinib in ROS1-rearranged advanced non-small-cell lung cancer (NSCLC): updated results, including overall survival, from PROFILE 1001. Annals of Oncology, 2019. 30(7): 1121-1126.
- Wu YL., et al: Estudio de fase II de crizotinib en pacientes de Asia oriental con cáncer de pulmón no microcítico avanzado ROS1-positivo. Revista de Oncología Clínica, 2018. 36(14): 1405-1411.
- Camidge DR, et al: Brigatinib frente a crizotinib en el cáncer de pulmón no microcítico ALK-positivo. New England Journal of Medicine, 2018. 379(21): 2027-2039.
- Kim DW, et al: Brigatinib en pacientes con cáncer de pulmón no microcítico positivo a la quinasa del linfoma anaplásico refractario al crizotinib: un ensayo de fase II aleatorizado y multicéntrico. J Clin Oncol, 2017. 35(22): 2490-2498.
- Horn L, et al: Ensartinib (X-396) en el cáncer de pulmón de células no pequeñas ALK-positivo: Resultados de un estudio multicéntrico de fase I/II, primero en humanos. Clinical cancer research: an official journal of the American Association for Cancer Research, 2018. 24(12): 2771-2779.
- Horn L, et al: eXalt3: Un estudio de fase III de ensartinib (X-396) en cáncer de pulmón no microcítico (CPNM) anaplásico linfoma quinasa (ALK) positivo. Revista de Oncología Clínica, 2017. 35(15_suppl): TPS8578-TPS8578.
- Shaw AT, et al: Avelumab (anti-PD-L1) en combinación con crizotinib o lorlatinib en pacientes con CPNM avanzado previamente tratado: resultados de fase 1b de JAVELIN Lung 101. Journal of Clinical Oncology, 2018. 36(15_suppl): 9008-9008.
- Kim DW, et al: Safety and clinical activity results from a phase Ib study of alectinib plus atezolizumab in ALK+ advanced NSCLC (aNSCLC). Revista de Oncología Clínica, 2018. 36(15_suppl): 9009-9009.
- Shaw AT, et al: Lorlatinib in advanced ROS1-positive non-small-cell lung cancer: a multicentre, open-label, single-arm, phase 1-2 trial. Lancet Oncol, 2019. 20(12): 1691-1701.
- Ou S, et al: OA02.03 Actividad clínica del lorlatinib en pacientes con cáncer de pulmón no microcítico avanzado ROS1: estudio de fase 2 cohorte EXP-6. Journal of Thoracic Oncology, 2018. 13(10): S322-S323.
- Barlesi F, et al: Entrectinib en el cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico con fusión ROS1 positiva: análisis integrado de ALKA-372-001, STARTRK-1 y STARTRK-2. Ann Oncol., 2019. 30(suppl_2):109O.
InFo ONCOLOGY & HEMATOLOGY 2020; 8(2): 14-20 (publicado el 23.4.20, antes de impresión).