La anemia aplásica se asocia a hipocelularidad de la médula ósea y pancitopenia. La adición de un agonista oral del receptor de la trombopoyetina a la terapia inmunosupresora estándar ha demostrado ser beneficiosa en pacientes con anemia aplásica grave o muy grave inmunomediada para los que el trasplante de médula ósea no es una opción.
En la anemia aplásica se produce una falta total de eritrocitos, leucocitos y trombocitos debido a una insuficiencia de la médula ósea. El resultado es una médula ósea de hipo a aplásica, ya que las células madre hematopoyéticas CD34 positivas son desplazadas por la médula grasa. Dependiendo de la causa, existen diferentes mecanismos fisiopatológicos subyacentes, explicó el Dr. Neal S. Young, del Instituto Nacional del Corazón, los Pulmones y la Sangre de los Institutos Nacionales de la Salud, Bethesda (EE UU), en la Reunión Anual de la Asociación Europea de Hematología (EHA) [1]. Los tres patomecanismos más importantes son
- Daños químicos o físicos, por ejemplo, por quimioterapia o radioterapia
- Defecto constitucional en genes importantes para el mantenimiento de la integridad celular y la regulación inmunológica.
- Daños inmunomediados en las células hematopoyéticas.
Esta última se da con mayor frecuencia y también se conoce como “anemia aplásica idiopática”. Se cree que es una reacción autoinmune causada por linfocitos T activados contra células madre y progenitoras hematopoyéticas. El hemograma muestra una anemia normocítica (VCM normal) con reticulocitopenia, trombocitopenia pronunciada y leucopenia con neutropenia. Hay pocos o ningún precursor en el aspirado de médula ósea y la biopsia de médula ósea se caracteriza por una celularidad muy reducida con proliferación de médula grasa. El cuadro clínico se caracteriza por anemia (palidez, fatiga), neutropenia (infección) y trombocitopenia (hemorragia) [2].
Las opciones de tratamiento de un vistazo
El trasplante de células madre hematopoyéticas es una opción terapéutica potencialmente curativa. Es el tratamiento de elección, sobre todo para los pacientes más jóvenes que disponen de un donante adecuado. Por este motivo, se analiza la compatibilidad de los hermanos con el antígeno leucocitario humano en cuanto se realiza el diagnóstico.
Para los pacientes que no son aptos para un trasplante o que no disponen de un donante, existe como alternativa el tratamiento inmunosupresor con globulina antitimocítica equina (ATG) en combinación con ciclosporina. Esta opción de tratamiento es eficaz en la mayoría de los pacientes, pero no en todos, según el Dr. Young [1]. Alrededor de dos tercios de los pacientes responden a ella [3]. Durante muchos años se han probado sin éxito diversos métodos para mejorar los resultados del tratamiento inmunosupresor estándar (TIS). Finalmente, se logró un gran avance cuando un estudio de fase I/II abierto y no aleatorizado demostró que la adición de Eltrombopag a la ATG más ciclosporina daba lugar a tasas de respuesta considerables en pacientes sin tratamiento con anemia aplásica grave o muy grave [4].
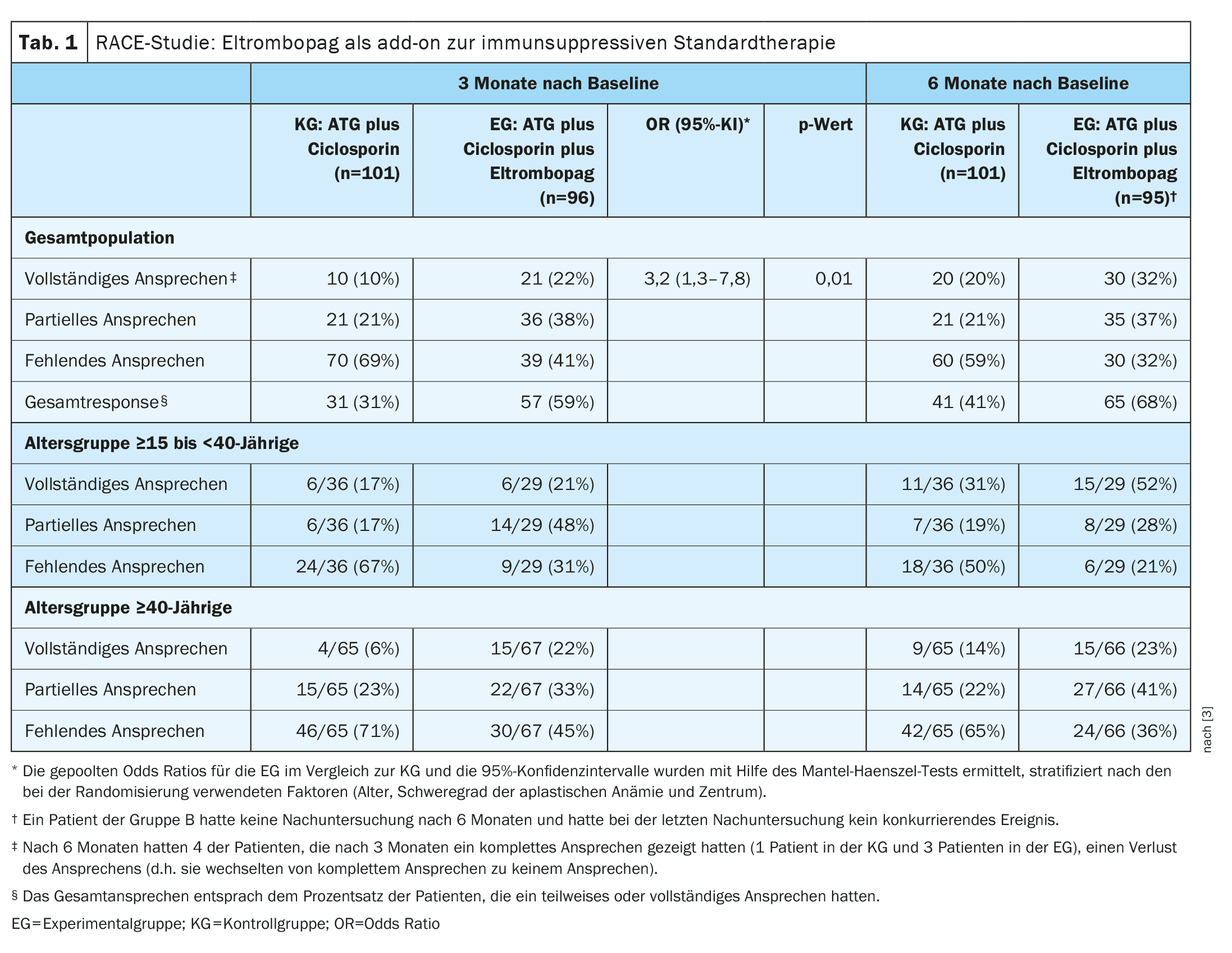
| El criterio de valoración primario del estudio fue una respuesta hematológica completa al cabo de tres meses, definida como un nivel de hemoglobina superior a 10 g por dl, un recuento absoluto de neutrófilos superior a 1.000 por mm3 y un recuento de plaquetas de 100.000 por mm3 en pacientes que no habían recibido transfusiones. Los criterios para una respuesta parcial eran la independencia de las transfusiones (tanto de glóbulos rojos como de plaquetas), con un grupo sanguíneo que no cumplía los criterios de la anemia aplásica grave pero que era insuficiente para una respuesta completa. |
Eltrombopag estimula la hematopoyesis a nivel de las células madre
Este agonista oral del receptor de la trombopoyetina tiene un efecto sobre el control de la formación de células madre hematopoyéticas y de plaquetas. El fármaco activa la trombopoyetina, que controla la formación de trombocitos y de sangre (hematopoyesis). En el estudio aleatorizado y controlado de fase III RACE (Randomized, Multicenter Trial Comparing Horse ATG plus Cyclosporine with or without Eltrombopag as First-Line), se comparó la TSI sola (ATG más Ciclosporina) con la TSI más Eltrombopag como terapia de primera línea en pacientes con anemia aplásica grave o muy grave [3]. Se observó que la mediana del tiempo transcurrido hasta la primera respuesta y hasta la respuesta completa era más corta en el brazo del estudio con TSI más eltrombopag (grupo experimental, EG) en comparación con el brazo del estudio en el que se prescribió TSI sola (grupo de control, KG). Estos tiempos de respuesta más cortos explican por qué el EG era antes independiente de las transfusiones de glóbulos rojos y plaquetas.
- Los pacientes del KG recibieron TSI consistente en ATG (40 mg por kg de peso vivo al día durante cuatro días consecutivos) más ciclosporina oral (5 mg por kg de peso vivo al día desde el primer día durante al menos 12 meses). La ciclosporina se redujo a lo largo de los 12 meses siguientes y se suspendió a los 24 meses.
- Los pacientes del GE recibieron la terapia experimental consistente en TSI más eltrombopag (150 mg diarios a partir del día 14). Las características demográficas y clínicas de los participantes en ambos grupos fueron comparables. La mediana del periodo de seguimiento fue de 24 meses.
- [OR]El porcentaje de pacientes que respondieron plenamente al tratamiento al cabo de tres meses fue del 10% en el GC y del 22% en el CE (odds ratio agrupada , 3,2; IC 95%: 1,3-7,8; p=0,01, Tab. 1).
- La tasa de respuesta global a los 3 meses fue inferior en el grupo de control (31%) que en el CE (59%) y la mediana del tiempo transcurrido hasta la primera respuesta fue de 8,8 meses en el grupo de control y de 3,0 meses en el CE. Después de 12 meses, la tasa de respuesta completa fue del 33% en el grupo de control y del 52% en la CE. La mediana del tiempo transcurrido hasta la primera respuesta fue de 3,0 meses en el grupo de eltrombopag y de 8,8 meses en el de CE.
La incidencia de efectos adversos graves fue comparable en ambos grupos; las interrupciones del tratamiento fueron poco frecuentes. Se detectaron mutaciones somáticas en el 31% en el GE y en el 29% en el KG antes del inicio del estudio. Estos porcentajes aumentaron al 55% en el GE y al 66% en el KG en el mes 6 después del inicio, sin efecto alguno en la respuesta hematológica ni en las tasas de supervivencia a 2 años (90% en el GE frente a 85% en el KG).
Los trasplantes de médula ósea haploidénticos también son prometedores para ampliar el acceso al trasplante de células madre hematopoyéticas, mencionó el ponente [1,5].
Congreso: EHA2024
Literatura:
- “Anemia aplásica inmunitaria: actualización sobre fisiopatología y nuevos tratamientos”, Dr. Neal S. Young, EHA2024, Madrid, 13.6.-16.6.2024.
- Lauten M, Erlacher M, Knöfler R: Hematología. Pediatría 2019: 541-570.
- Peffault de Latour R, et al: Eltrombopag añadido a la inmunosupresión en la anemia aplásica grave. N Engl J Med 2022; 386(1): 11-23.
- Townsley DM, et al: Eltrombopag añadido a la inmunosupresión estándar para la anemia aplásica. N Engl J Med 2017; 376: 1540-1550.
- DeZern A, et al: Alternative donor BMT with post-transplant cyclophosphamide as initial therapy for acquired severe aplastic anemia [publicado en línea antes de impresión, 2023 21 de abril]. Blood 2023; blood.2023020435. doi:10.182/blood.2023020435.
HAUSARZT PRAXIS 2024; 19(11): 34–35 (publicado el 25.11.24, antes de impresión)
InFo ONKOLOGIE & HÄMATOLOGIE 2024; 12(6): 26–27