Los enfoques terapéuticos modernos para las enfermedades inflamatorias intestinales crónicas (EII) se guían por el lema “tratar para conseguir el objetivo”, según el cual, además del alivio de los síntomas y la inducción de la remisión de la enfermedad, el objetivo actual es también preservar y hacer endoscópicamente discreta la mucosa del colon. Los nuevos agentes activos del campo de los biológicos y las moléculas pequeñas, que pueden utilizarse cuando hay una respuesta deficiente a los fármacos convencionales, son importantes fuentes de esperanza para optimizar los resultados de la terapia.
El panorama terapéutico ha cambiado rápidamente en los últimos años, con la llegada al mercado de varias sustancias nuevas muy eficaces de los grupos de fármacos biológicos y de moléculas pequeñas, sobre todo para las formas moderadas y graves de la enfermedad. El cuadro 1 muestra los agentes farmacoterapéuticos aprobados actualmente en Suiza para el tratamiento de la colitis ulcerosa y la enfermedad de Crohn.

“Tratar al objetivo” es el lema
Los objetivos terapéuticos en el tratamiento de la EII son principalmente el alivio de los síntomas y la supresión de la inflamación en el tracto gastrointestinal. Hoy en día, el objetivo no es sólo curar la mucosa intestinal, sino lograr un control completo de la enfermedad con remisión histológica [1]. Aunque todavía no existe una terapia curativa, se dispone de varias opciones de tratamiento farmacológico que han demostrado su eficacia. En la primera fase de la terapia, la atención se centra en iniciar la remisión y, por tanto, el alivio de los síntomas. A menudo se utilizan para este fin fármacos inmunomoduladores con un rápido inicio de acción (por ejemplo, los corticosteroides). El siguiente paso es mantener la remisión el mayor tiempo posible. Debido a sus efectos secundarios, los esteroides no son adecuados para este fin; en su lugar, dependiendo de la gravedad y otras características de la enfermedad, se utilizan aminosalicilatos, azatioprina o productos biológicos. En la era de la medicina personalizada, cada vez se tienen más en cuenta las características individuales específicas de la enfermedad, como el riesgo de progresión y las complicaciones, así como los factores predictivos de la respuesta al tratamiento [2].
Para el tratamiento de la colitis ul cerosa leve (C. ulcerosa ), suelen utilizarse inicialmente preparados de ácido 5-aminosalicílico (5-ASA) (por ejemplo, mesalazina o sulfasalazina), posiblemente también corticosteroides [3]. En este caso, la atención se centra en la disminución de la inflamación. El 5-ASA también ha demostrado su eficacia como terapia de mantenimiento y profilaxis de las recaídas. Si se trata de una forma de C. ulcerosa caracterizada por recaídas frecuentes o si la actividad de la enfermedad es elevada, los inmunosupresores como la azatioprina o la 6-mercaptopurina pueden ser útiles [1]. En un episodio muy activo y agresivo de C. ulcerosa, puede considerarse el uso de esteroides intravenosos y, si esto no proporciona un alivio suficiente, puede recurrirse a la ciclosporina. Para las formas graves de progresión, el ustekinumab ha ampliado el espectro de terapias biológicas aprobadas en Suiza desde 2020 [14].
En la enfermedad de Crohn (M. Crohn), los corticosteroides suelen utilizarse en primer lugar si hay focos inflamatorios activos. En caso de inflamación leve, los preparados de 5-ASA también pueden ser eficaces (por ejemplo, la mesalazina o la sulfasalazina) [1]. En las formas más agresivas de la enfermedad de Crohn, debe considerarse el uso de inmunosupresores como la azatioprina, la 6-mercaptopurina o el metotrexato. Si no hay respuesta al tratamiento farmacológico convencional, se dispone de productos biológicos como adalimumab, certolizumab, infliximab, vedolizumab o ustekinumab.
Gran arsenal de productos biológicos altamente eficaces
Los avances en el campo de la investigación de procesos moleculares proporcionan la base para el desarrollo de dianas terapéuticas, lo que se refleja en nuevos productos biológicos altamente eficaces. Está implicada, entre otras cosas, una destrucción de las uniones estrechas y de la película mucosa que recubre la capa epitelial intestinal, lo que aumenta la permeabilidad del epitelio, dando lugar a una mayor captación de antígenos luminales en las capas más profundas de la pared intestinal [23]. La implicación de las células inmunitarias conduce a un aumento de la producción de citoquinas proinflamatorias, las dianas de los anticuerpos monoclonales.
La aprobación en el mercado de los productos biológicos ha mejorado significativamente las opciones terapéuticas para las formas moderadas y graves de la EII. Con el creciente número de sustancias activas disponibles, la elección de la terapia adecuada se está convirtiendo en un reto cada vez más complejo. Para una decisión terapéutica guiada por criterios, se puede recurrir a una amplia base de pruebas. Entre otras cosas, la gravedad de los síntomas y los focos inflamatorios en el intestino son criterios importantes para la estrategia de tratamiento. A continuación se presenta un resumen compacto de los resultados seleccionados sobre los anticuerpos monoclonales aprobados actualmente en Suiza para el tratamiento de la EII.

ANTI-TNF: La aprobación de los inhibidores del TNFα hace unos años supuso un gran avance en las opciones de tratamiento de la EII. La eficacia y seguridad del adalimumab para el tratamiento de inducción y mantenimiento en la C. ulcerosa activa de moderada a grave quedó demostrada en los ensayos ULTRA 1 y 2 [4]. El estudio ULTRA 3 demostró que la remisión, la cicatrización de la mucosa y la mejora de la calidad de vida se mantuvieron con el tratamiento con adalimumab durante un período de 4 años [4]. La eficacia del golimumab en presencia de colitis ulcerosa de moderada a grave a pesar del tratamiento con esteroides, 5-ASA o tiopurinas quedó demostrada en el programa de ensayos PURSUIT [5,6]. Según los análisis del estudio de extensión PURSUIT, el balance con respecto a los datos a largo plazo también es positivo [7]. En la C. ulcerosa con actividad fulminante de la enfermedad y mala respuesta a los esteroides intravenosos, las directrices S3 actualizadas en 2019 recomiendan, entre otras cosas, la terapia con infliximab (combinado con tiopurina si es posible) [8].
Además del adalimumab y el infliximab, los antagonistas del TNFα certolizumab han sido aprobados recientemente en Suiza para la enfermedad de Crohn. En general, los inhibidores del TNFα son una opción terapéutica importante para la C. ulcerosa y la enfermedad de Crohn. Sin embargo, la falta de respuesta, la disminución de la eficacia o la intolerancia al uso de anti-TNFα resultó ser un problema en algunos pacientes. Para estos grupos de pacientes, el anticuerpo anti-integrina vedolizumab es una alternativa [9].
ANTI-47 INTEGRINA: Las células T portadoras de la integrina-α4β7 se unen a las células endoteliales del colon mediante la MAdCAM-1 (molécula 1 de adhesión celular de la direccionalidad vascular de la mucosa. Esto da lugar a una invasión de células T específicas del intestino en la lámina propia, una capa de tejido conectivo situada bajo los epitelios [23]. El vedolizumab es un anticuerpo dirigido contra la integrina, aprobado en Suiza desde 2015 para la C. ulcerosa activa de moderada a grave y la enfermedad de Crohn en caso de respuesta insuficiente o intolerancia a la terapia convencional o al tratamiento con anti-TNFα [1]. El vedolizumab es selectivo para el intestino y se une a la α4β7-integrinade otras células sanguíneas, impidiendo que desencadenen una respuesta inflamatoria en el tejido intestinal. En un metaanálisis, las tasas de remisión sin corticosteroides en pacientes con colitis ulcerosa fueron del 26% en la semana 14 y del 42% al año [10]. En la enfermedad de Crohn, estas tasas fueron del 25% y del 31%. Los autores concluyen que estos datos respaldan el perfil beneficio-riesgo a largo plazo del vedolizumab [10].
El estudio VARSITY es la primera comparación directa de vedolizumab y adalimumab en pacientes con colitis ulcerosa activa de moderada a grave. El vedolizumab demostró ser superior en términos de remisión clínica. En la semana 52, el 31,3% en el brazo de vedolizumab y el 22,5% en el de adalimumab alcanzaron la remisión clínica (p=0,006) según la puntuación de Mayo. La cicatrización de la mucosa (criterio de valoración secundario) se observó en un 39,7% con vedolizumab y en un 27,7% con adalimumab (p<0,001) [11,12]. Además, en los pacientes sin tratamiento biológico, el infliximab y el vedolizumab mostraron los mejores resultados en términos de remisión clínica y cicatrización de la mucosa. El tratamiento con vedolizumab también dio lugar a la tasa más baja de acontecimientos adversos graves e infecciones, y el perfil de eficacia y seguridad fue en gran medida coherente con estudios anteriores.
El Panorama 2 muestra en qué casos es especialmente útil el uso de anti-integrina/vedolizumab.

ANTI-IL12/23: La vía IL12/IL23 ha surgido como un factor importante en la patogénesis de la EII en los estudios de asociación de todo el genoma [13].
Ustekinumab (Stelara®) fue aprobado en Suiza en 2020 para el tratamiento de la enfermedad de Crohn ulcerosa C. Esta opción terapéutica ya se comercializa desde 2017 [14]. El ustekinumab es un anticuerpo monoclonal que bloquea simultáneamente las citocinas proinflamatorias IL12 e IL23 al dirigirse a la subunidad p40 de este heterodímero. En el programa de ensayos clínicos de fase III UNITI-1 y UNITI-2, el usteki-numab demostró su eficacia tanto en la fase de inducción como para la terapia de mantenimiento en pacientes con enfermedad de Crohn en los que había fracasado el tratamiento convencional y la terapia anti-TNF [15]. Tras un periodo de 6 semanas, el ustekinumab mostró una respuesta clínica significativamente mayor (reducción de la puntuación del CDAI en al menos 100 puntos) que el placebo. Cada uno de los participantes en el estudio había recibido terapia de inducción con ustekinumab i.v. en 2 dosis (130 mg y 6 mg/kg) o placebo. Los que respondieron a la terapia en los ensayos de inducción UNITI se incluyeron en el ensayo de mantenimiento IM-UNITI de 44 semanas, en el que se les trató con 90 mg de ustekinumab s.c. cada 8 semanas, cada 12 semanas o placebo. Tras 44 semanas, el 48,8% de los pacientes del grupo que recibió ustekinumab 90 mg cada 12 semanas alcanzó la remisión clínica, y el 53,1% del grupo que recibió ustekinumab 90 mg cada 8 semanas. En la condición placebo, esta proporción fue del 35,9%.
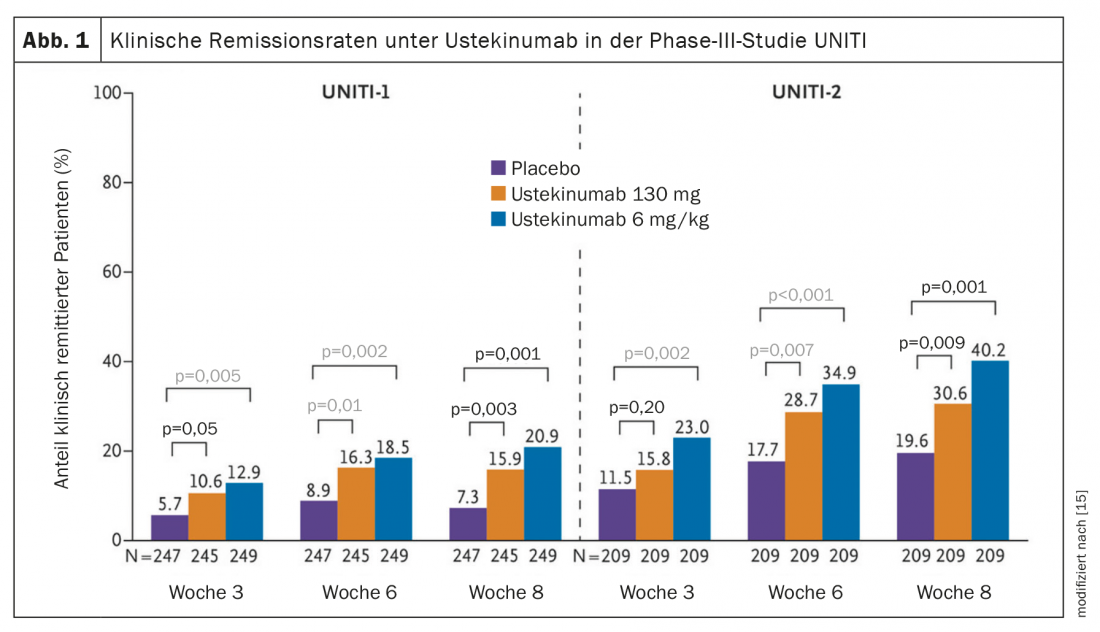
La eficacia en la C. ulcerosa ulcerosa quedó demostrada en el programa de ensayos UNIFI de fase III, multicéntrico, doble ciego y controlado con placebo (Fig. 1) [15,22]. En el estudio de inducción, los participantes en el estudio (n=961) recibieron una única administración i.v. de ustekinumab a una dosis de 130 mg o 6 mg/kg de peso vivo o placebo. En la semana 8, el 15,6% de los pacientes con 130 mg y el 15,5% con 6 mg/kg frente al 5,3% con placebo habían alcanzado la remisión clínica (Puntuación Mayo ≤2) [15,22]. Además, las tasas de respuesta* hasta la semana 8 fueron del 56,5% para ambas dosis. El 15,6% alcanzó la remisión clínica durante este periodo. Los pacientes que habían respondido a la terapia de inducción fueron incluidos en el estudio de mantenimiento de 44 semanas (n=523). Estos participantes en el estudio fueron asignados aleatoriamente a las condiciones ustekinumab 90 mg s.c. cada 8 semanas (q8w), cada 12 semanas (q12w) o placebo. La remisión clínica en la semana 44 (criterio de valoración primario) fue alcanzada por el 43,8% en el brazo q8w y el 38,4% en el brazo q12w, frente al 24% con placebo. En el 42% (q8w) y el 37,8% (q12w), respectivamente, se alcanzó incluso una remisión sin el uso de esteroides en la semana 44; en la condición placebo, esta proporción fue del 23,4%. Además, el nivel de calprotectina disminuyó significativamente bajo ustekinumab (la calprotectina es un marcador importante de la inflamación en el intestino) [16]. El perfil de seguridad de ustekinumab fue coherente con el de estudios anteriores.
* Reducción de ≥30% y ≥3 puntos en la puntuación Mayo con reducción de ≥1 punto en la subpuntuación de hemorragia rectal desde el inicio en la semana 0.
La tabla 3 muestra en qué casos es especialmente útil el uso de un inhibidor de la IL12/23.

Los inhibidores de JAK complementan el espectro terapéutico
Los inhibidores de la Janus quinasa (JAK), a diferencia de los biológicos, se producen sintéticamente. Se trata de sustancias de bajo peso molecular (“moléculas pequeñas”). En cuanto al mecanismo de acción, una diferencia esencial es que los inhibidores de JAK, a diferencia de los biológicos, no interceptan las señales de las citocinas en el espacio extracelular, sino intracelularmente. La inhibición de la vía JAK-STAT previene la respuesta proinflamatoria al bloquear simultáneamente múltiples citoquinas. El inicio de la acción es rápido en la mayoría de los casos y la forma de administración oral es un importante factor de comodidad.
El primer inhibidor de JAK aprobado en Suiza para la CED es el tofacitinib (Xeljanz®), que figura en la lista para el tratamiento de la C. ulcerosa desde 2019 [21]. En el programa de ensayos clínicos OCTAVE (“Oral Clinical Trials for Tofacitinib in ulcerative colitis global development program”), se demostró el rápido inicio de la eficacia del tofacitinib [18]. Después de sólo tres días, 10 mg de tofacitinib dos veces al día mostraron una reducción estadísticamente significativa mayor de la hemorragia rectal que el placebo (14,4% frente a 8,2%; p<0,05). Se observó una reducción significativa de la frecuencia de las deposiciones al cabo de siete días en una proporción significativamente mayor de pacientes que tomaban 10 mg de tofacitinib dos veces al día en comparación con placebo (9,2% frente a 2,3%; p<0,01).

En el estudio de fase III U-ACHIEVE, en el que se investigó la eficacia y seguridad del upadacitinib (Rinvoq®) en adultos con colitis ulcerosa de moderada a grave, el 26% de los pacientes del brazo de upadacitinib alcanzaron la remisión clínica al cabo de 8 semanas, frente al 5% del placebo (p<0,001). Además, un número significativamente mayor de pacientes en tratamiento con upadacitinib experimentó una mejoría endoscópica en la semana 8 en comparación con el placebo (36% frente a 7%; p<0,001). El perfil de seguridad de utacitinib 45 mg fue coherente con estudios anteriores, sin que se informara de nuevas señales de seguridad [19].
Mensajes para llevarse a casa
- Los enfoques terapéuticos modernos para las enfermedades inflamatorias intestinales crónicas (EII) se guían por el lema “tratar para conseguir el objetivo”, según el cual, además del alivio de los síntomas y la inducción de la remisión de la enfermedad, el objetivo actual es también preservar y hacer endoscópicamente discreta la mucosa del colon.
- Los fármacos antiinflamatorios convencionales utilizados habitualmente en la EII incluyen los aminosalicilatos (5-ASA), los esteroides, los inmunosupresores (por ejemplo, azatioprina, 6-mercaptopurina, metotrexato, tacrolimus, ciclosporina A).
- Si la respuesta es pobre, pueden utilizarse productos biológicos. Además de la terapia anti-47 integrina y de los representantes de los bloqueantes del TNFα, desde hace algunos años se dispone de un inhibidor de la IL-12/23 para el tratamiento de la enfermedad de Crohn en forma de ustekinumab, para el que se concedió una ampliación de indicación para la colitis ulcerosa en 2020 [14].
- El tofacitinib, del grupo de las “moléculas pequeñas”, está aprobado para el tratamiento de la colitis ulcerosa en Suiza [21].


Literatura:
- IBDnet: Red suiza de investigación y comunicación sobre la enfermedad inflamatoria intestinal, www.ibdnet.ch.
- Flamant M, Roblin X: Enfermedad inflamatoria intestinal: hacia una medicina personalizada. Avances terapéuticos en gastroenterología 2018, https://doi.org/10.1177/1756283X17745029
- Biedermann L: Estado de la técnica en el tratamiento de la EII. Una visión general sobre las opciones de tratamiento convencionales y avanzadas. PD Luc Biedermann, MD, presentación de diapositivas, Simposio de diciembre de 2020.
- Colombel J-F, et al: Tratamiento de mantenimiento de cuatro años con adalimumab en pacientes con colitis ulcerosa de moderada a gravemente activa: datos de ULTRA 1, 2 y 3. Am J Gastroenterol 2014; 109(11): 1771-1780.
- Sandborn WJ, et al: El golimumab subcutáneo induce la respuesta clínica y la remisión en pacientes con colitis ulcerosa moderada-grave. Gastroenterología 2014; 146: 85-95.
- Sandborn WJ, et al: El golimumab subcutáneo mantiene la respuesta clínica en pacientes con colitis ulcerosa de moderada a grave. Gastroenterología 2014; 146: 96-109 e1
- Reinisch W: Beneficio a largo plazo del golimumab para pacientes con colitis ulcerosa de moderada a gravemente activa: Resultados de la extensión de mantenimiento PURSUIT. J Crohns Colitis 2018. doi: 10.1093/ecco-jcc/jjy079. [Epub ahead of print].
- Kucharzik T, et al.: Directriz S3 actualizada sobre colitis ulcerosa. Agosto de 2019 – Número de registro AWMF: 021-009. www.awmf.org
- Scribano ML: Vedolizumab para la enfermedad inflamatoria intestinal: de los ensayos controlados aleatorizados a las pruebas en la vida real. World J Gastroenterol 2018; 24(23): 2457-2467.
- Schreiber S, et al.: Revisión sistemática con metaanálisis: eficacia en el mundo real y seguridad del vedolizumab en pacientes con enfermedad inflamatoria intestinal. J Gastroenterol 2018; 53 (9): 1048-1064.
- Kassenärztliche Bundesvereinigung (KBV): Biologika. Colitis ulcerosa. Edición 04/2020. www.akdae.de/Arzneimitteltherapie/WA/Archiv/Biologika.pdf
- Schreiber S, et al: J Crohns Colitis 2019; 13 (Suplemento 1): S612-613 (Resumen OP34).
- Jostins L, et al.: Las interacciones huésped-microbio han dado forma a la arquitectura genética de la enfermedad inflamatoria intestinal. Nature 2012; 491: 119-124.
- Información temática Stelara®: www.swissmedicinfo.ch, fecha de acceso 04.01.2021
- Feagan BG: Ustekinumab como terapia de inducción y mantenimiento para la enfermedad de Crohn. N Engl J Med 2016; 375: 1946-1960.
- Sands BE, et al.: Seguridad y eficacia del tratamiento de inducción con utekinumab en pacientes con colitis ulcerosa de moderada a grave: resultados del estudio de fase 3 UNIFI. Ponencia presentada en la Semana UEG 2018, Viena, Austria
- USZ: Clínica de Gastroenterología y Hepatología, www.gastroenterologie.usz.ch/fachwissen/morbus-crohn-colitits-ulcerosa, último acceso 04.01.2021
- Stiefelhagen P: Inhibición de JAK: un nuevo enfoque prometedor. Gastro-News 5, 62 (2018). https://doi.org/10.1007/s15036-018-0464-5
- “Upadacitinib (RINVOQ™) Meets Primary and All Ranked Secondary Endpoints in First Phase 3 Induction Study in Ulcerative Colitis”, AbbVie Inc, 9/12/2020.
- Stallmach A, et al.: Addendum a las directrices S3 Enfermedad de Crohn y colitis ulcerosa: Atención a pacientes con enfermedad inflamatoria intestinal en la pandemia COVID-19 – preguntas y respuestas abiertas. www.awmf.org, última consulta: 04.01.2021
- Compendio suizo de medicamentos: Xeljanz®, www.compendium.ch, último acceso 04.01.2021
- Ärzte Zeitung: Ustekinumab: Nueva opción para la colitis ulcerosa, Publicado en línea el 18.10.2019, www.aerztezeitung.de/Medizin/Neue-Option-bei-Colitis-ulcerosa-402582.html
- Roeb E: Colitis ulcerosa: terapia según las nuevas directrices. Pharmazeutische Zeitung, 14.02.2019 www.pharmazeutische-zeitung.de/therapie-nach-neuer-leitlinie
PRÁCTICA GP 2021; 16(1): 15-18