Los ensayos clínicos de intervención pueden dividirse en fase I, II y III. Hasta ahora, todo va bien. Pero, ¿qué significa eso exactamente? He aquí un breve repaso para todos aquellos que no participan directamente en la investigación clínica y cuyo tiempo de estudio se remonta un poco más atrás.
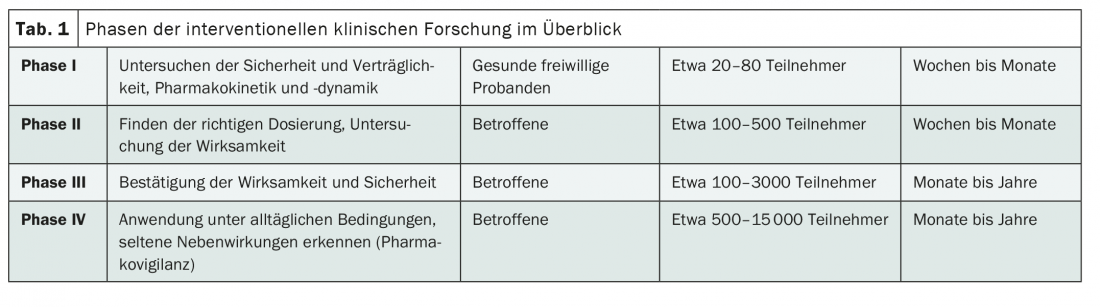
Cada estudio de intervención -es decir, cualquier estudio en el que los participantes reciben una forma activa de tratamiento- puede asignarse a una fase específica de desarrollo de la intervención que se está probando, por ejemplo el fármaco que se está probando (Tab.1). En particular, el objetivo es proteger a los participantes en el estudio de posibles efectos adversos y permitir que la intervención se caracterice con la mayor precisión posible en diferentes sujetos. Por cierto, esto no tiene nada que ver con la aleatorización, no todos los ensayos de fase III son automáticamente ensayos aleatorizados controlados.
Paso a paso del I al III
Clásicamente, las pruebas preclínicas de una intervención van seguidas -como su nombre indica- de un ensayo de fase I. La intervención o el fármaco se prueba en humanos por primera vez. Aquí nos centramos en las pruebas de compatibilidad [1]. Normalmente, en un estudio de fase I participan unas pocas docenas de voluntarios sanos. Se estudian en detalle la farmacocinética y la farmacodinámica a diferentes dosis. De este modo, se recogerán los primeros datos sobre los efectos secundarios en humanos y las dosis adecuadas [1].
Sólo en la segunda fase se centra la atención en la eficacia. Se trata de personas que padecen la enfermedad por primera vez, lo que hace indispensable la cooperación entre las empresas farmacéuticas y las organizaciones de investigación clínica con las clínicas. Normalmente se incluyen entre 100 y 500 pacientes, con o sin grupo de control, con o sin cegamiento [1].
En ensayos clínicos mucho más amplios, los ensayos de fase III, la intervención se prueba entonces idealmente en varios miles de pacientes. Se está probando si la eficacia y la tolerabilidad pueden reproducirse en una gran población de estudio. Los análisis de subgrupos también son importantes en este caso, ya que pueden proporcionar información sobre qué pacientes se benefician especialmente -y cuáles tienden a beneficiarse menos- de la intervención. Los ensayos de fase III suelen ser estudios comparativos con terapias existentes y/o placebo [1]. Éstas son también las más significativas. Cuanto más avanzado esté el desarrollo de una intervención y mayor sea el estudio, más importante será planificarla con suficiente antelación. Hay que determinar los criterios de valoración y la evaluación estadística debe ser lo más precisa posible. Esto se debe, por ejemplo, a que normalmente no es posible ponerse al día en la recogida de datos de más de 1.000 pacientes.
Dependiendo de la intervención y de la enfermedad, los ensayos de fase III pueden ser difíciles de realizar. Es el caso, entre otras, de las enfermedades muy raras. También hay casos en los que los estudios de fase III aleatorizados y controlados son difícilmente justificables desde el punto de vista ético, por ejemplo, si ya se aprecia una gran eficacia clínica en la 2ª fase . Debido a este problema, en repetidas ocasiones se aprueban fármacos antes de que finalicen los correspondientes ensayos de fase III, lo que actualmente es un tema candente en oncología. A menudo, la inclusión en un ensayo clínico es lo que da acceso a un medicamento (no aprobado) en primer lugar. Por un lado, esto puede salvar vidas, pero también es una lotería – y una razón para derivar a los pacientes correspondientes a centros especializados que participen en ensayos clínicos. En general, el camino desde el ensayo de fase I hasta la aprobación es largo y tiene una escasa probabilidad de éxito de poco menos del 10%. Y esto se reduce a la mitad, al 5,1%, en el desarrollo de medicamentos contra el cáncer. La mayoría de los ensayos se interrumpen en la fase II [2].
No hay que olvidarlo: Fase 0 y IV
Aunque el desarrollo clínico suele centrarse en la fase I-III, los ensayos de fase 0 y IV también desempeñan un papel importante en la innovación médica. Mientras que los ensayos de fase 0 implican la investigación de material humano, los de fase IV tienen lugar tras la aprobación del mercado. En consecuencia, éstas se limitan a las indicaciones, dosis y formas de administración aprobadas. Entre otras cosas, el tamaño de la población permite detectar efectos secundarios poco frecuentes [3].
Literatura:
- Fase clínica. www.interpharma.ch/themen/fuhrend-in-forschung-entwicklung/der-weg-eines-medikaments/klinische-phase-phase-i-ii-iii (última consulta: 21.11.2021).
- Thomas DW, et al.: Clinical Development Success Rates 2006-2015. www.bio.org/sites/default/files/legacy/bioorg/docs/Clinical%20Development%20Success%20Rates%202006-2015%20-%20BIO,%20Biomedtracker,%20Amplion%202016.pdf (letzter Zugriff am 21.11.2021).
- Fases del estudio. www.dimdi.de/dynamic/de/glossar/glossareintrag/Studienphasen (última consulta: 21.11.2021).
- ¿Qué tipos de ensayos clínicos existen? www.viomedo.de/posts/welche-arten-von-klinischen-studien-gibt-es (última consulta: 21.11.2021).
InFo ONCOLOGÍA Y HEMATOLOGÍA 2021; 9(6): 42











