La incidencia del carcinoma endometrial está aumentando. En las mujeres posmenopáusicas, suele hacerse notar pronto a través de las hemorragias vaginales. Más del 70% de los pacientes se encuentran en el estadio I de la FIGO en el momento del diagnóstico. El tratamiento quirúrgico consiste en una histerectomía, una anexectomía bilateral y, en función del perfil de riesgo, una linfonodectomía centinela y/o pélvica y paraaórtica. La terapia adyuvante depende de la estadificación y del riesgo de recidiva.
El carcinoma endometrial es el tumor ginecológico maligno más frecuente y la sexta enfermedad maligna más común en todo el mundo. La incidencia anual en Europa occidental está aumentando y actualmente es de 10-25:100.000 mujeres [1]. La enfermedad suele diagnosticarse en fases tempranas confinada al útero y en mujeres posmenopáusicas debido a hemorragias vaginales. En la premenopausia, la enfermedad puede manifestarse a través de cambios en la intensidad y la frecuencia de la menstruación.
¿Nueva clasificación biológica molecular?
El carcinoma endometrial se divide clásicamente en dos categorías: El tipo I, que es más frecuente (80%) y se origina a partir de una hiperplasia endometrial atípica, corresponde histológicamente a los adenocarcinomas endometriales. Los carcinomas de tipo II son más agresivos e incluyen carcinomas de células claras, carcinomas serosos y carcinosarcomas. Sin embargo, esta clasificación, basada únicamente en la histología, está siendo cuestionada en la actualidad. Actualmente se está debatiendo una nueva clasificación biológica molecular, que podría ser más relevante desde el punto de vista pronóstico y terapéutico. Hasta ahora, la edad media en el momento del diagnóstico se consideraba más elevada para los carcinomas de tipo II. Sin embargo, un estudio prospectivo de más de un millón de mujeres noruegas, que incluía 992 cánceres de tipo II, no mostró diferencias (edad media en ambos grupos: 65 años) [2].
El carcinoma endometrial de tipo I es estrógeno-dependiente. Además, el uso prolongado de estrógenos sin protección progestágena, el síndrome metabólico con obesidad, la menarquia precoz, la menopausia tardía, el tratamiento con tamoxifeno y los niveles elevados de estrógenos (por ejemplo, en el síndrome de ovario poliquístico) se consideran factores de riesgo de carcinomas de tipo I. También se incluyen la hipertensión arterial y la diabetes mellitus. Además, el cáncer de endometrio se produce en el 40-60% de las pacientes con síndrome de Lynch y en el 5-10% de las pacientes con síndrome de Cowden.
Por otro lado, los anticonceptivos hormonales reducen el riesgo de cáncer de endometrio en aproximadamente un 50%. Fumar también parece ser un factor de protección. Su efecto protector puede explicarse por la estimulación del metabolismo hepático de los estrógenos. Otros factores de protección son una edad elevada en el último parto y el consumo de café y té.
Estadificación y evaluación de riesgos
Desde 2009, está en vigor la versión actualizada de la estadificación según la FIGO [3] (Tab. 1) . La supervivencia a 5 años para el estadio IA es de ~90%, para el estadio IB de 78% y disminuye a 57% para el estadio IIIC1 resp. al 49% en caso de afectación de los ganglios linfáticos paraaórticos (IIIC2) [4].
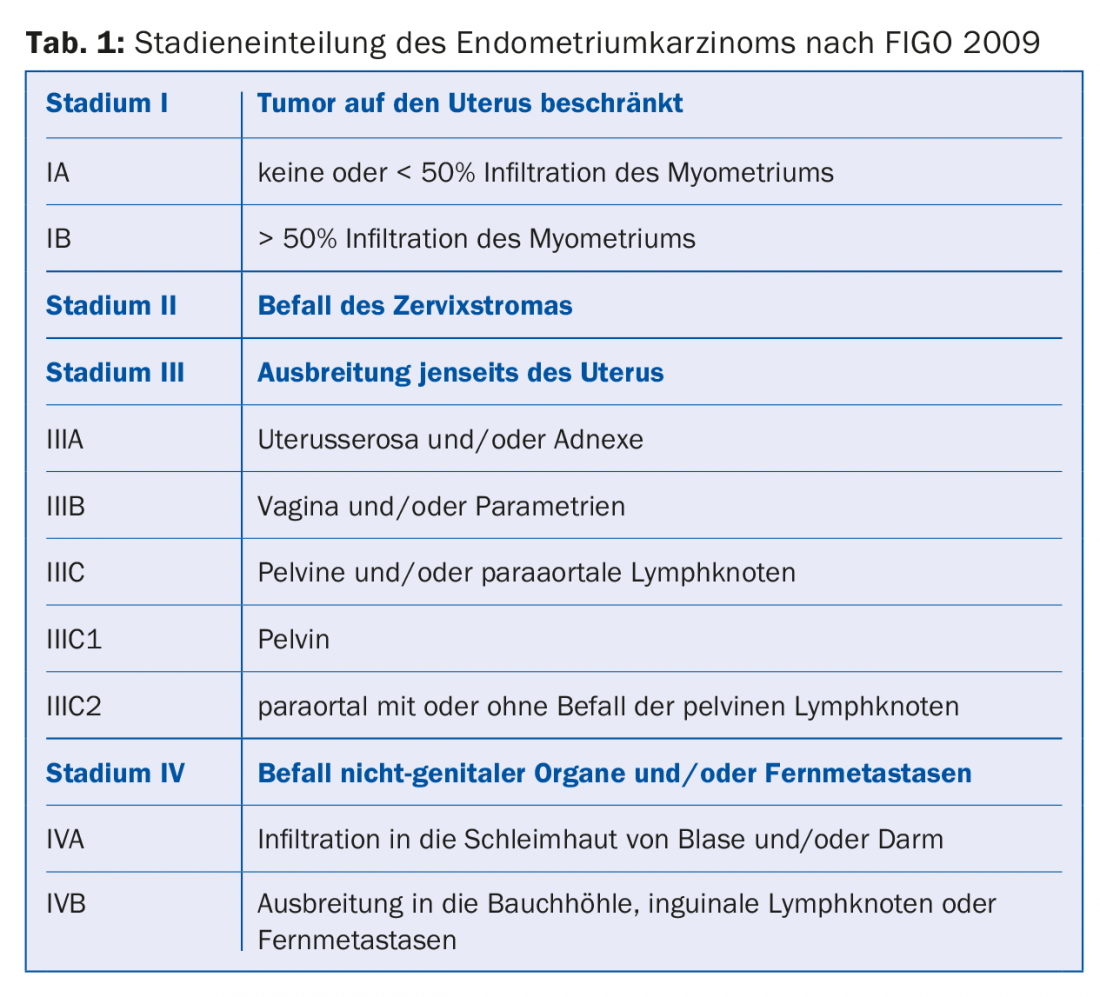
En el estadio I, se definen tres grupos de riesgo en función del estadio histológico de madurez (G1-3) y de la histología (tipo endometrioide frente a tipo no endometrioide) (Tab. 2) . Un análisis molecular exhaustivo de 373 carcinomas endometriales publicado en 2013 identificó cuatro subtipos pronósticamente diferentes. Esto podría dar lugar a una nueva clasificación en el futuro, que posiblemente cambiaría la terapia del carcinoma endometrial [5].

Diagnóstico
No existe ninguna medida de cribado basada en pruebas con respecto al carcinoma endometrial. La enfermedad se diagnostica con mayor frecuencia en mujeres posmenopáusicas debido a hemorragias vaginales. En la premenopausia, puede manifestarse a través de cambios en la intensidad y la frecuencia de la menstruación. A menudo, el diagnóstico puede sospecharse ya mediante ecografía vaginal y establecerse después con la llamada pipelle de cornier (biopsia endometrial). Es importante establecer si el origen de la hemorragia es realmente el cavum uteri y no el cuello uterino, la vagina, el recto o incluso la vejiga. Si la pipelle no es posible o la biopsia no es representativa, el diagnóstico se realiza mediante histeroscopia y legrado. Si se sospecha un estadio avanzado, puede realizarse un TAC abdominal para la estadificación preoperatoria.
Cirugía
Deseo de tener hijos: En caso de deseo urgente de tener hijos y carcinoma endometrioide bien diferenciado en estadio T1a, puede considerarse la terapia de preservación de la fertilidad si se ha asegurado histeroscópicamente que no hay carcinoma residual en el útero. La infiltración miometrial y las metástasis ováricas deben excluirse mediante ecografía transvaginal, resonancia magnética y laparoscopia. Los pacientes deben ser informados sobre la mayor probabilidad de recidiva, la posibilidad de progresión y la necesidad de un seguimiento estrecho. La aplicación oral continua de progestágenos con acetato de medroxiprogesterona 200 mg/día es la terapia de elección. Revisiones trimestrales con ecografía transvaginal, histeroscopia y biopsia endometrial. El embarazo sólo debe intentarse después de una reimplantación discreta, si es necesario con reproducción asistida, para que el tiempo hasta el embarazo sea lo más corto posible. Una vez cumplido el deseo de tener un hijo, es necesaria una terapia quirúrgica adecuada al estadio debido al alto riesgo de recidiva.
Estadificación laparoscópica: Salvo en casos de deseo urgente de tener un hijo y situaciones de alto riesgo con operabilidad limitada, la terapia quirúrgica se realiza principalmente. La estadificación quirúrgica sistemática consiste en una histerectomía, una anexectomía bilateral y, en función del perfil de riesgo, una linfonodectomía centinela y/o pélvica y paraórtica. En raras ocasiones, también está indicada una omentectomía. Tradicionalmente, la estadificación del carcinoma endometrial se ha realizado mediante laparotomía. Sin embargo, en los últimos años varios estudios han comparado la estadificación mediante laparotomía con la estadificación mediante laparoscopia [6]. Dado que en estudios aleatorizados y metaanálisis se han demostrado las claras ventajas del procedimiento laparoscópico frente a la cirugía abierta clásica (menos complicaciones y hospitalización más corta) con la misma frecuencia de recidiva y la misma tasa de supervivencia a 5 años, hoy en día la cirugía debería realizarse por vía laparoscópica de forma estándar. (Fig. 1). En cuanto a la cirugía asistida por robot, hasta la fecha no se ha publicado ningún estudio que demuestre una ventaja sobre la laparoscopia en el tratamiento quirúrgico del carcinoma endometrial.
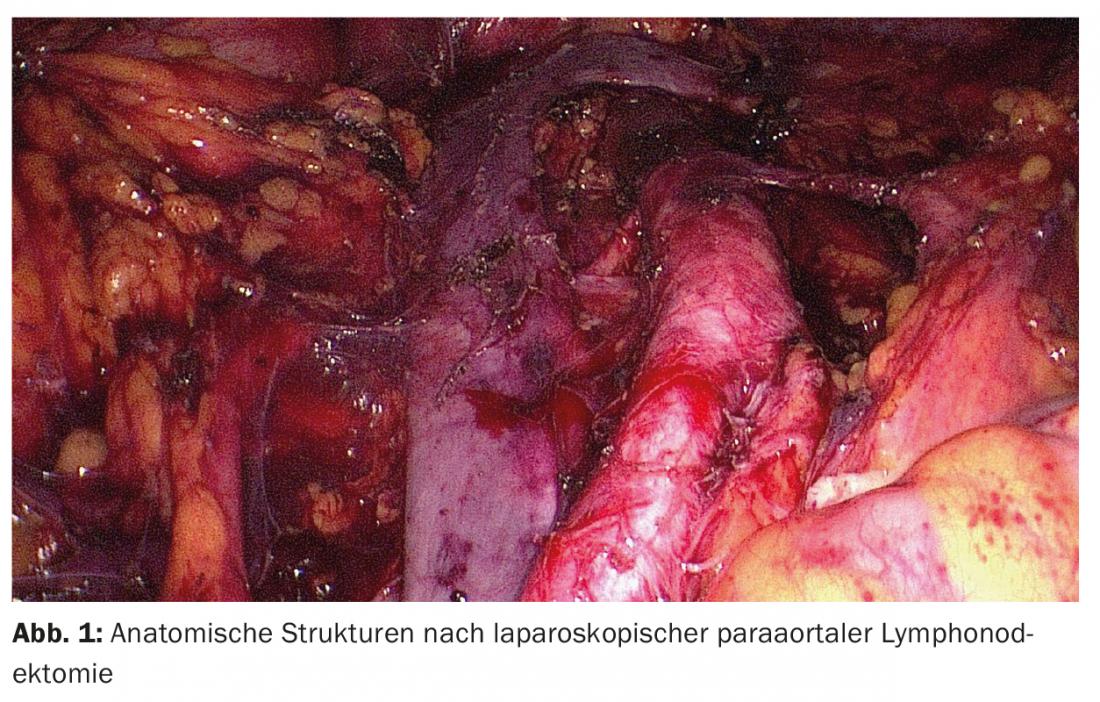
Linfonodectomía: Una cuestión central controvertida es cuándo debe realizarse una linfonodectomía y en qué medida. Dos ensayos multicéntricos aleatorizados, que desgraciadamente presentan graves defectos formales, no lograron demostrar un beneficio en la supervivencia de la linfonodectomía pélvica sola [7,8]. Los datos sobre la importancia de la linfonodectomía pélvica y paraórtica sistemática son escasos; no existen estudios prospectivos aleatorizados. Un estudio de cohortes retrospectivo demostró que las pacientes con un riesgo intermedio o alto de recidiva que se sometieron a una linfonodectomía pélvica y paraórtica tenían una esperanza de vida mayor que las que se sometieron únicamente a una linfonodectomía pélvica. Esta ventaja no se encontró en el riesgo bajo [9].
Aunque el efecto terapéutico directo de la linfonodectomía sigue siendo controvertido, en general se acepta que sirve para evaluar el pronóstico y decidir la terapia adyuvante. Si los ganglios linfáticos son poco visibles, se puede prescindir de la terapia adyuvante, evitando así una toxicidad innecesaria. Dado que la linfonodectomía aumenta la morbilidad tanto operatoria como postoperatoria, sólo debe realizarse si existe una alta probabilidad de que los ganglios linfáticos sean cancerosos. Un estudio prospectivo de cohortes muestra que en las pacientes con un riesgo intermedio y alto de recidiva, los ganglios linfáticos pélvicos fueron positivos en un 17% y los ganglios linfáticos paraaórticos en un 12%. El 55% de las pacientes con ganglios linfáticos pélvicos positivos también tenían ganglios linfáticos paraaórticos positivos. Además, el 3% de las pacientes con ganglios linfáticos pélvicos negativos tenían ganglios linfáticos paraaórticos positivos.
Curiosamente, la mayoría de los pacientes con ganglios linfáticos paraaórticos positivos mostraron afectación entre los vasos renales y la arteria mesentérica inferior (AMI) [10]. Así pues, en los casos de riesgo intermedio y alto de recidiva, se suele recomendar la linfonodectomía pélvica y paraórtica. En cambio, si el riesgo es bajo, la probabilidad de que haya ganglios linfáticos cancerosos es tan baja (3-5%) que no se realiza una linfonodectomía.
Sin embargo, como ya se ha mencionado, la linfonodectomía está asociada a la morbilidad intra y postoperatoria. Según los estudios, el riesgo de linfedema oscila entre el 5 y el 38%. Para evitarlo, el concepto de ganglio linfático centinela también se está evaluando actualmente en el carcinoma endometrial en varios estudios en curso. Un metaanálisis de 26 estudios con 1101 intervenciones del ganglio linfático centinela mostró una sensibilidad del 93% para la detección de metástasis en los ganglios linfáticos [11]. La técnica ICG parece ofrecer los mejores índices de detección (Fig. 2) y es posible que se imponga en el futuro [12]. Esto permitiría captar los ganglios linfáticos raramente afectados por carcinoma con un riesgo bajo e intermedio de recidiva.

Estadios superiores: Si el estroma cervical está afectado (FIGO II), cabe suponer que el riesgo de afectación parametrial es similar al del carcinoma cervical, pero los datos actuales no lo confirman. Parece que la invasión linfovascular es un mejor indicador de la propagación parametrial que la infestación del estroma cervical. Por lo tanto, la histerectomía radical no se recomienda necesariamente para los carcinomas endometriales FIGO II. Si el tumor se ha extendido a la vagina y/o a los parametrios (FIGO IIIB), se realiza una histerectomía radical ampliada, con resección de los parametrios y, si es necesario, con colpectomía. En estadios incurables y avanzados, puede considerarse la intervención quirúrgica (histerectomía para la profilaxis de hemorragias, citorreducción de grandes masas tumorales) en un contexto paliativo.
Tratamientos adyuvantes
Radioterapia: El último metaanálisis Cochrane demostró que la radioterapia percutánea postoperatoria para el cáncer de endometrio en estadio I FIGO de bajo riesgo no aporta beneficios [13]. Aunque la radioterapia externa, es decir, percutánea, mejora el control local del tumor en los casos de riesgo intermedio y alto, no puede prolongar la supervivencia. Debido a la menor toxicidad con la misma eficacia, la braquiterapia vaginal postoperatoria es preferible a la radiación externa para el tratamiento del carcinoma endometrial precoz de riesgo intermedio a alto.
Quimioterapia adyuvante, combinación con radioterapia percutánea: Sólo en estadios tumorales avanzados (FIGO III y pacientes bien tratados quirúrgicamente con enfermedad FIGO IV) está indicada la quimioterapia adyuvante con doxorrubicina y cisplatino, que mejora la supervivencia en un 25% [14]. El ensayo PORTEC-3, que no finalizará hasta dentro de unos años, está probando de forma aleatoria la radioterapia percutánea frente a la radioquimioterapia en pacientes del estadio IB con una constelación de alto riesgo.
Recurrencias y terapias paliativas
Las recaídas suelen producirse en un plazo de tres años. El espectro es amplio y va desde las recidivas vaginales aisladas, que de nuevo pueden tratarse de forma curativa con terapias locales, hasta las manifestaciones diseminadas. Los tumores bien diferenciados, las recaídas tardías y las metástasis pulmonares pueden tratarse mejor, mientras que las recaídas tras la quimioterapia adyuvante son de pronóstico desfavorable. Sólo existen pocos datos para esta situación en comparación con otros tumores, por ejemplo para el temsirolimus o el bevacizumab. Las terapias hormonales paliativas son una alternativa frecuentemente utilizada y bien tolerada en pacientes oligosintomáticas con tumores bien diferenciados y con receptores hormonales positivos. Las tasas de respuesta alcanzan ~30% y no pocas veces son duraderas. Se utilizan el acetato de medroxiprogesterona (=Farlutal), el tamoxifeno, que es ligeramente menos eficaz pero claramente mejor que los inhibidores de la aromatasa letrozol o anastrozol.
Resumen y perspectivas
El carcinoma endometrial suele diagnosticarse en una fase temprana. A menudo, el diagnóstico puede realizarse sin complicaciones. Es más difícil ajustar la radicalidad de la terapia con el perfil de riesgo del tumor y también con los recursos del paciente.
En el futuro, junto con la diferenciación molecular, la cirugía mínimamente invasiva y la linfonodectomía centinela, la cirugía y las terapias adyuvantes podrán adaptarse de la forma más idónea posible.
Literatura:
- Weiderpass E, et al: Tendencias en la mortalidad por cáncer de cuerpo uterino en los estados miembros de la Unión Europea. Eur J Cancer 2014;50: 1675-1684.
- Bjørge T, et. al.: Tamaño corporal en relación con el cáncer de cuerpo uterino en 1 millón de mujeres noruegas. Int J Cancer 2007; 120: 378.
- Pecorelli S: Estadificación FIGO revisada para el carcinoma de vulva, cuello uterino y endometrio. Int J Gynaecol Obstet. 2009;105: 103-104.
- Lewin SN, et al: Rendimiento comparativo del sistema de estadificación del cáncer de cuerpo uterino de la Federación Internacional de Ginecología y Obstetricia de 2009. Obstet Gynecol. 2010;116: 1141-1149.
- Cancer Genome Atlas Research N, Kandoth C, et al: Caracterización genómica integrada del carcinoma endometrial. Nature 2013;497: 67-73.
- Santi A, et al: ¿Laparoscopia o laparotomía? Una comparación de 240 pacientes con cáncer de endometrio en estadio inicial. Surg Endosc. 2010;24(4): 939-43
- Benedetti Panici P, et al: Linfadenectomía pélvica sistemática frente a no linfadenectomía en el carcinoma de endometrio en estadio temprano: ensayo clínico aleatorizado. J Natl Cancer Inst. 2008;100: 1707-1716.
- Grupo de estudio ASTEC, Kitchener H, et al: Eficacia de la linfadenectomía pélvica sistemática en el cáncer de endometrio (ensayo ASTEC del MRC): un estudio aleatorizado. Lancet 2009;373: 125-136.
- Todo Y, et al: Efecto sobre la supervivencia de la linfadenectomía paraaórtica en el cáncer de endometrio (estudio SEPAL): un análisis de cohortes retrospectivo. Lancet. 2010;375: 1165-1172.
- Kumar S, et al: Evaluación prospectiva de la prevalencia de metástasis en los ganglios linfáticos pélvicos, paraaórticos y paraaórticos altos en el cáncer de endometrio. Gynecol Oncol. 2014; 132(1): 38-43.
- Kang S, et.al.: Biopsia del ganglio linfático centinela en el cáncer de endometrio: metaanálisis de 26 estudios. Gynecol Oncol 2011; 123: 522.
- Papadia A, et. al: Mapeo laparoscópico del ganglio linfático centinela con verde de indocianina en el cáncer de endometrio. Ann Surg Oncol. 2016; 2206-2211
- Kong A, et al: Radioterapia adyuvante para el cáncer de endometrio en estadio I. Cochrane Database Syst Rev. 2012;4.
- Galaal K, et al.: Quimioterapia adyuvante para el cáncer de endometrio avanzado. Cochrane Database Syst Rev. 2014;5.
PRÁCTICA GP 2017; 12(2): 19-24