Aunque el cáncer testicular sólo representa el 1% de las enfermedades oncológicas en los hombres, es el tipo de cáncer más frecuente en los varones. En el Congreso Suizo de Oncología y Hematología SOHC, el Dr. Richard Cathomas, médico jefe adjunto del Hospital Cantonal de los Grisones, aportó interesantes conocimientos sobre el diagnóstico y la terapia de los estadios iniciales de la enfermedad.
En el mundo occidental, entre 3 y 10 de cada 100.000 hombres son diagnosticados de cáncer testicular cada año; en Suiza, esta enfermedad sigue afectando a unos 400 pacientes, en su mayoría jóvenes. Aunque los tumores no seminomatosos también se encuentran con más frecuencia entre los menores de 30 años, la proporción de seminomas aumenta en el grupo de edad de 30-40 años. En general, el 95% de los casos son tumores de células germinales, y el 70% se detectan en el estadio I. El diagnóstico más común es el de “seminoma en estadio I”, es decir, en aproximadamente la mitad de los afectados. Pero, ¿qué significa eso en términos concretos?
Estadificación e histología
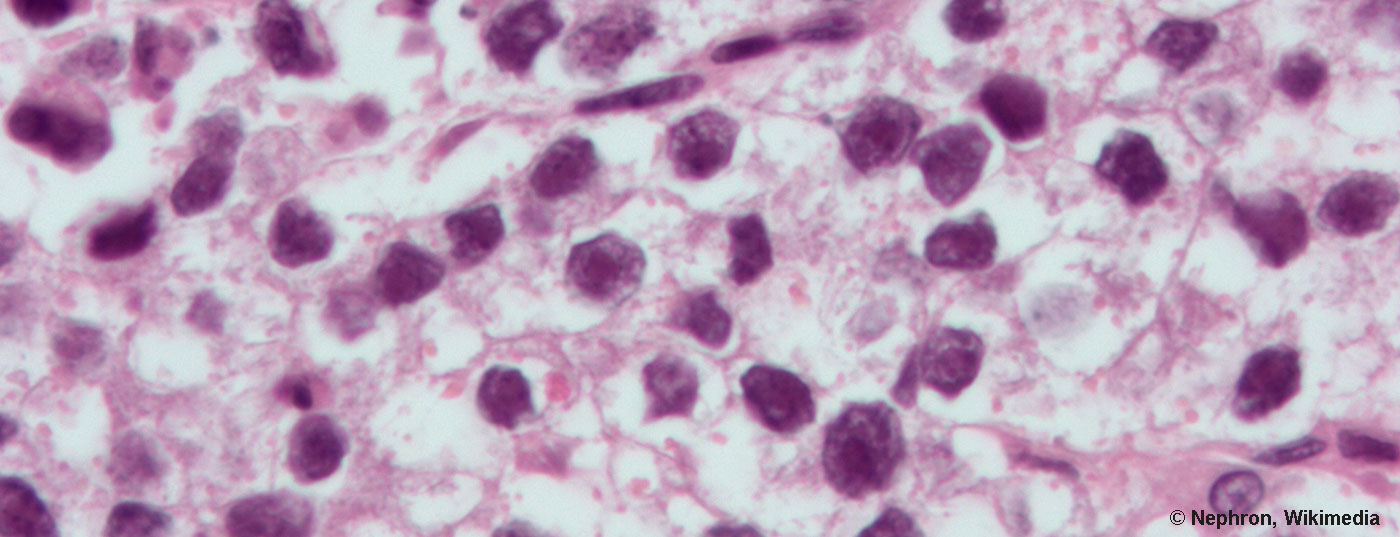
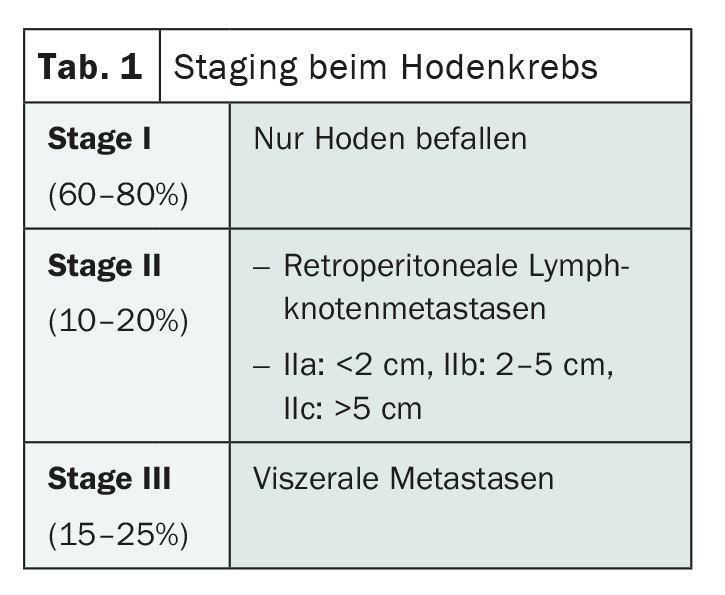
Los tumores de células germinales del testículo se dividen histológicamente a grandes rasgos en las dos categorías de seminomas y no seminomas, con un cierto predominio de los seminomas. El Dr. Cathomas subraya que cualquier tumor que presente partes no seminomatosas debe considerarse un no seminoma y tratarse en consecuencia. En ambos grupos, la estadificación se basa en los mismos criterios. Mientras que el tumor se limita a los testículos en el estadio I, los ganglios linfáticos retroperitoneales se ven afectados en el estadio II y los órganos viscerales, especialmente los pulmones, también se ven afectados en el estadio III. (Tab.1). Para una subdivisión más precisa y una mejor evaluación del pronóstico, existe otra clasificación para los estadios II y III basada en los llamados grupos de riesgo del IGCCCG (Grupo Internacional de Colaboración en Cáncer de Células Germinales).
Diagnóstico en la confusión de las directrices
Desde el consenso de la ESMO hasta las directrices de la NCCN y la EAU: existen numerosas recomendaciones para el tratamiento óptimo del cáncer de testículo [1–3]. En la SOHC, el Dr. Cathomas presentó una vía intermedia, que -bastante suiza- representa un compromiso de las distintas directrices y que suele seguirse en este país.
Además de la anamnesis y la exploración clínica, el diagnóstico debe incluir una ecografía testicular bilateral, la determinación de los marcadores tumorales HCG, AFP y LDH, así como un TAC de tórax/abdomen/pelvis (resumen 1) . El experto desaconseja explícitamente la realización de un PET-TAC. Debe realizarse una biopsia del lado no afectado en los menores de 40 años con testículos pequeños, microlitiasis o maldescenso para excluir la afectación simultánea del segundo testículo. Lo ideal es que el estudio histológico tras la orquiectomía se realice en un centro especializado.

En el postoperatorio, los marcadores tumorales deben vigilarse hasta que se hayan normalizado, hayan alcanzado un nadir o -lo que es menos favorable- estén aumentando. También se recomienda repetir el TAC al cabo de seis u ocho semanas en caso de hallazgos poco claros antes de decidir el procedimiento terapéutico ulterior, incluso si los marcadores tumorales se encuentran en el rango normal. En caso de enfermedad metastásica y un pronóstico intermedio o incluso malo, el Dr. Cathomas recomienda además el uso de una resonancia magnética craneal.
Según el experto, una radiografía de tórax es suficiente para el seguimiento radiológico, aunque sólo es necesario realizarla en el caso de los no seminomas. Una resonancia magnética abdominal también es superior a un TAC.
Una opción de la que ningún paciente debería privarse es la criopreservación de esperma. Esta posibilidad debe discutirse a más tardar antes del inicio de la radio o la quimioterapia y debe recomendarse a todas las que deseen tener un hijo.
Marcadores tumorales de un vistazo
Los tres marcadores tumorales alfa fetoproteína (AFP), gonadotropina coriónica humana (hCG) y lactato deshidrogenasa (LDH ) han desempeñado durante mucho tiempo un papel importante en el diagnóstico y seguimiento del cáncer testicular (Tab. 2). Su interpretación suele ser suficiente para distinguir entre tumores seminomatosos y no seminomatosos, por ejemplo. Por ejemplo, la AFP nunca es medible en los seminomas, mientras que la hCG puede aumentar tanto en los seminomas como en los no seminomas. Dado que también se produce un ligero aumento sin significación clínica, se recomienda precaución al interpretar los valores de AFP. La LDH, más inespecífica, también debe interpretarse con cautela, pero según el Dr. Cathomas, debe medirse antes de iniciar la terapia y en el seguimiento. El conocimiento de la vida media puede simplificar el diseño de los marcadores. Mientras que para la AFP son de cinco a seis días, para la hCG son de 24 a 36 horas. Los valores de los marcadores tras la orquiectomía son decisivos para la clasificación del riesgo según el IGCCCG.

Terapia de una enfermedad de pronóstico favorable: atención a la tasa de recaída
Si el diagnóstico confirma el diagnóstico de cáncer de testículo más frecuente, un seminoma en la primera fase, el pronóstico es favorable. Los requisitos para ello son la ausencia de metástasis en el estadiaje, una normalización postoperatoria de los marcadores tumorales, en particular la hCG, la ausencia de aumento de AFP y la ausencia de partes tumorales no seminomatosas. Independientemente de la terapia elegida, la supervivencia a 10 años específica de la enfermedad en este caso es superior al 99%, con tasas de recaída de hasta el 30%, siendo el tamaño del tumor y la invasión de la rete testicular factores pronósticos desfavorables. Sin embargo, no se tienen en cuenta en la elección del tratamiento. La terapia adyuvante con una dosis única de carboplatino AUC 7 o la radioterapia retroperitoneal pueden reducir la tasa de recaída a un 5% aproximadamente. La vigilancia activa tras la orquiectomía sigue siendo el tratamiento estándar para todos los pacientes a pesar de esta reducción del riesgo, según el Dr. Cathomas. Sin embargo, subraya que la quimioterapia adyuvante puede ser útil, especialmente si el tamaño del tumor supera los 4 cm, mientras que desaconseja encarecidamente el uso de radioterapia adyuvante.
Si el tumor testicular recién diagnosticado es un no seminoma sin metástasis y con valores postoperatorios normales de AFP y hCG, la situación es algo diferente. Aunque el pronóstico en este caso también es igual de favorable que en el seminoma, existe un subgrupo con tasas de recaída de alrededor del 50%. Se trata de tumores que muestran invasión linfovascular y se denominan tumores de altoriesgo debido a esta característica. Para reducir la tasa de recaída, se recomienda un ciclo de BEP (bleomicina, etopósido, cisplatino) adyuvante para estos tumores germinales no seminomatosos de alto riesgo. De este modo, el riesgo de recidiva puede reducirse a menos del 4%, según el Dr. Cathomas. Sin embargo, para todos los demás no seminomas en estadio I, la vigilancia activa es suficiente. Existen directrices claras tanto para los tumores de células germinales seminomatosos como para los no seminomatosos, que prevén un seguimiento regular de los marcadores tumorales y un diagnóstico por imagen mediante TAC abdominal o IRM, así como radiografías de tórax para los no seminomas, especialmente en los primeros cinco años.
Fuente: Congreso Suizo de Oncología y Hematología 18-21.11.2020, Sesión a la carta “Cáncer de testículo: herramientas de diagnóstico y tratamiento fase I”, PD Dr. med. Richard Cathomas, Médico Jefe Adjunto de Oncología y Hematología del Hospital Cantonal de los Grisones.
Literatura:
- Gilligan T, et al: Cáncer de testículo, versión 2.2020, Guías de práctica clínica en oncología de la NCCN. J Natl Compr Canc Netw. 2019; 17(12): 1529-1554.
- Laguna M, et al: Cáncer testicular 2020. https://uroweb.org/guideline/testicular-cancer/ (último acceso 18.11.2020).
- Honecker F, et al: Conferencia de consenso de la ESMO sobre el cáncer testicular de células germinales: diagnóstico, tratamiento y seguimiento. Ann Oncol. 2018; 29(8): 1658-1686.
InFo ONCOLOGY & HEMATOLOGY 2020; 8(6): 38-39 (publicado el 9.12.20, antes de impresión).