El tratamiento de la artritis reumatoide (AR) ha avanzado mucho en los últimos 20 años. Esto se refiere tanto a la gama de fármacos disponibles como a los avances en términos de rapidez de acción y tasas de respuesta. En 2019 se publicaron ensayos clínicos de fase III, en particular para los inhibidores de JAK, cuyos resultados se presentaron en el Rheumatism Update de Wiesbaden.
Las recomendaciones actualizadas para 2019 de la Liga Europea contra el Reumatismo (EULAR) muestran pocas diferencias respecto a ediciones anteriores. Relevante es la recomendación de utilizar un segundo bloqueante del TNF como máximo en caso de fracaso terapéutico con el primer bloqueante del TNF. Los inhibidores de JAK siguen posicionándose tras el fracaso del tratamiento con csDMARDs o biológicos. Esto puede interpretarse formalmente en el sentido de que el cambio de un inhibidor de JAK a otro es posible y sensato en caso de fracaso terapéutico, explicó la Prof. Dra. Andrea Rubbert-Roth, de la Clínica de Reumatología del Hospital Cantonal de San Gall. Sin embargo, aún no hay datos disponibles. En vista de la reciente aprobación del upadacitinib y pronto también del filgotinib, se plantea la cuestión de una estrategia de cambio óptima, especialmente para los inhibidores JAK.
Cuatro inhibidores JAK disponibles para la AR
El año pasado, el peficitinib recibió la aprobación para el mercado japonés. Así pues, en la actualidad existen cuatro inhibidores de JAK aprobados para el tratamiento de la AR, aunque el peficitinib aún no ha sido aprobado para su uso en EE.UU. o Europa. El experto se ocupó principalmente de la cuestión de las diferencias específicas de cada sustancia en cuanto a eficacia y perfil de seguridad. En vista de su difícil manejo (necesidad de refrigeración, administración parenteral), debe afirmarse que los biológicos no representan la forma óptima de terapia para todos los pacientes, sobre todo porque sólo una minoría logra una remisión clínica continua. Por otro lado, el dolor, las limitaciones funcionales, la fatiga y la depresión representan una elevada carga de enfermedad para los afectados.
La selectividad de los inhibidores de JAK, es decir, la inhibición de isoformas individuales a una determinada concentración intracelular, es el principal objetivo de los estudios. Se busca así la relación óptima entre eficacia y efectos secundarios, como la anemia. El programa de ensayos clínicos de fase III para el tofacitinib y el baricitinib ha finalizado; en el caso del upadacinitib, aún se esperan los resultados de un estudio comparativo con el abatacept en pacientes con AR que no han respondido adecuadamente a una terapia biológica previa.
Tofacitinib
Con el tofacitinib no hay muchas novedades en cuanto a su eficacia, ya que está disponible y es bien conocido en EE.UU. desde hace muchos años. El tofacitinib también está aprobado en Suiza desde 2013. Un nuevo análisis post hoc relativo a los pacientes seropositivos y seronegativos ha mostrado una respuesta comparable en ambos grupos. Las tasas de remisión DAS28 fueron ligeramente inferiores a las de los pacientes con CCP.
En el análisis, se agruparon los datos de cinco estudios de fase III y se definieron subgrupos en función de la serología: RF+CCP+, RF+CCP-, RF-CCP+ y RF-CCP-. Como resultado, los pacientes con RF+CCP+ tuvieron una mayor probabilidad de lograr una respuesta ACR-20, -50 o -70 que los pacientes con RF-CCP. Este resultado se mostró para la respuesta ACR-20 y -50 tanto para el tofacitinib 5 mg dos veces al día como para el tofacitinib 10 mg dos veces al día. Por el contrario, la respuesta ACR-70 sólo fue mejor con la dosis más alta [1].
Otro estudio analizó el riesgo de eventos cardiovasculares con el tofacitinib. La evaluación de un estudio actual de fase IV que compara el tofacitinib con los bloqueantes del TNF (adalimumab, etanercept) en pacientes de más de 50 años y al menos un factor de riesgo adicional de acontecimientos cardiovasculares mostró que el riesgo de acontecimientos tromboembólicos asociado al tofacitinib debe considerarse aumentado.
El riesgo de embolia pulmonar aumentó significativamente con el tofacitinib en la dosis de 10 mg y también fue mayor con 5 mg dos veces al día que en estudios anteriores. Además, la mortalidad por todas las causas fue mayor con 10 mg dos veces al día que con 5 mg dos veces al día. Posteriormente, la EMA emitió una recomendación para que el tofacitinib no se utilizara en pacientes con mayor riesgo de tromboembolismo. Los pacientes con AR mayores de 65 años sólo deben ser tratados con tofacitinib si no existe alternativa terapéutica. La profesora Rubbert-Roth comentó que le parece “insólita” la recomendación de la EMA basada en un estudio que aún no se ha presentado ni debatido científicamente y espera que esto ocurra pronto.
Baricitinib
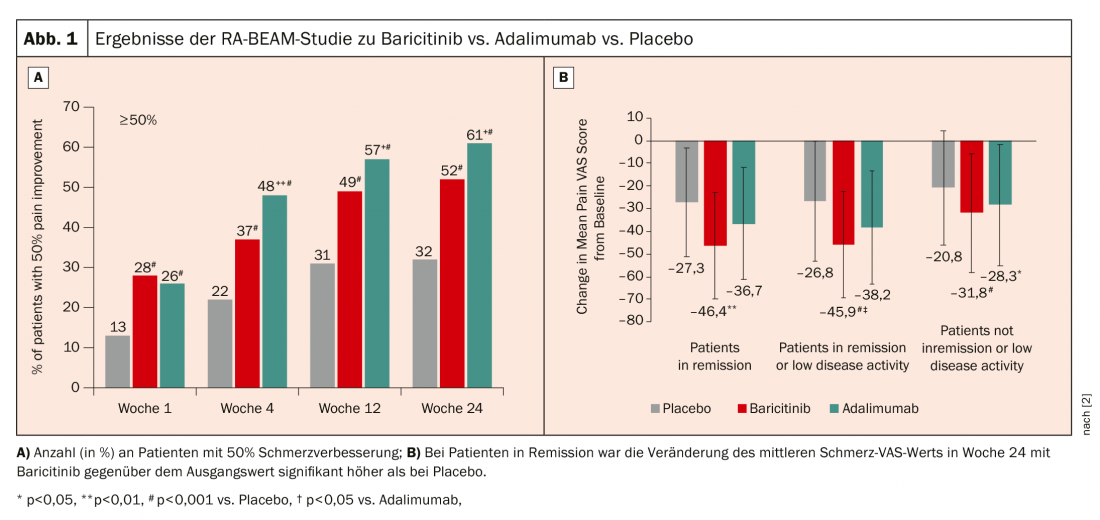
El baricitinib está aprobado en Suiza desde 2017 en una dosis de 4 mg (2 mg en pacientes de edad avanzada o con insuficiencia renal). En el estudio RA-BEAM, se comparó baricitinib 4 mg + MTX con adalimumab + MTX y placebo + MTX [2]. En este caso, se ha demostrado que la mejora del dolor del 50% es mejor con baricitinib. (Fig.1A). Si observamos más detenidamente sólo a los pacientes que están en remisión o tienen una baja actividad de la enfermedad, seguimos viendo un efecto significativo sobre el dolor con baricitinib. (Fig.1B). El reumatólogo sólo puede especular por qué es así: “Es posible que los receptores del dolor también utilicen las JAK en su señalización, lo que significa que también tienen efectos específicos sobre el dolor. El efecto positivo también pudo observarse tras un cambio de adalimumab a baricitinib al cabo de una semana. 16 determinar.
En cuanto a la respuesta de vacunación con baricitinib, se han probado la PCV13 y el toxoide tetánico (TT). 106 Los pacientes del estudio RA-BEYOND que recibieron 2 mg o 4 mg de baricitinib (con y sin MTX) fueron vacunados con PCV13 y contra el tétanos. En general, el 68% de los pacientes mostraron una respuesta de vacunación suficiente contra el neumococo, el 43% lograron un aumento de los títulos de vacunación de más de 4 veces para el tétanos. El 74 % de los pacientes lograron un aumento de más de 2 veces tras la PCV13 [3].
Upadacitinib
Según el Prof. Rubbert-Roth, uno de los estudios más importantes del año pasado es el SELECT-COMPARE, que comparó el upadacitinib frente al adalimumab frente al placebo en pacientes MTX-IR con AR activa [4]. En este estudio, existía la opción de cambiar de upadacitinib a adalimumab en la semana 12 y viceversa (en las semanas 14, 18, 22 y 26) si se producía una mejoría inferior al 20% en las articulaciones dolorosas e inflamadas (criterios de valoración coprincipales ACR20 y DAS28-CRP <2,6).
El estudio de 1629 pacientes con AR activa a pesar del MTX demostró que el upadacitinib (aprobado en Suiza desde la primavera de 2020) era estadísticamente más eficaz que el adalimumab: el 71% de los pacientes lograron una respuesta ACR20 con upadacitinib, sólo el 63% con adalimumab y el 36% con placebo. El 29% de los pacientes alcanzaron la remisión según el DAS28-CRP, frente a sólo el 18% con adalimumab y el 6% con placebo. En cuanto a los efectos secundarios, el herper zoster y las elevaciones de la CK fueron más frecuentes con el upadacitinib, el tromboembolismo venoso (TEV) se produjo en 3 pacientes con adalimumab frente a 2 pacientes con upadacitinib. En cuanto a los no respondedores, se observó que el cambio de upadacitinib a adalimumab hizo que el 13% lograra la remisión, mientras que, a la inversa, el cambio de adalimumab a upadacitinib hizo que el 26% lograra el resultado deseado.
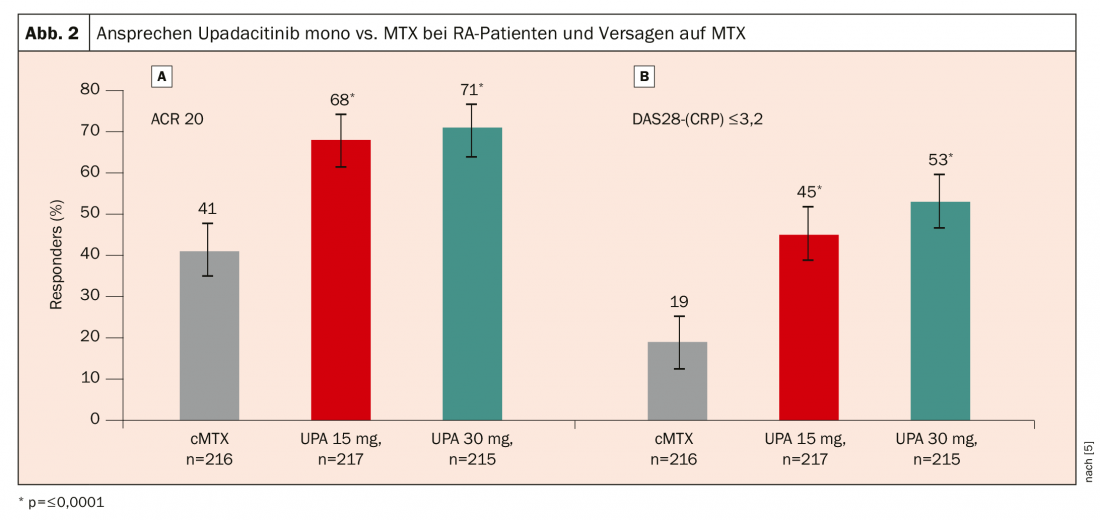
En el ensayo SELECT-MONOTHERAPY, 648 pacientes con AR activa a pesar del MTX fueron aleatorizados a la continuación del tratamiento con MTX o a upadacitinib 15 mg o 30 mg en monoterapia [5]. De nuevo, se observó una respuesta significativamente mejor con el upadacitinib: tras 14 semanas, se alcanzó una respuesta ACR20 en el 68% de los pacientes con upadacitinib 15 mg y en el 71% con upadacitinib 30 mg, en comparación con sólo el 41% de los pacientes que continuaron con el tratamiento con MTX (Fig. 2).
Filgotinib y peficitinib
El filgotinib se considera un inhibidor selectivo de JAK1, y el programa de ensayos de fase III FINCH1, -2 y -3 se publicó o presentó en los congresos internacionales de 2019. En FINCH2, se estudió la eficacia y la seguridad del filgotinib (100 mg o 200 mg diarios) en comparación con el placebo durante 24 semanas en 449 pacientes con AR activa a pesar de un tratamiento estable con csDMARDs y fracaso o intolerancia previa al tratamiento con biológicos (bDMARDs) [6]. El 23,4% de los pacientes tenían tres o más bDMARD previos; el criterio de valoración primario fue la consecución de una respuesta ACR20 a las 12 semanas. El resultado aquí fue que el 66% cumplió el criterio de valoración primario con filgotinib 200 mg, el 57,5% con filgotinib 100 mg y el 31,1% de los pacientes con placebo. En los pacientes con fracaso del tratamiento con al menos tres bDMARD, la respuesta ACR20 fue del 70,3% con 200 mg de filgotinib, del 58,8% con 100 mg y del 17,6% con placebo. “Sin duda, ésta también será una sustancia que pronto se registrará”, valoró el Prof. Rubbert-Roth.
Sin embargo, el experto no parece estar tan convencido sobre el peficitinib, que se aprobará en Japón en 2019. Sólo hizo referencia a un estudio que analizó el inhibidor pan-JAK frente al placebo durante 52 semanas en pacientes con AR activa a pesar de los DMARD convencionales pero sin registrar progresión radiográfica. Se aleatorizó a 507 pacientes. El peficitinib mostró una respuesta ACR20 del 57,7% a las 12 semanas con peficitinib 100 mg y del 74,5% con peficitinib 150 mg frente al 30,7% con placebo (p<0,001). Sin embargo, un brazo de comparación abierto con etanercept demostró que el etanercept superaba sistemáticamente al peficitinib, logrando una respuesta ACR20 del 83,5%.
Fuente: Rheumatism Update, Wiesbaden (D)
Literatura:
- Bird P, Hall S, Nask P, et al: RMD open 2019; 5: e000742; doi:10.1136/rmdopen-2018-000742. (Epub ahead of print).
- Fautrel B, Kirkham B, Pope JE, et al: J Clin Med 2019; 8: 1394-408.
- Winthrop K, Bingham CO, Komocsar WJ, et al: Arthritis Res Ther 2019; 21: 102-112.
- Fleischmann R, Pangan AL, Song ICH, et al: Arthritis Rheumatol 2019; 71 (11): 1788-1800.
- Smolen JS, Pangan AL, Emery P, et al: Lancet 2019; 393: 2303-2311.
- Genovese MC, Kalunian K, Gottenberg JE, et al: JAMA 2019; 322 (4): 315-325.
InFo PAIN & GERIATURE 2020; 2(1): 32-35 (publicado el 5.7.20, antes de impresión).