Los programas de detección precoz aumentan la incidencia de las primeras fases del cáncer de pulmón. La cirugía sigue siendo la primera opción de tratamiento. Con una linfadenectomía completa, la resección del segmento anatómico es una alternativa equivalente a la lobectomía.
El cáncer de pulmón es el segundo cáncer más frecuente en Suiza, con una incidencia del 11,9% en los hombres y el tercero en las mujeres, con una incidencia del 8,7%. La tasa de mortalidad es la más alta entre los hombres (21,9%) y la segunda entre las mujeres (15,4%), y la tendencia es al alza [1]. Esto se debe principalmente a que el diagnóstico inicial suele realizarse en una fase avanzada y de mal pronóstico. Por ello, los programas de detección precoz han pasado a primer plano.
I-ELCAP (International Early Lung Cancer Action Program), el programa internacional para la detección precoz del cáncer de pulmón, existe desde 1992. En Suiza, el Programa Nacional de Cribado del Cáncer de Pulmón forma parte del I-ELCAP y es ejecutado por la Fundación para el Diagnóstico Pulmonar, creada en 2011 [2]. La herramienta más importante de este programa de cribado es realizar un TAC de “dosis baja” en pacientes de riesgo sin síntomas como tos, hemoptisis, disnea, ronquera, disfagia o dolor torácico. Esto incluye a todos los pacientes que han padecido anteriormente cáncer de pulmón y ahora se consideran curados, a todos los fumadores de más de 50 años y a los ex fumadores con al menos 20 paquetes-año (py). Además, todos los pacientes mayores de 50 años que ya padezcan tumores de nariz y garganta o que estén expuestos a sustancias cancerígenas (amianto, humo pasivo, cromo, arsénico, etc.) o que tengan al menos dos familiares de primer grado que padezcan cáncer de pulmón (Tab. 1) [3].

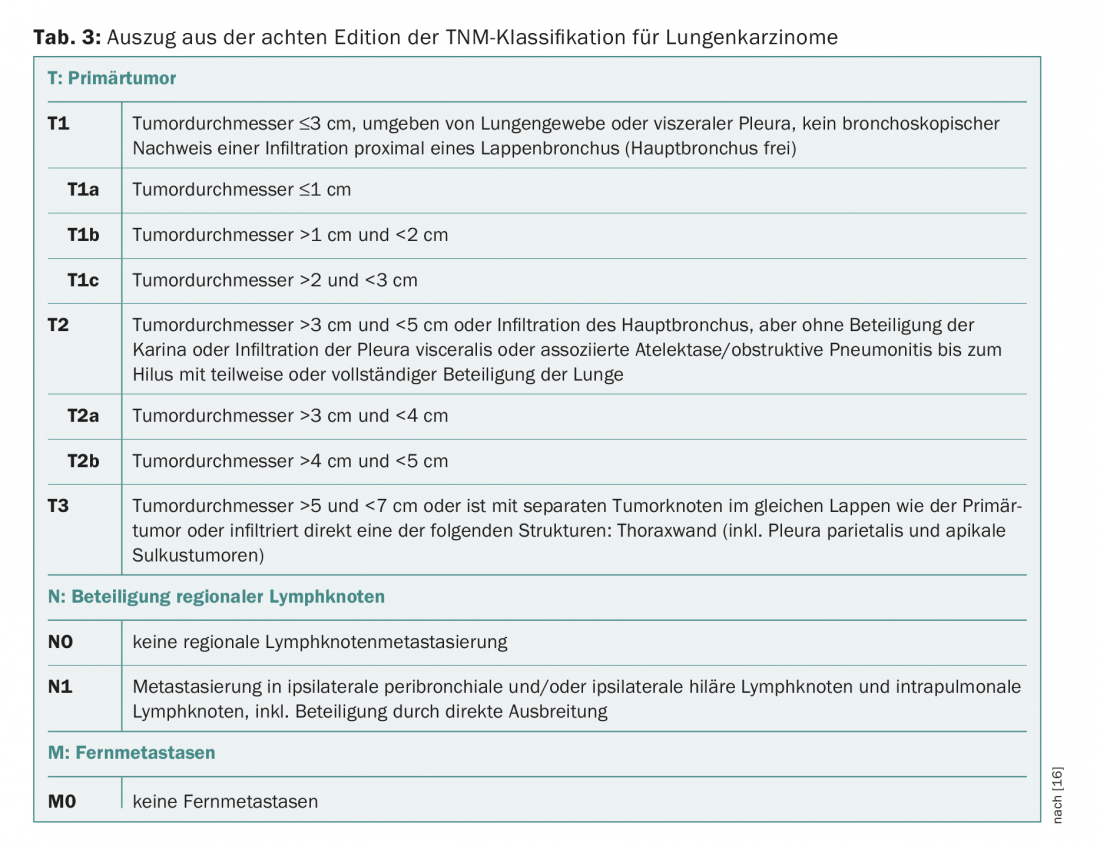
Si se sospecha un cáncer de pulmón no microcítico (CPNM) en el marco de este programa de cribado, se llevan a cabo otras aclaraciones como la broncoscopia con EBUS y PET-TAC. Los hallazgos se utilizan para la clasificación TNM (“metástasis en los ganglios tumorales”). En función del estadio TNM, el estadio clínico es IA, IB, IIA, IIB, IIIA, IIIB o IV, clasificados según la octava edición de la AJCC.
Dado que este artículo pretende tratar la terapia de los estadios iniciales del carcinoma pulmonar, nos limitaremos a continuación a una visión general de los estadios IA, IB, IIA y IIB y su correspondiente clasificación TNM (Tab. 2 y 3).

Opciones terapéuticas
A partir de esta estadificación, pueden planificarse los pasos terapéuticos posteriores en el marco de la junta interdisciplinar de tumores obligatoria. Existen dos opciones de tratamiento diferentes para los estadios iniciales I y II: Quirúrgico y no quirúrgico o radioterapia. Para tomar una decisión entre ambas, se realizan exámenes como pruebas de función pulmonar, ergometría y, en casos críticos, espiroergometría en combinación con gammagrafía de perfusión para evaluar el estado general del paciente. Se recomienda seguir las directrices de la ESMO [4].
Radioterapia
La radioterapia se recomienda a los pacientes que no son aptos para las opciones quirúrgicas debido a comorbilidades o a una función pulmonar deteriorada (FEV1 postoperatorio mínimo <1 litros). Dentro de este espectro terapéutico, existen la radioterapia estereotáctica (SBRT), la radioterapia de ablación estereotáctica (SABR) y la ablación por radiofrecuencia (RFA).
Aunque la radioterapia ha ganado considerablemente en precisión y exactitud en los últimos años gracias a los avances técnicos, tiene una desventaja importante además del conocido perfil de efectos secundarios: el tratamiento sólo se realiza sobre la base de la estadificación clínica sin confirmación patoanatómica ni confirmación del diagnóstico. Tenga en cuenta que la estadificación clínica suele ser incorrecta y que el estadio clínico a menudo no se corresponde con el patológico [5]: En el 11-14% de los casos se encuentran ganglios linfáticos afectados ocultos que no se detectan con radioterapia sola [6]. Sin la resección quirúrgica y la toma de muestras de los ganglios linfáticos o la linfadenectomía radical, estos pacientes no serán estadificados correctamente y, en consecuencia, también recibirán una atención terapéutica inadecuada. Por lo tanto, la cirugía sigue siendo la primera opción para los pacientes con CPNM en estado general operable.
Cirugía
Las opciones quirúrgicas incluyen lobectomías y resecciones sublobares (resección de segmento anatómico y resección en cuña) (Fig. 1) . Por lo general, se opta por un abordaje mínimamente invasivo (VATS) o abierto (toracotomía), en función de la localización del tumor y de las condiciones intraoperatorias. En nuestra propia población de pacientes, se opta por una técnica mínimamente invasiva en un buen 70% de los casos, por lo que también ofrece opciones terapéuticas para pacientes con un estado general reducido.
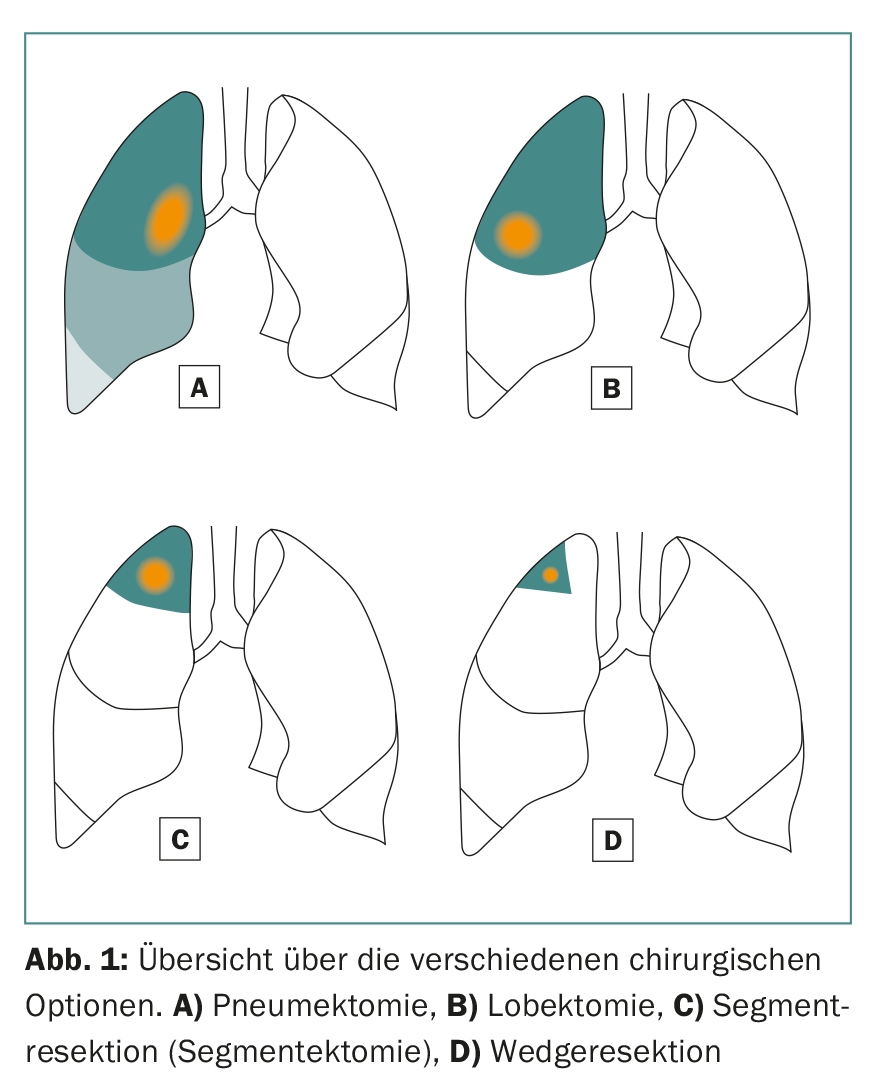
En una lobectomía, como su nombre indica, se extirpa al menos un lóbulo entero del pulmón derecho o izquierdo. Se recomienda para tumores mayores de 3 cm. Este procedimiento también tiene una gran desventaja: en el proceso se pierde mucho tejido pulmonar sano y vital.
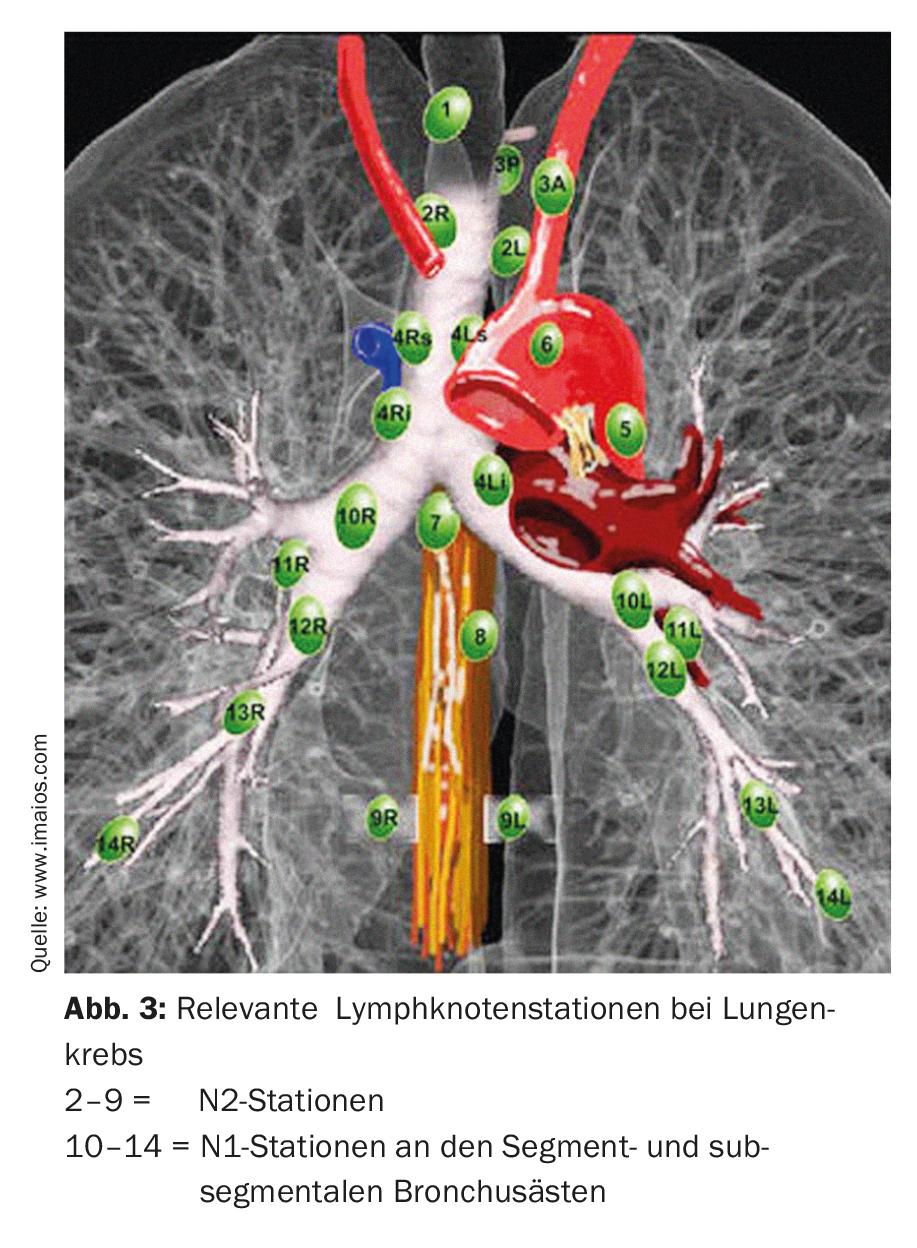
En la resección por segmentos anatómicos (segmentectomía) se resecan uno o hasta tres segmentos (resección trisegmentaria) de lóbulos individuales, lo que permite conservar una cantidad considerablemente mayor de tejido pulmonar vital que en una lobectomía. Esto es especialmente importante para los pacientes con una función pulmonar deteriorada o para posibles resecciones posteriores en caso de un segundo o tercer carcinoma pulmonar primario [7]. Para realizar con éxito una resección de segmento anatómico, es importante que el cirujano conozca las relaciones anatómicas exactas, es decir, el pulmón y su división en diez o nueve segmentos por pulmón (Fig. 2).
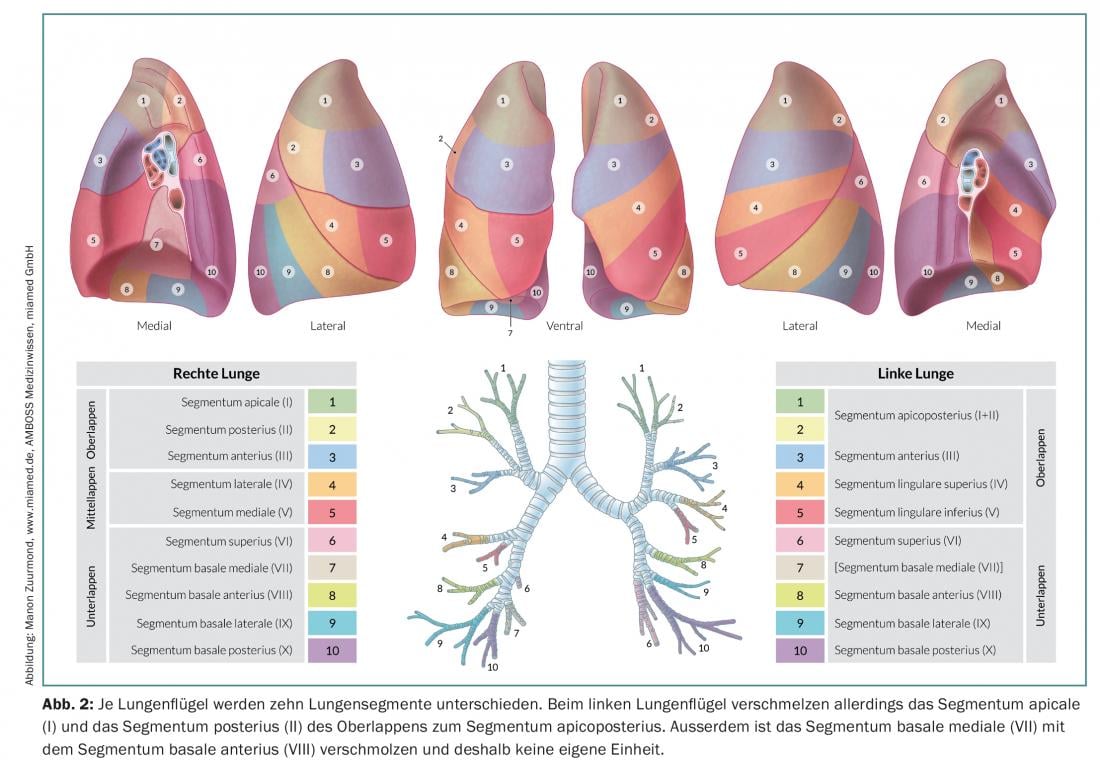
En función de la localización y el tamaño del tumor, se decide entre la segmentectomía o la lobectomía. En cualquier caso, es importante confirmar el estado N0 con una disección minuciosa de los ganglios linfáticos mediastínicos (desde el hilio hasta la rama bronquial segmentaria y subsegmentaria) con análisis de sección congelada. Si los hallazgos intraoperatorios muestran una afectación N1 o N2, la terapia quirúrgica debe cambiarse inmediatamente y debe realizarse una lobectomía completa con linfadenectomía radical. También hay que tener en cuenta la edad y el estado general del paciente. Además, el cirujano debe conocer los factores pronósticos para el tratamiento quirúrgico del CPNM. Según los conocimientos actuales, los siguientes factores son factores pronósticos independientes (ponderados por importancia) [8]:
- Número de estaciones ganglionares afectadas
- Clasificación y diferenciación histológica
- Linfangioinvasión en la histología definitiva
- Número total de ganglios linfáticos afectados
- Respuesta con terapia neoadyuvante
- Sexo y edad del paciente
- Tamaño del tumor.
Si un paciente ha sido sometido a una resección segmentaria y se comprueba en el postoperatorio que existen muchos de los factores de riesgo pronóstico mencionados, es necesario realizar una lobectomía completa en el sentido de una segunda operación y discutir en la junta tumoral una quimioterapia aditiva.
Comparación de lobectomía frente a segmentectomía y linfadenectomía
En el pasado se discutió varias veces si la resección del segmento anatómico podría sustituir a la lobectomía como patrón oro para la terapia de los carcinomas en estadio IA. La mayor ventaja de la segmentectomía anatómica es la posibilidad de resección tumoral preservando la reserva funcional del paciente, lo que también podría desplazar a las opciones no quirúrgicas como tratamiento del cáncer de pulmón en pacientes con baja función pulmonar. Estudios anteriores mostraron peores tasas de supervivencia con la resección sublobar en comparación con la lobectomía [9]. No obstante, debe tenerse en cuenta que las resecciones no anatómicas y anatómicas se agruparon y que la recopilación de datos se llevó a cabo hace 25 años.
Estudios anteriores han demostrado que existe una ventaja de supervivencia asociada a un número creciente de ganglios linfáticos resecados: Ludwig et al. mostraron que el beneficio en la supervivencia alcanzaba su punto máximo a partir de los 13-16 ganglios linfáticos resecados y Gulack et al. encontró resultados similares (once ganglios linfáticos resecados) [10,11].
Un trabajo reciente de Stiles et al. investigó el papel de la linfadenectomía en el CPNM estadio IA y pudo demostrar una ventaja significativa para la supervivencia a largo plazo y la supervivencia libre de recidiva local en pacientes con resección sublobar (segmentectomía o resección en cuña) y linfadenectomía en comparación con la resección sublobar sin linfadenectomía [12].
Así pues, si se opta por la resección sublobar, la linfadenectomía sistemática es crucial para el resultado postoperatorio y la supervivencia a largo plazo.
Radioterapia frente a cirugía
La radioterapia puede considerarse el procedimiento de elección en casos de cáncer de pulmón en estadios I y II en pacientes que no son candidatos a la resección quirúrgica debido a comorbilidades o a una función pulmonar reducida.
La desventaja más importante de la radioterapia es que no se dispone de un diagnóstico histológico previo a la decisión del tratamiento y no se realiza una linfadenectomía de estadificación. Esto puede ser fatal para el futuro de la salud del paciente, ya que el estadio clínico y el patológico son divergentes, como demostró un estudio de casi 3.000 pacientes realizado por López-Encuentra et al. mostró. Allí, la concordancia fue sólo del 47% [5]. Los ganglios linfáticos afectados de forma oculta no se detectan durante la ablación estereotáctica, aunque, como ya se ha mencionado, están presentes en el 11-14% de los casos [6]. Esto da lugar a que se asigne un TNM incorrecto y, finalmente, un estadio clínico incorrecto.
Por otro lado, hoy en día casi todos los estadios iniciales se tratan quirúrgicamente con métodos mínimamente invasivos (con toracoscopia y/o procedimientos asistidos por robot). Siempre se obtiene la histología, se realiza sistemáticamente la resección segmentaria anatómica y la linfadenectomía N1/N2. Además, los diagnósticos rápidos intraoperatorios (tumor primario y ganglios linfáticos) crean la posibilidad de ajustar la estrategia terapéutica óptima en la misma anestesia, si es necesario (ampliación de la resección en caso de afectación de los ganglios linfáticos). Todos los factores relevantes y determinantes para el pronóstico estarán también disponibles para el postoperatorio y la nueva presentación en la junta tumoral, algo de lo que carecen por completo los procedimientos de radioterapia ablativa estereotáctica.
Procedimiento postoperatorio
Si la histología definitiva muestra T1a/b/c N0 M0 o T2a N0 M0 y, en consecuencia, estadio IA o IB, no se recomiendan más terapias adyuvantes. Como seguimiento se prevén exámenes físicos y tomografías computarizadas de “dosis baja” a intervalos de seis meses durante los dos primeros años postoperatorios. A partir de entonces, las inspecciones se realizarán anualmente. A partir del estadio II, las opciones de terapia adyuvante deben discutirse en una junta tumoral interdisciplinar [13].
Terapias adyuvantes
Las terapias basadas en el cisplatino han demostrado ser agentes adyuvantes exitosos en términos de supervivencia a largo plazo en el estadio II en tres ensayos clínicos. Estas ventajas no pudieron demostrarse en las pacientes en estadio I; al contrario, la quimioterapia adyuvante resultó ser bastante perjudicial en este caso [14].
Las terapias sistémicas más recientes, como la terapia dirigida contra el cáncer con anticuerpos monoclonales, no están establecidas actualmente fuera de los ensayos clínicos. En la actualidad, varios ensayos clínicos aleatorizados están evaluando el papel de las terapias dirigidas al EGFR o ALK en el contexto adyuvante para pacientes EGFR- o ALK-positivos. Hasta ahora, existen pruebas de que los pacientes con mutaciones del EGFR tienen un mayor tiempo de supervivencia libre de recaídas con erlotinib. Sin embargo, aún no está claro si esto también aumenta la supervivencia a largo plazo o si sólo prolonga el tiempo hasta que se produce una recaída.
La radioterapia postoperatoria sólo se recomienda en los casos en los que no se haya podido crear una situación R0 quirúrgicamente [15].
Resumen
En el contexto de la detección precoz, en los últimos años se han diagnosticado cada vez más carcinomas de pulmón en una fase temprana. Dependiendo del estadio clínico y del estado general de la paciente, la decisión de tratamiento entre radioterapia y cirugía debe sopesarse detenidamente. La cirugía sigue siendo el tratamiento de elección para los estadios iniciales del CPNM. En este campo, con el aumento de la experiencia y los conocimientos, la resección segmentaria anatómica con linfadenectomía completa es cada vez más importante por su exactitud anatómica y la preservación de la reserva funcional de la paciente. Con la minuciosidad adecuada de la linfadenectomía, es una alternativa equivalente a la lobectomía y una terapia mejor en comparación con la radioterapia.
Mensajes para llevarse a casa
- Los programas de detección precoz están aumentando la incidencia de las primeras fases del cáncer de pulmón. Esto puede reducir significativamente la mortalidad.
- La tasa de supervivencia a 5 años podría aumentar de aproximadamente el 17% actual (todos los estadios del cáncer de pulmón) a más del 50%.
- La cirugía sigue siendo la primera opción para el tratamiento de los estadios iniciales del carcinoma de pulmón, con la experiencia adecuada del cirujano
- Casi tres cuartas partes de todos los procedimientos pueden realizarse con las técnicas mínimamente invasivas más modernas.
- La resección por segmentos anatómicos es ideal para la resección en pacientes con una función pulmonar deteriorada debido a la preservación del tejido pulmonar vital.
- Con una minuciosidad adecuada de la linfadenectomía, la resección del segmento anatómico es una alternativa equivalente a la lobectomía.
- La radioterapia estereotáctica y otros procedimientos ablativos son procedimientos de segunda elección debido a la falta, por lo general, de confirmación diagnóstica patoanatómica.
Literatura:
- Krebsliga: El cáncer en Suiza: cifras importantes. 2016. www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf.
- I-ELCAP: Fundación para el Diagnóstico Pulmonar. %C3%diagnósticos.
- Fundación para el Diagnóstico Pulmonar: Preguntas frecuentes. www.lungendiagnostik.ch/index.php/haufige_fragen.html.
- Vansteenkiste J, et al.: 2ª Conferencia de Consenso de la ESMO sobre cáncer de pulmón: consenso sobre diagnóstico, tratamiento y seguimiento del cáncer de pulmón no microcítico en estadios iniciales. Ann Oncol 2014; 25(8): 1462-1474.
- López-Encuentra A, et al: Comparación entre la estadificación clínica y patológica en 2.994 casos de cáncer de pulmón. Ann Thorac Surg 2005; 79(3): 974-979.
- Stiles BM, et al.: Point: Clinical stage IA non-small cell lung cancer determined by computed tomography and positron emission tomography is frequently not pathologic IA non-small cell lung cancer: the problem of understaging. J Thorac Cardiovasc Surg 2009; 137(1): 13-19.
- Hattori A, et al: Resultados oncológicos de la resección sublobar en pacientes con cáncer de pulmón no microcítico de alto riesgo en estadio clínico IA con aspecto radiológicamente sólido en la tomografía computarizada. Gen Thorac Cardiovasc Surg 2016; 64(1): 18-24.
- Schöb O: Tratamiento quirúrgico del cáncer de pulmón. La estadificación, la operabilidad y los factores pronósticos determinan la indicación. InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(1): 13-17.
- Ginsberg RJ, et al: Ensayo aleatorizado de lobectomía frente a resección limitada para el cáncer de pulmón de células no pequeñas T1 N0. Ann Thorac Surg 1995; 60(3): 615-622.
- Ludwig MS, et al: Supervivencia postoperatoria y número de ganglios linfáticos muestreados durante la resección del cáncer de pulmón de células no pequeñas ganglionar negativo. Chest 2005 Sep; 128(3): 1545-1550.
- Gulack BC, et al: El impacto del tamaño del tumor en la asociación de la extensión de la resección de los ganglios linfáticos y la supervivencia en el cáncer de pulmón no microcítico en estadio clínico I. Cáncer de pulmón 2015; 90(3): 554-560.
- Stiles BM, et al: La importancia de la disección de los ganglios linfáticos que acompaña a la resección en cuña en el cáncer de pulmón en estadio clínico IA†. Eur J Cardiothorac Surg 2017; 51(3): 511-517.
- No hay autores en la lista: Quimioterapia en el cáncer de pulmón no microcítico: un metaanálisis con datos actualizados de pacientes individuales de 52 ensayos clínicos aleatorizados. Grupo de colaboración sobre cáncer de pulmón de células no pequeñas. BMJ 1995; 311(7010): 899-909.
- Pignon JP, et al: Evaluación del cisplatino adyuvante pulmonar: un análisis conjunto del grupo de colaboración LACE. J Clin Oncol 2008; 26(21): 3552-3559.
- Wang EH, et al: La radioterapia postoperatoria se asocia con una mejora de la supervivencia global en el cáncer de pulmón no microcítico en estadios II y III resecado de forma incompleta. J Clin Oncol 2015; 33(25): 2727-2734.
- Thomas KW, Gould MK: Sistema de estadificación de tumores, ganglios y metástasis (TNM) para el cáncer de pulmón no microcítico. UpToDate 2017 Ene 16.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2017; 5(3): 8-12