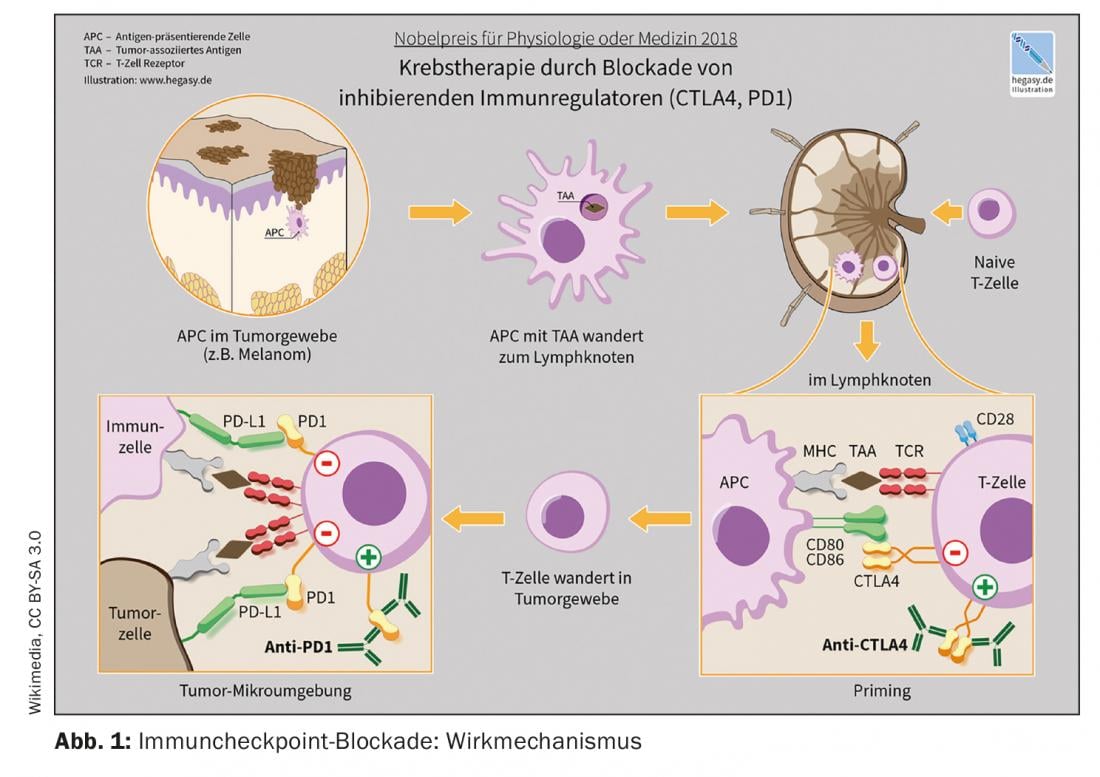
La terapia con anticuerpos anti-PD-1, anti-PDL-1 y anti-CTLA-4 también puede lograr remisiones a largo plazo en pacientes con enfermedades tumorales previamente incurables. La respuesta de un paciente con carcinoma al tratamiento con inhibidores de los puntos de control puede evaluarse mediante ciertos factores predictivos. Dado que la inmunoterapia implica una fuerte activación del sistema inmunológico, pueden producirse efectos secundarios autoinmunes. Para proporcionar la mejor atención posible a los pacientes con carcinoma, es necesaria la cooperación interdisciplinar entre oncólogos y médicos generalistas.
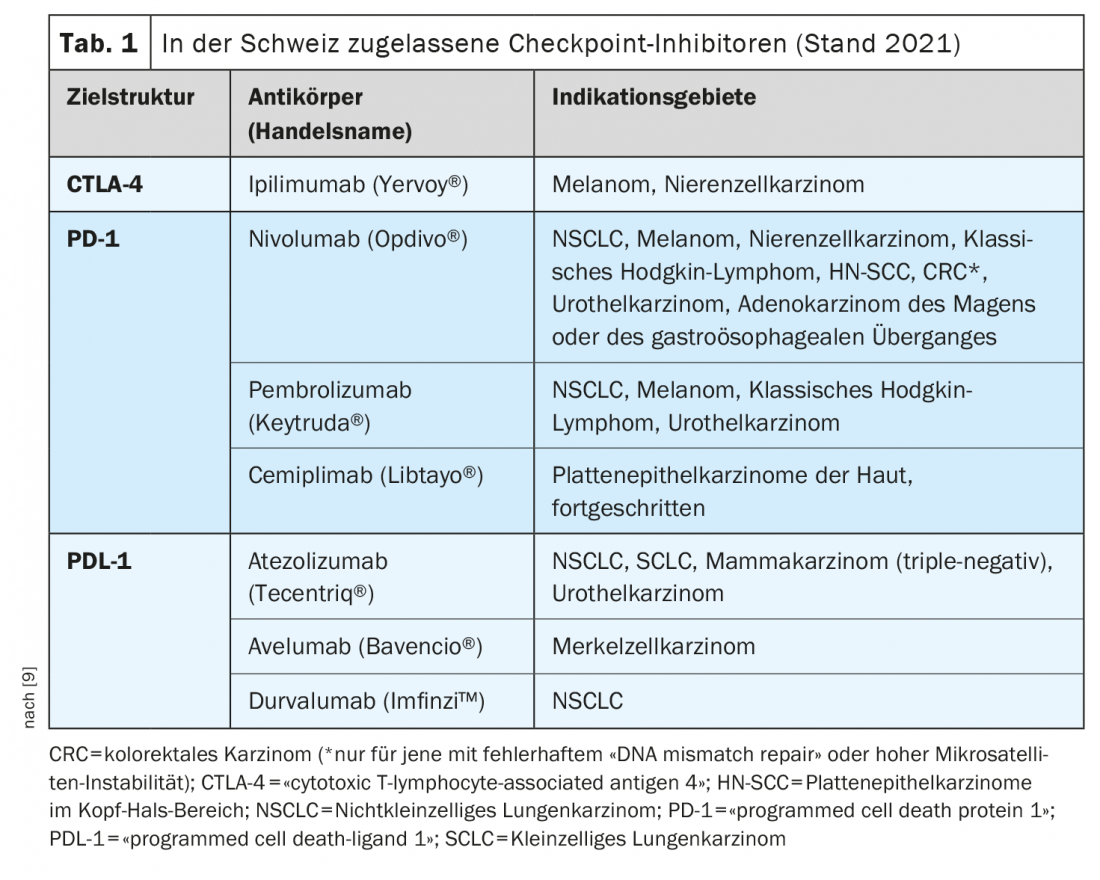
La aprobación en el mercado de los llamados inhibidores de los puntos de control es uno de los avances más rompedores en inmuno-oncología durante los últimos años. Los inhibidores del punto de control activan las células T en la lucha contra las células tumorales. En la actualidad se dispone de varios anticuerpos monoclonales dirigidos contra los puntos de control inmunitarios PD-1 (muerte programada-1), PDL-1 (ligando PD 1) y CTLA-4 (antígeno citotóxico de linfocitos T-4) [1]. Estas opciones de tratamiento se consideran el nuevo estándar para cada vez más entidades tumorales, ya sea solas o en combinación con quimioterapia, explica el doctor Raphaël Delaloye, del Centro de Tumores del Hospital Universitario de Basilea [2]. La inhibición de los puntos de control es una de las estrategias más utilizadas en el campo de la inmunoterapia. Su eficacia se basa en la activación de la defensa tumoral mediante la interrupción de las interacciones inhibitorias entre las células presentadoras de antígenos y los linfocitos T en los llamados puntos de control. “Los inhibidores del punto de control inmunitario pueden restablecer el equilibrio entre las células tumorales y la respuesta inmunitaria”, explica el ponente [2]. Con Ipilumumab (Yervoy®), se aprobó el primer anticuerpo anti-TCLA-4 en 2011, seguido de los anticuerpos anti-PD-1 Nivolumab (Opdivo®) y Pembrolizumab (Keytruda®) en 2015. La combinación de ipilimumab/nivolumab recibió la aprobación de Swissmedic en 2016 para el tratamiento del melanoma [2,3]. Un ejemplo del uso combinado de la inhibición de los puntos de control inmunitarios y la quimioterapia es la combinación de pembrolizumab (anti-PD-1-Ak) más carboplatino y paclitaxel o nab-paclitaxel aprobada en Suiza para el tratamiento de primera línea de adultos con cáncer de pulmón escamoso de células no pequeñas (CPNM) metastásico.
¿Es posible predecir la respuesta a la terapia?
Hay dos factores principales que explican por qué no todos los pacientes muestran la misma respuesta a la terapia con inhibidores de puntos de control inmunitarios. Por un lado, la relevancia de los mecanismos bloqueados para la tolerancia tumoral es decisiva. La determinación de la expresión de PDL-1 en muestras tumorales ha demostrado ser un biomarcador predictivo de la respuesta a los inhibidores de PD-1/PDL-1 [4]. El ponente lo ilustró con el siguiente ejemplo: en el estudio CheckMate 057, se demostró una asociación entre la expresión de PDL-1 y la respuesta clínica al nivolumab en el CPNM como terapia de segunda línea [2,5]. Los pacientes que tenían una fuerte expresión de PDL-1 tenían más probabilidades de responder al tratamiento anti-PDL-1, sin embargo, incluso aquellos con menos del 1% de PDL-1 mostraron una mejor respuesta en comparación con la quimioterapia (docetaxel) [2,5]. El segundo factor importante para la respuesta terapéutica es el “microentorno” del tumor. El microentorno circundante de las células tumorales desempeña un papel importante [2]. En función de la presencia de células inmunitarias activas en el tumor, éste se designa como inflamado (“caliente”) o no inflamado (“frío”) [6]. Las firmas de genes inflamatorios se asocian a una mejor respuesta a las inmunoterapias.

Gestión de los efectos secundarios: ¿Qué debe tenerse en cuenta?
Los inhibidores de los puntos de control inmunitarios pueden utilizarse solos, combinados con otra inmunoterapia (por ejemplo, en el melanoma) o en combinación con quimioterapia (por ejemplo, en el CPNM). El intervalo de dosis de la inhibición del punto de control administrada como infusión intravenosa suele ser de dos o tres semanas. “Por regla general, esta infusión no requiere premedicación, a diferencia de la quimioterapia”, explica el Dr. Delaloye [2]. No suele haber toxicidad aguda como náuseas o reacciones alérgicas, los efectos secundarios suelen aparecer con la inmunoterapia sólo después de un cierto retraso. La fuerte activación del sistema inmunitario relacionada con la terapia va acompañada del peligro de que las células inmunitarias destruyan también el propio tejido sano del organismo, por lo que, en principio, todos los órganos pueden ser atacados. En algunos casos, estos efectos secundarios pueden poner en peligro su vida. La detección precoz es crucial, y los médicos de cabecera desempeñan un papel muy importante, subraya la Dra. Delaloye [2]. Los efectos secundarios más frecuentes se producen entre 6 y 8 semanas después del inicio de la inmunoterapia. Por lo tanto, los pacientes en inmunoterapia siempre deben ser considerados por un efecto secundario inmunomediado si aparecen nuevos síntomas. Las más comunes son exantema, diarrea, colitis o gastritis. Más raramente, pueden producirse enfermedades tiroideas, insuficiencia renal, hepatitis o neumonitis. El conferenciante recomienda ponerse en contacto con los especialistas oncológicos tratantes en caso de sospecha correspondiente y muestra con ayuda de casos prácticos cómo puede ser una gestión exitosa de los efectos secundarios inmunomediados (recuadro) [2].

La inmunoterapia del cáncer quo vadis – sigue siendo apasionante
Además de los inhibidores de los puntos de control, las terapias con células T se encuentran entre las innovaciones más prometedoras en el campo de la inmuno-oncología. Los pacientes con enfermedades tumorales avanzadas, en particular, pueden beneficiarse de ello. La terapia génica TCR (receptor de células T) consiste en trasplantar un receptor de células T específico de la mutación en células T frescas obtenidas de la sangre del paciente. Las células T modificadas genéticamente de este modo no están restringidas funcionalmente y pueden entonces, de vuelta en el cuerpo de la persona enferma, luchar contra el cáncer [8]. La terapia con células T CAR (receptor de antígeno quimérico) se basa en células T modificadas genéticamente con receptores sintéticos específicos de antígeno. El tisagenlecleucel es un compuesto del grupo de las células CAR-T, que fue aprobado en 2018 [7].
Otro tema importante de la inmuno-oncología es la investigación de vacunas contra el cáncer [7]. Se basan en un principio similar al de los inhibidores de los puntos de control, pero deberían conllevar un menor riesgo de efectos secundarios tóxicos. En el caso de los pacientes cuyos tumores no presentan neoantígenos, los científicos pueden recurrir a una amplia selección de epítopos de antígenos germinales, en gran medida específicos del tumor, para el desarrollo de vacunas [7]. La investigación también se centra en el desarrollo ulterior de nuevas plataformas tecnológicas que generen perfiles de biomarcadores altamente complejos basados en análisis microscópicos, genéticos, moleculares y experimentales con el fin de predecir mejor el éxito de las intervenciones terapéuticas [7].
Congreso: Foro de Educación Médica Continua
Literatura:
- Kähler KC, et al: para el Comité de Efectos Secundarios Cutáneos del Grupo de Trabajo de Oncología Dermatológica: JDDG 2020; 18(6): 582-609.
- Delaloye R: Inmunoterapia y terapias dirigidas en oncología. Raphaël Delaloye, MD, Foro para la Educación Médica Continua 27.01.2022
- Información sobre medicamentos, www.swissmedicinfo.ch (última consulta: 30.03.2022)
- Prelaj A, et al: Eur J Cancer 2019; 106: 144-159.
- Horn L, et al: J Clin Oncol 2017; 35: JCO2017743062-33.
- Hegde PS, Karanikas V, Evers S: Clin Cancer Res 2016; 22(8): 1865-1874.
- Consorcio alemán para la investigación translacional del cáncer, https://dktk.dkfz.de (última consulta: 30.03.2022)
- Centro Max Delbrück de Medicina Molecular, www.mdc-berlin.de/de/news (última consulta: 30.03.2022)
- Riggenbach E, et al.: Swiss Med Forum 2021; 21(0506): 78-82.
PRÁCTICA GP 2022; 17(4): 38-39