La enfermedad renal crónica (ERC) se clasifica según el tipo de enfermedad subyacente, la tasa de filtración y el grado de proteinuria. Los pacientes con ERC son pacientes de riesgo cardiovascular. La morbilidad cardiovascular aumenta con el incremento de la proteinuria y con la disminución de la tasa de filtración. La base terapéutica para frenar la progresión de la insuficiencia renal sigue siendo la terapia antiproteinúrica mediante la inhibición del SRA. Con respecto a la hipertensión arterial y renovascular: Un control demasiado intensivo de la presión arterial tiende a ser desaconsejable. La hipertensión renovascular es la causa más común de hipertensión secundaria en pacientes mayores de 50 años con hipertensión resistente y se asocia a una mayor mortalidad cardiovascular y a una pérdida más rápida de la función renal. La denervación renal no debe utilizarse como método estándar para tratar a pacientes con hipertensión “refractaria”.
La primera parte de este artículo se centra en la insuficiencia renal crónica. ¿Cuál es la evolución del diagnóstico y qué puede decirse del riesgo de progresión?
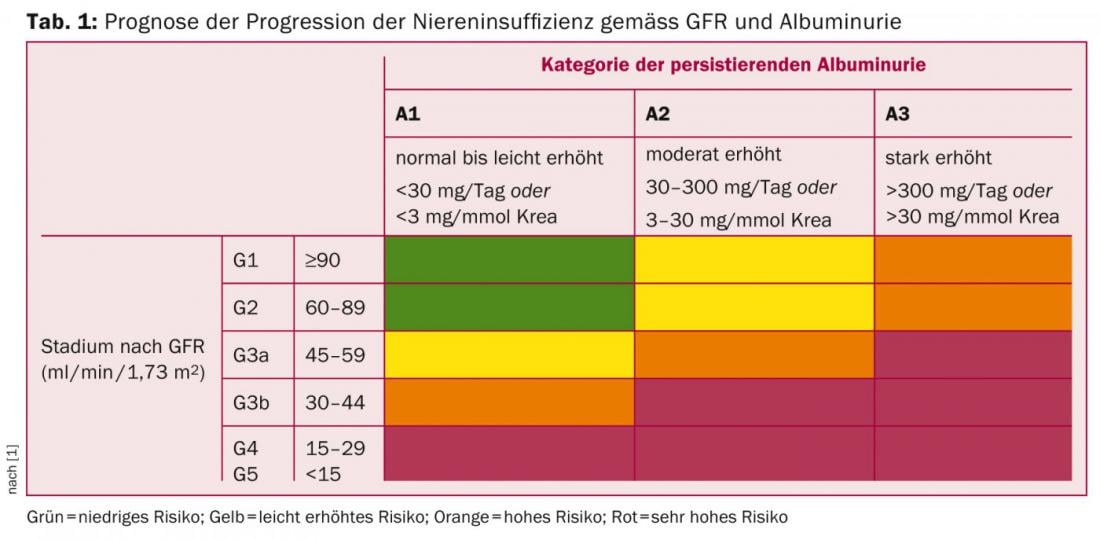
La enfermedad renal crónica (ERC) se define por una tasa de filtración (eGFR) ≤60 ml/min/1,73 m2 o por signos de daño renal (en orina, suero o por imagen) durante tres meses, según las directrices KDIGO de 2012 [1]. La clasificación de la ERC debe orientarse según el tipo de enfermedad subyacente, la tasa de filtración y el grado de proteinuria [1], ya que estos parámetros no sólo son relevantes para la progresión (Tab. 1), sino también para estimar la morbilidad y la mortalidad cardiovasculares.
La estimación de la TFGe debe realizarse en el día a día mediante la fórmula 2009-CKD-EPI [1]. La cistatina C junto con la creatinina sérica para la determinación de la eGFR (fórmula creatinina-cistatina C 2012-CKD-EPI) debe utilizarse en situaciones especiales [2]. Esto es especialmente cierto cuando la creatinina sérica no se correlaciona con la TFGe (por ejemplo, pérdida muscular, cirrosis hepática, embarazo, uso de trimetoprina) y cuando no hay ninguna otra evidencia de enfermedad renal excepto una TFG disminuida estimada por la creatinina sérica [1]. Ambas fórmulas están disponibles en internet en www.mdrd.com.
La presencia de microalbuminuria es un factor de riesgo cardiovascular no relacionado [3], aunque no siempre se asocia a la progresión de la enfermedad renal, ya que la microalbuminuria también puede ser regresiva en el curso de la enfermedad [4]. La disminución de la tasa de filtración en pacientes ancianos hasta la ERC 3a (TFGe 45 ml/min/1,73 m2) puede considerarse un proceso normal de envejecimiento si la TFGe es estable y no hay proteinuria [1].
Complicaciones cardiovasculares (prevención)
Los pacientes con ERC son pacientes de riesgo cardiovascular. La morbilidad cardiovascular aumenta con el incremento de la proteinuria y con la disminución de la tasa de filtración. El efecto parece ser aditivo [5]. Los factores de riesgo pueden dividirse en tradicionales (edad, colesterol LDL, hipertensión, sexo, etc.) y no tradicionales (albuminuria, anemia, carga de volumen, trastorno del equilibrio mineral-óseo). Las nuevas directrices KDIGO recomiendan una reducción moderada del colesterol LDL con una dosis fija de una estatina tras una única medición del colesterol en pacientes mayores de 50 años que no requieran diálisis, sin más controles del perfil lipídico según la estrategia “disparar y olvidar” [6]. En pacientes menores de 50 años, no se recomienda el tratamiento farmacológico hasta que no se haya detectado enfermedad coronaria, diabetes mellitus, ictus o un riesgo calculado a diez años de acontecimientos coronarios >10%. En este caso, se aplican los valores objetivo de la enfermedad subyacente [6].
Ralentización de la progresión de la insuficiencia renal
El tratamiento antiproteinúrico mediante la inhibición del sistema renina-angiotensina-aldosterona (SRA) sigue siendo la piedra angular para frenar la progresión de la insuficiencia renal. Dado que se dispone de más de una clase de compuestos para inhibir el SRA, se está investigando hasta qué punto el bloqueo dual del SRA tiene beneficios en términos de mortalidad cardiovascular y progresión a insuficiencia renal.
El ensayo ONTARGET es el mayor estudio realizado hasta la fecha que ha investigado la combinación de un inhibidor de la ECA con un sartán frente al tratamiento con un inhibidor de la ECA o un sartán solos en pacientes de alto riesgo. La terapia combinada no mostró ningún beneficio en la mortalidad cardiovascular. En cuanto a los criterios de valoración renales, la terapia combinada mostró incluso un peor resultado [7]. Una desventaja importante de ONTARGET fue que sólo se incluyeron unos pocos pacientes con proteinuria. El estudio ALTITUDE [8] (combinación del inhibidor de la renina aliskiren con IECA o ARA) y, más recientemente, el estudio NEPHRON-D [9] (combinación de losartán con lisinopril frente a losartán solo) en pacientes con diabetes de tipo 2 y proteinuria mostraron que los efectos secundarios graves (hiperpotasemia, insuficiencia renal aguda) se producían con mayor frecuencia con la terapia combinada, por lo que los estudios se dieron por terminados prematuramente. El doble bloqueo del SRA ya no se recomienda en pacientes con diabetes y proteinuria. Sigue sin estar claro si los pacientes con nefropatía proteinúrica debida a glomerulonefritis se benefician del doble bloqueo del SRA.
Equilibrio calcio-fosfato y alteración del equilibrio mineral-hueso
La fisiopatología de los desequilibrios minerales y óseos se percibe clásicamente como el desarrollo de un hiperparatiroidismo secundario debido a la deficiencia progresiva de calcitriol y a la retención de fosfato. Los nuevos descubrimientos sobre el sistema FGF-23/Klotho han cambiado esta percepción.
Incluso en las primeras fases, se produce un aumento del FGF-23, que inhibe simultáneamente la síntesis de calcitriol y de hormona paratiroidea [10]. Es posible que en las primeras fases de la insuficiencia renal, el FGF-23 regule un balance positivo de fosfato que es invisible en el suero. Al mismo tiempo, el FGF-23 sirve para mantener estable el equilibrio del calcio. Con la pérdida adicional de potencia renal, el efecto del correceptor Klotho del FGF-23 disminuye. La hormona paratiroidea y el FGF-23 aumentan entonces en paralelo. Sin embargo, la fisiopatología exacta sigue sin estar clara.
Según las directrices KDIGO, debe aspirarse a valores normales de fosfato y hormona paratiroidea en suero en pacientes que no requieran diálisis [11]. Recientemente se ha cuestionado el uso de captores de fosfato en pacientes sin diálisis con insuficiencia renal avanzada [12,13]. Basándose en la información anterior, la atención en la práctica clínica debería centrarse en reducir la ingesta de fosfato lo antes posible – la importancia del asesoramiento nutricional con el objetivo de reducir el fosfato es cada vez mayor [1]. Sin embargo, hay que evitar conseguir la reducción de fosfatos mediante la restricción de proteínas y la malnutrición [1]. En caso de deficiencia de vitamina D (25[OH]vitamina D <50 nmol/l), que suele presentarse en pacientes con ERC [14], se recomienda la sustitución.
Hipertensión arterial y renovascular
La segunda parte de este artículo trata sobre la hipertensión arterial y renovascular: ¿Cuáles son los objetivos actuales de presión arterial? ¿Y qué novedades hay en este ámbito?
Las directrices para el tratamiento de la hipertensión arterial han cambiado en los últimos años. En 2012, se publicaron las directrices KDIGO, que abordan específicamente el control de la presión arterial en pacientes sin diálisis con insuficiencia renal crónica. Se han elevado los valores objetivo de presión arterial para los pacientes sin albuminuria (<30 mg/día) con presión arterial objetivo <140/90 mmHg. Sin embargo, para los pacientes con albuminuria, los objetivos agresivos se mantienen sin pruebas contundentes [15].
En 2013, se actualizaron las directrices ESH/ESC (Tab. 2 y 3), recomendando la reducción de la presión arterial sistólica a <140 mmHg en todos los pacientes con alto riesgo cardiovascular, incluidos aquellos con proteinuria manifiesta (con y sin diabetes) [16].

La presión arterial diastólica durante la terapia debe ser inferior a 90 mmHg. Sólo en pacientes con diabetes se recomienda una reducción adicional a 85 mmHg [16]. La tendencia actual es desaconsejar una reducción demasiado intensa de la presión arterial. Esto se debe en particular a los estudios realizados en diabéticos de tipo 2 con alto riesgo cardiovascular, que presentaron una mayor mortalidad cardiovascular como resultado de un control intensivo de la presión arterial [17,18].

Hipertensión renovascular
La hipertensión renovascular es la causa más común de hipertensión secundaria en pacientes mayores de 50 años con hipertensión resistente (hasta un 45%). La prevalencia de la hipertensión renovascular es del 1-5% de los pacientes con hipertensión [19] y se asocia a una mayor mortalidad cardiovascular y a una pérdida más rápida de la función renal. Los grandes ensayos aleatorizados (STAR y ASTRAL) no lograron demostrar un beneficio terapéutico de la colocación de endoprótesis en la arteria renal [20,21]. Estos resultados han sido confirmados ahora por el estudio CORAL, el mayor ensayo aleatorizado realizado en este campo hasta la fecha [22]. En el análisis de subgrupos de pacientes con estenosis de mayor grado (>80%), función renal deteriorada (eGFR <45 ml/min/1,73 m2), diabetes mellitus, estenosis bilateral o presión arterial elevada basal (>160 mmHg), la implantación de endoprótesis tampoco mostró beneficios. CORAL fue el primer ensayo en el que muchos pacientes tratados en el brazo conservador recibieron una combinación de aspirina, inhibidores de la ECA o ARA-II y estatinas. Una crítica al estudio CORAL es que la relevancia hemodinámica de la estenosis sólo se determinó mediante angiografía y no se confirmó con la medición de la presión intraarterial. Además, no se había realizado ninguna medición sonográfica dúplex del índice de resistencia, lo que podría indicar la relevancia de la estenosis como causa de la hipertensión [23]. La decisión de implantar un stent en casos de estenosis de la arteria renal de relevancia hemodinámica demostrada sólo debe tomarse tras una evaluación ecográfica dúplex y clínica exhaustiva por parte de angiólogos y nefrólogos.
Hipertensión resistente
Calhoun et al. abordó el problema de la hipertensión refractaria en un gran colectivo (estudio REGARDS). Tras la modificación de la terapia, la exclusión de causas secundarias y el control de la adherencia del paciente, sólo el 0,5% presentaba hipertensión refractaria [24]. La denervación renal ha sido objeto de gran debate en los últimos años, tras los resultados positivos de los estudios Simplicity 1 [25] y Simplicity 2 [26]. El estudio de Fadl et al. (un estudio pequeño que requería una adherencia asegurada a la medicación) cuestionó la eficacia de la denervación renal [27]. Por ello, se esperaban con impaciencia los resultados del ensayo Simplicity-3 (ensayo aprobado por la FDA) (denervación frente a punción arterial simulada e inserción de un catéter sin denervación). El estudio no mostró ninguna ventaja significativa de la intervención sobre el tratamiento simulado [28]. Así pues, la denervación renal no debe utilizarse como método estándar para el tratamiento de pacientes con hipertensión “resistente a la terapia” en la actualidad.
Prof. Dr. med. Michael Dickenmann
Literatura:
- Guía de práctica clínica KDIGO 2012 para la evaluación y el tratamiento de la enfermedad renal crónica. Kidn Int Suppl 2013 3(1).
- Shlipak MG, et al: N Engl J Med 2013 Sep 5; 369(10): 932-943.
- Go AS, et al: N Engl J Med 2004 Sep 23; 351(13): 1296-1305.
- Glassock RJ, Winearls C: Curr Opin Nephrol Hypertens 2010 Mar; 19(2): 123-128.
- Matsushita K, et al. (Consorcio para el pronóstico de la enfermedad renal crónica): Lancet 2010 Jun 12; 375(9731): 2073-2081.
- Guía de práctica clínica KDIGO para el tratamiento de los lípidos en la ERC: resumen de las declaraciones de recomendación y enfoque clínico del paciente. Kidney Int 2014 Feb 19. doi: 10.1038/ki.2014.31.
- Mann JF, et al: Lancet 2008 Ago 16; 372(9638): 547-553.
- Parving HH, et al: N Engl J Med 2012; 367: 2204-2213.
- Fried LF, et al: N Engl J Med 2013; 369: 1892-1903.
- Isakova T, et al: Kidney Int 2011 jun; 79(12): 1370-1378.
- Guía de Práctica Clínica KDIGO para el Diagnóstico, Evaluación, Prevención y Tratamiento de la Enfermedad Renal Crónica-Trastorno Mineral y Óseo (CKD-MBD). Kidney Int Suppl 2009 ago; 113: 1-130.
- Hill KM, et al: Kidney Int 2013 mayo; 83(5): 959-966.
- Block GA, et al: J Am Soc Nephrol 2012 Ago; 23(8): 1407-1415.
- LaClair RE, et al: Am J Kidney Dis 2005; 45: 1026-1033.
- Guía de práctica clínica KDIGO para el manejo de la presión arterial en la enfermedad renal crónica. Kidney International Supplements 2012; 2.
- Mancia G, et al: Journal of Hypertension 2013, 31: 1281-1357.
- Cooper-DeHoff RM, et al: JAMA 2010 Jul 7; 304(1): 61-68.
- Cushman WC, et al: N Engl J Med 2010 abr 29; 362(17): 1575-1585.
- Dworkin LD, Cooper CJ: N Engl J Med 2009 Nov 12; 361(20): 1972-1978.
- Wheatley K, et al. (Investigadores de ASTRAL): N Engl J Med 2009; 361: 1953-1962.
- Bax L, et al: J Nephrol 2003; 16: 807-812.
- Cooper CJ, et al: N Engl J Med 2014; 370: 13-22.
- Radermacher J, et al: N Engl J Med 2001 344: 410-417.
- Calhoun DA, et al: Hypertension 2014 Mar; 63(3): 451-458.
- Investigadores de Symplicity HTN-1: Hipertensión 2011 mayo; 57(5): 911-917.
- Esler MD, et al: Circulation 2012 Dic 18; 126(25): 2976-2982.
- Fadl Elmula FE, et al: Hipertensión 2014 mayo; 63(5): 991-999.
- Bhatt DL, et al. (Investigadores de SYMPLICITY HTN-3): N Engl J Med 2014 Abr 10; 370(15): 1393-1401.
CARDIOVASC 2014; 13(4): 16-20