Con un tiempo soleado de principios de primavera, fue difícil permanecer en las salas de conferencias sin luz del 25º Curso de Formación Continuada para Médicos en Oncología Clínica de San Gall, pero mereció la pena. PD Dr. med. Markus Jörger, Oncología y Hematología, St. Gallen, ofreció en su conferencia una amplia información sobre las interacciones de los medicamentos en las terapias oncológicas.
La definición de interacciones adversas entre medicamentos (IAM) es la siguiente: “Un cambio medible en el efecto específico de un fármaco (en magnitud o duración) debido a la administración previa o concurrente de otro fármaco”. En la práctica, sin embargo, el IAM puede estar causado no sólo por medicamentos, sino también por alimentos, sustancias vegetales, sustancias nocivas como el alcohol y el tabaco, y otras sustancias químicas. El riesgo de IAM aumenta con el número de fármacos administrados, el uso de fármacos con un estrecho margen terapéutico, el deterioro creciente de las funciones orgánicas (hígado, riñón) y las comorbilidades. Además, las personas con sensibilidades especiales (sobrepeso, caquexia, edad avanzada) se ven más afectadas por el IAM.
Farmacéutica, cinética y dinámica
Básicamente, el AMI puede dividirse en tres formas:
- Las interacciones farmacéuticas se deben a las propiedades químicas de los principios activos. Por ejemplo, la dependencia del pH de la absorción gástrica de un fármaco es clínicamente significativa.
- En las interacciones farmacocinéticas, un fármaco afecta a la absorción, distribución, metabolismo o eliminación (ADME) de otro fármaco. Los cambios en las concentraciones plasmáticas repercuten en la actividad o toxicidad de otro principio activo, por lo que puede ser necesario reducir o aumentar la dosis. Las enzimas CYP-P450 hepáticas y la eliminación renal de los fármacos son importantes.
- En las interacciones farmacodinámicas, un fármaco altera la eficacia de un segundo fármaco sin disminuir ni aumentar la concentración plasmática. Estas interacciones también pueden utilizarse terapéuticamente: Ejemplos típicos son la combinación de diferentes antihipertensivos, la administración de antagonistas en casos de intoxicación o la combinación de citostáticos en oncología.
Precaución con los alimentos
Los IAM se producen con frecuencia: Según las estimaciones, el 7% de todas las reacciones adversas a los medicamentos (RAM) en pacientes hospitalizados y el 30% de todas las RAM mortales se deben a un IAM. Cuantos más medicamentos tome un paciente, mayor será el riesgo.
Básicamente, la mayoría de los IAM son evitables si se es consciente del riesgo y de las situaciones especiales de riesgo (Tab. 1). Los fármacos de alto riesgo incluyen no sólo los grupos de sustancias bien conocidos (medicamentos oncológicos, AINE, anticoagulantes, etc.), sino también preparados a base de plantas como la equinácea y la hierba de San Juan. Este último es un fuerte inductor del CYP, por lo que puede reducir la eficacia de otros medicamentos. Los dos efectos más significativos de la hierba de San Juan son sobre los efectos de la ciclosporina (crisis de rechazo de trasplantes de órganos) y los anticonceptivos (hemorragias intermitentes y embarazos no deseados). La soja contiene flavonoides con efectos proestrogénicos, por lo que las pacientes con cáncer de mama y en tratamiento con tamoxifeno deben tener precaución al tomar productos de soja.
Especialmente con los fármacos oncológicos orales, las interacciones entre fármacos y alimentos también pueden desempeñar un papel importante. Una comida rica en grasas aumenta la absorción de los inhibidores de la tirosina quinasa (ITK) y, por tanto, el riesgo de efectos secundarios. Por lo tanto, se recomienda ayunar para la mayoría de los TKI, aunque hay excepciones como el imatinib o el dasatinib. “Para evitar el IAM en la medida de lo posible, hay que informar a los pacientes de cuándo deben tomar la medicación”, subraya el Dr. Jörger. “En St. Gallen, las enfermeras, que también distribuyen la medicación, disponen de las fichas correspondientes para poder transmitir la información con todo detalle a los pacientes. Los zumos de frutas (zumo de manzana, de pomelo, de naranja, etc.) también pueden ser problemáticos: Ralentizan la excreción y aumentan así el riesgo de IAM y de complicaciones como la prolongación del QT, las arritmias o la mielosupresión.
En la segunda parte de su presentación, el Dr. Jörger expuso varios casos de IAM.

Capezitabina y Marcoumar
Una paciente de 66 años con carcinoma de mama metastásico recibía Marcoumar desde enero de 2007 debido a embolias pulmonares bilaterales. Desde enero de 2008, la paciente fue tratada con capezitabina (Xeloda®). En noviembre, la paciente desarrolló un hematoma subdural crónico. La razón se encontró rápidamente: La capezitabina es un fuerte inhibidor del CYP2C9 y, por tanto, impide la degradación del Marcoumar. El Dr. Jörger señaló que las pacientes en tratamiento con Xeloda® deben cambiar el Marcoumar por una heparina de bajo peso molecular (HBPM) para evitar complicaciones hemorrágicas.
Erlotinib y simvastatina
Una paciente de 75 años con adenocarcinoma de pulmón fue tratada con erlotinib (Tarceva®) como terapia de segunda línea. Al cabo de seis semanas, ingresó de urgencia en el hospital con dolores musculares y astenia, y se le diagnosticó rabodmiólisis aguda. Debido a comorbilidades, la paciente llevaba años tomando aspirina, atenolol, amlodipino y simvastatina sin complicaciones. La inhibición del CYP3A4 por el erlotinib había aumentado la concentración plasmática de simvastatina, provocando rabdomiólisis. La interrupción de la simvastatina tras la fase de recuperación permitió continuar sin problemas el tratamiento con erlotinib.
El EGFR TKI oral erlotinib interactúa con toda una serie de sustancias. Debido a la inducción del CYP3A4, existe un riesgo de eficacia reducida cuando se combina con agentes como la fenitoína, la hierba de San Juan, la dexametasona, etc. Este problema también existe en los fumadores, que tienen niveles plasmáticos significativamente más bajos que los no fumadores a la dosis estándar de 150 mg/día. Por otro lado, existe el riesgo de que aumente la toxicidad con la combinación de erlotinib y azoles, zumo de pomelo, macrólidos, antagonistas del Ca, nelfinavir, etc. La toma simultánea de erlotinib e inhibidores de la bomba de protones (IBP) debe evitarse si es posible, o la toma debe programarse por separado (erlotinib por la mañana, IBP por la noche).
Sunitinib y carbamazepina
En una paciente de 76 años con carcinoma metastásico de células renales que recibía tratamiento con carbamazepina y fenitonina, se estaba debatiendo la terapia con sunitinib (Sutent®). El sunitinib es un sustrato del CYP3A4, la carbamazepina y la fenitoína son fuertes inductores del CYP3A4. En esta situación, se recomienda el cambio a un fármaco antiepiléptico no inductor enzimático (no AEINE) por parte del neurólogo (Tab. 2) . Si la combinación de sunitinib y un EIAED es inevitable, debe considerarse al menos un aumento gradual de la dosis de sunitinib, si se tolera bien, para evitar la pérdida de eficacia.
Capecitabina y diclofenaco
Una paciente de 62 años con cáncer de recto recibió quimioterapia adyuvante con capecitabina (Xeloda®). Al cabo de cinco meses, fue ingresado de urgencia con fiebre neutrogénica, diarrea, erupción cutánea y eritema en las palmas de las manos y las plantas de los pies. Se diagnosticó síndrome mano-pie y disfunción renal subaguda. La paciente había tomado altas dosis de diclofenaco a causa de una lumbalgia aguda.
IAM con metotrexato
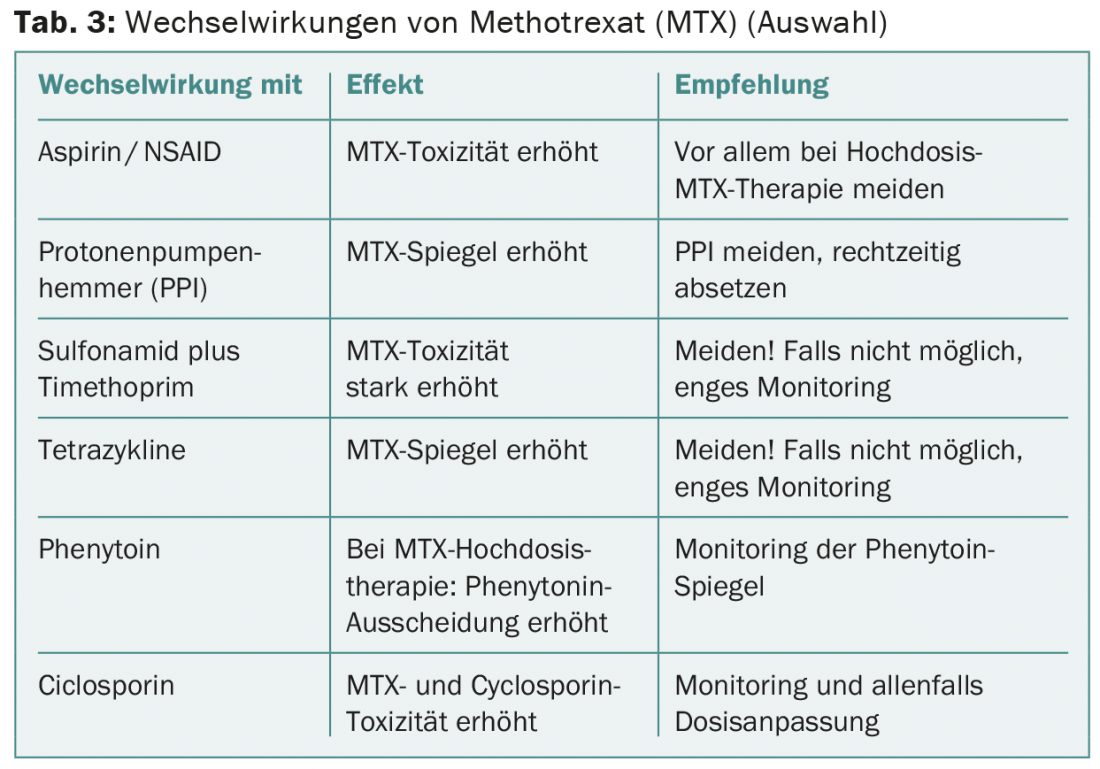
El metotrexato (MTX) interactúa con muchos otros medicamentos (tab. 3) . Una paciente de 65 años con carcinoma laríngeo fue tratada con MTX 60 mg i.v. tras una recidiva local. Una semana más tarde, sufrió una estomatitis grave, exantema ulceroso y neutropenia grave. Además, se produjo una neumonía, de la que finalmente murió la paciente. Había estado tomando mefenazida de forma intermitente, lo que en este caso probablemente había provocado una disfunción renal subaguda y retrasado gravemente la eliminación renal del MTX.
IAM con imatinib
Una paciente de 75 años con leucemia mieloide crónica (LMC) inició un tratamiento con imatinib (Gleevec®). Un año después, fue ingresado de urgencia con dolor abdominal superior, ictericia y enzimas hepáticas gravemente elevadas. Se hizo un diagnóstico de hepatitis lobular subaguda, muy probablemente tóxico-medicinal. Dos meses antes, la paciente había empezado a tomar un preparado de ginseng. Sin embargo, el ginseng es un inhibidor del sistema CYP3A4 y también inhibe la degradación del imatinib, lo que había provocado un aumento de los niveles plasmáticos de imatinib y una toxicidad grave en esta paciente. Tras la interrupción de la medicación, las enzimas hepáticas se normalizaron en tres semanas y el imatinib pudo reintroducirse sin problemas.
La combinación de imatinib y simvastatina también es problemática. Por lo tanto, antes de iniciar la terapia con imatinib, se recomienda cambiar la simvastatina por la pravastatina.
Además, debe tenerse precaución cuando se administran simultáneamente paracetamol e imatinib, ya que también puede producirse toxicidad hepática con esta combinación. La dosis diaria máxima correspondiente de paracetamol es de unos 1300 mg y no debe superarse si es posible.
Conclusión para la práctica
- Los IAM son frecuentes y clínicamente significativos.
- Muchos IAM pueden evitarse.
- Evite la polifarmacia en la medida de lo posible: Examine detenidamente la lista de medicamentos y valore si se puede omitir o cambiar algo.
- Es importante conocer los medicamentos y suplementos específicos de la comedia.
- Apoyo al cumplimiento de la medicación.
- Pida a los pacientes que le digan si están tomando productos adicionales (medicamentos de venta libre, remedios a base de hierbas o alternativos).
Fuente: 25º Curso de formación continua para médicos Oncología clínica, St. Gallen, 19-21 de febrero de 2015
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(3-4), 30-32