En el pasado, el dolor neuropático se clasificaba en función de la etiología subyacente. Sin embargo, dada la heterogeneidad de los mecanismos del dolor, otros esquemas de clasificación pueden ser más apropiados. En este caso, el perfil somatosensorial individual puede proporcionar algunas pistas sobre los trastornos fisiopatológicos del procesamiento aferente. Además, los síntomas notificados por los pacientes también pueden describir cualidades sensoriales.
Los pacientes con dolor neuropático son heterogéneos en cuanto a etiología, fisiopatología y presentación clínica. Muestran una variedad de síntomas y signos sensoriales relacionados con el dolor, lo que se conoce como perfil sensorial. Diferentes perfiles sensoriales pueden indicar diferentes clases de mecanismos neurobiológicos, de modo que los subgrupos con diferentes perfiles sensoriales pueden responder de forma diferente al tratamiento.
Principio de ordenación basado en perfiles sensoriales
Utilizando métodos estadísticos libres de hipótesis en la base de datos de tres redes de investigación multinacionales (Red alemana de investigación del dolor neuropático (DFNS), IMI-Europain y Neuropain), un estudio investigó la identificación de subgrupos en una amplia muestra de pacientes con dolor neuropático. Se realizaron pruebas sensoriales cuantitativas estandarizadas en 902 (cohorte de prueba) y 233 (cohorte de validación) pacientes con dolor neuropático periférico de diferente etiología. Para formar subgrupos, se realizó un análisis de conglomerados utilizando 13 parámetros cuantitativos de pruebas sensoriales. Se identificaron y reprodujeron tres subgrupos diferentes con perfiles sensoriales característicos [2].
El grupo 1 (pérdida sensorial, 42%) se caracterizó por la pérdida de la función de las fibras pequeñas y grandes y la presencia de una sensación paradójica de calor (PHS). Estos pacientes no sufrieron realce sensorial, salvo una leve alodinia mecánica dinámica (AMD) en unos pocos pacientes. Alrededor del 52% de los pacientes con polineuropatías pertenecían a esta categoría, lo que indica una degeneración atenuada de casi todas las clases de fibras. Curiosamente, el 43% de los pacientes con radiculopatía dolorosa (RAD) presentaban este patrón sensorial, lo que indica una degeneración grave de las fibras sensoriales dentro de la raíz nerviosa afectada. Las sensaciones paradójicas de calor fueron las más comunes, lo que sugiere que se desencadenan por una pérdida de entrada aferente, aunque ostensiblemente es un signo sensorial positivo, posiblemente relacionado con un proceso de desinhibición central. El perfil sensorial es similar al de un bloqueo nervioso por compresión. Probablemente representa los subgrupos de “deafferentación” o “hipoestesia dolorosa” descritos por otros. El dolor espontáneo se debe probablemente a potenciales de acción ectópicos generados en sitios proximales de los nociceptores lesionados, por ejemplo en el ganglio de la raíz dorsal o en neuronas nociceptivas centrales deferentes [2].
El grupo 2 se caracterizaba por funciones sensoriales relativamente preservadas de fibras grandes y pequeñas en combinación con hiperalgesia al calor y al frío y AMD de baja intensidad. Este patrón (hiperalgesia térmica) se produjo en el 33% de todos los pacientes con dolor neuropático periférico, independientemente de la etiología. El hecho de que la función sensorial cutánea estuviera relativamente bien conservada en un tercio de todos los pacientes a pesar del daño nervioso documentado sugiere que el dolor neuropático periférico puede estar asociado a una regeneración cutánea eficaz y a nociceptores sensibilizados. El perfil sensorial se asemeja al de una lesión por quemadura UV-B y probablemente se deba a una sensibilización periférica. Representa los subgrupos de “nociceptores irritables” descritos por otros. Los nociceptores sensibilizados se asocian a una sobreexpresión de canales y receptores que conducen a descargas espontáneas patológicas y a una disminución del umbral de activación ante estímulos térmicos (calor y frío) y mecánicos. La hiperactividad persistente de los nociceptores supervivientes puede ser responsable del dolor persistente y provocar cierta sensibilización central en el asta de la médula espinal, de modo que los estímulos táctiles transmitidos a través de las fibras A pueden activar las neuronas nociceptivas centrales. Como resultado, los estímulos mecánicos inducen un aumento de la percepción del dolor, es decir, hiperalgesia por pinchazo y AMD. Dado que estos tipos de hiperalgesia mecánica sólo se produjeron en aproximadamente el 20% de los pacientes, es evidente que el impulso de los nociceptores periféricos no siempre induce una sensibilización central [2].
El grupo 3 (hiperalgesia mecánica, 24%) se caracterizaba por una pérdida predominante de pequeñas fibras sensibles al frío y al calor en combinación con hiperalgesia por presión roma, hiperalgesia por pinchazo y una DMA marcada y más frecuente. La calidad del dolor urente fue más pronunciada en este grupo que en los demás, lo que concuerda con los hallazgos en el síndrome de Guillain-Barré, en el que el dolor urente se asoció a déficits de fibras pequeñas, y con el concepto de calor sintético más que de sensibilización periférica al calor. El perfil fue más frecuente en pacientes con neuralgia posherpética (NPH) (47%). Se asemeja al perfil elicitado por la estimulación eléctrica de alta frecuencia de la piel capaz de inducir una potenciación espinal a largo plazo y probablemente corresponde a los subgrupos de “hiperalgesia neurógena” o “sensibilización central” descritos por otros. La sensibilización central es pronunciada con los estímulos mecánicos, pero no con los térmicos. La disociación de la hiperalgesia térmica y mecánica puede explicarse por las diferencias en la señalización neuronal del dolor térmico y mecánico, que comienza con la codificación periférica en diferentes subconjuntos de nociceptores. El dolor persistente en este subgrupo indica de nuevo una actividad espontánea en el sistema nociceptivo, que puede originarse en el sistema nervioso periférico y/o central [2].
Tratamiento basado en perfiles: ¡los subgrupos responden mejor!
Basándose en este algoritmo, se clasificó a los pacientes según grupos similares en ensayos clínicos posteriores y se comprobó la diferente eficacia de los fármacos en un análisis secundario planificado. Por ejemplo, un estudio de prueba de concepto aleatorizado y controlado con placebo evaluó la seguridad y eficacia de la administración durante 28 días de ISC 17536, un novedoso inhibidor, disponible por vía oral, del ampliamente utilizado receptor del dolor Anquirina 1 del potencial receptor transitorio, que media la señalización nociceptiva en las pequeñas fibras nerviosas periféricas, se estudió en 138 pacientes con neuropatía diabética periférica crónica y dolorosa, utilizando pruebas sensoriales cuantitativas para caracterizar el fenotipo basal de los pacientes. El criterio de valoración primario fue el cambio en la puntuación media de la intensidad del dolor en 24 horas basada en una escala numérica de calificación de la intensidad del dolor de 11 ítems desde el inicio hasta el final del tratamiento. En el estudio, el criterio de valoración primario no se alcanzó en toda la población de pacientes. Sin embargo, en una subpoblación exploratoria, generadora de hipótesis, de pacientes con una función preservada de las fibras nerviosas pequeñas definida por pruebas sensoriales cuantitativas, se descubrió que el ISC 17536 producía una mejora estadísticamente significativa y clínicamente significativa del dolor [3].
Otro estudio aleatorizado, doble ciego, controlado con placebo y estratificado fenotípicamente investigó la eficacia de la oxcarbazepina (1800-2400 mg) y el placebo en dos periodos de tratamiento de 6 semanas. La medida de eficacia primaria fue el cambio en la intensidad media del dolor entre el inicio y la última semana de tratamiento, medido en una escala de calificación numérica de 11 puntos, y el objetivo primario fue comparar el efecto de la oxcarbazepina en pacientes con y sin fenotipo nociceptor irritable, definido por hipersensibilidad y función preservada de las fibras nerviosas pequeñas, según lo determinado por pruebas sensoriales cuantitativas detalladas. Se aleatorizó a 97 pacientes con dolor neuropático periférico debido a polineuropatía, lesión nerviosa quirúrgica o traumática o neuralgia postherpética. La población por intención de tratar incluyó a 83 pacientes: 31 con el fenotipo nociceptor irritable y 52 con el nociceptor no irritable. En la muestra total, la oxcarbazepina alivió el dolor en 0,7 puntos (en una escala de valoración numérica de 0-10; intervalo de confianza del 95% [CI] 0,4-1,4) más que el placebo (p=0,015), y hubo una interacción significativa entre el tratamiento y el fenotipo de 0,7 (IC del 95% 0,01-1,4, p=0,047). El número de pacientes que necesitaron tratamiento para lograr un alivio del dolor superior al 50% fue de 6,9 (IC 95%: 4,2-22) en la muestra total, 3,9 (IC 95%: 2,3-12) en el grupo de irritables y 13 (IC 95%: 5,3-∞) en el grupo de nociceptores no irritables. Los resultados muestran que la oxcarbazepina es más eficaz para aliviar el dolor neuropático periférico en pacientes con fenotipo nociceptor irritable frente al nociceptor no irritable [4].
Otro estudio utilizó modelos de medidas repetidas de efectos mixtos para evaluar la eficacia de la pregabalina en comparación con el placebo en subgrupos con fenotipos de dolor inducido (es decir, hiperalgesia o alodinia) utilizando datos de un reciente ensayo clínico aleatorizado multinacional (n=539) en el que los subgrupos fenotípicos se identificaron mediante el uso de un examen clínico estructurado. La diferencia en la puntuación media del dolor entre el grupo activo y el grupo placebo (es decir, delta) tras 15 semanas de tratamiento fue de -0,76 (p=0,001) para el subgrupo con hiperalgesia, en comparación con 0,19 (p=0,47) para el subgrupo que no presentaba hiperalgesia. La interacción entre tratamiento y fenotipo, que comprueba si los subgrupos responden de forma estadísticamente diferente al tratamiento, fue significativa (p=0,0067). El delta para el subgrupo con alodinia fue de -0,31 (p=0,22), frente a -0,30 (p=0,22) para el subgrupo sin alodinia (interacción tratamiento-fenotipo p=0,98). Estos resultados sugieren que la hiperalgesia, pero no la alodinia, predice la respuesta a la pregabalina en pacientes con dolor neuropático postraumático crónico [5].
La subagrupación identifica a los respondedores
En estos y otros estudios sobre dolor neuropático, el perfil sensorial QST* se utilizó para identificar predictores de respuesta al tratamiento que pueden asignarse provisionalmente a los tres grupos. Por ejemplo, los pacientes con un perfil de resultados QST parecido al grupo 2 (“hiperalgesia por calor”) mostraron una mayor eficacia en un ensayo prospectivo, aleatorizado y controlado con placebo de oxcarbazepina, en un análisis previo de un ensayo controlado con placebo de toxina botulínica y en un análisis retrospectivo de un ensayo de parches tópicos de capsaicina sin brazo placebo. Un análisis retrospectivo de un estudio controlado con placebo con lidocaína tópica mostró una eficacia menor. Los pacientes con un perfil de resultados QST parecido al grupo 1 (“pérdida sensorial”) tuvieron una mayor eficacia en un análisis retrospectivo de un ensayo controlado con placebo de opiáceos orales. Un ensayo prospectivo aleatorizado controlado con placebo de oxcarbazepina mostró una eficacia menor. Los pacientes con un perfil de resultados QST parecido al grupo 3 (“hiperalgesia mecánica”) mostraron una mayor eficacia en los análisis retrospectivos de los ensayos controlados con placebo con pregabalina oral, lidocaína tópica, lamotrigina o lidocaína intravenosa.
* QST=protocolo estandarizado para pruebas sensoriales cuantitativas
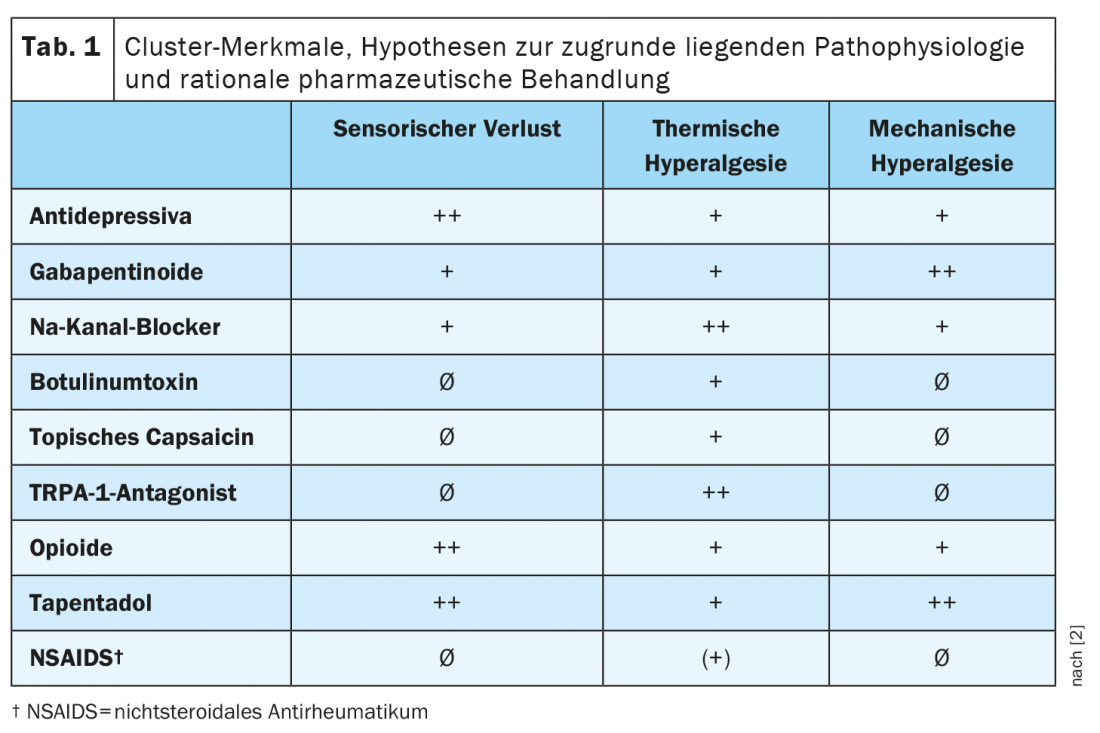
Los diferentes perfiles farmacológicos subrayan la relevancia clínica de las agrupaciones. En la tabla 1 se resume una predicción de la eficacia diferencial de los principales fármacos para el dolor neuropático en los distintos grupos [2]. El Prof. Dr. Ralf Baron, Jefe de la Sección de Investigación y Terapia del Dolor Neurológico del Hospital Universitario Schleswig-Holstein de Kiel, subraya en este punto que, no obstante, el alcance de la diferencia en la respuesta al tratamiento entre los grupos aún debe probarse en futuros estudios prospectivos [1].
Síntomas sensoriales captados por los resultados comunicados por los pacientes (PRO)
Además del perfil sensorial QST, también existen síntomas comunicados por los pacientes que describen cualidades sensoriales. Un resultado comunicado por el paciente (PRO, por sus siglas en inglés) describe la información evaluada y comunicada directamente por la persona sobre cómo se siente con respecto a su salud o tratamiento, o a su funcionamiento, sin interpretación ni modificación por parte de otros, incluidos médicos e investigadores. Para los pacientes neuropáticos o con dolor crónico, existen algunos cuestionarios validados que preguntan específicamente por diferentes síntomas sensoriales (Tabla 2) [6–8].
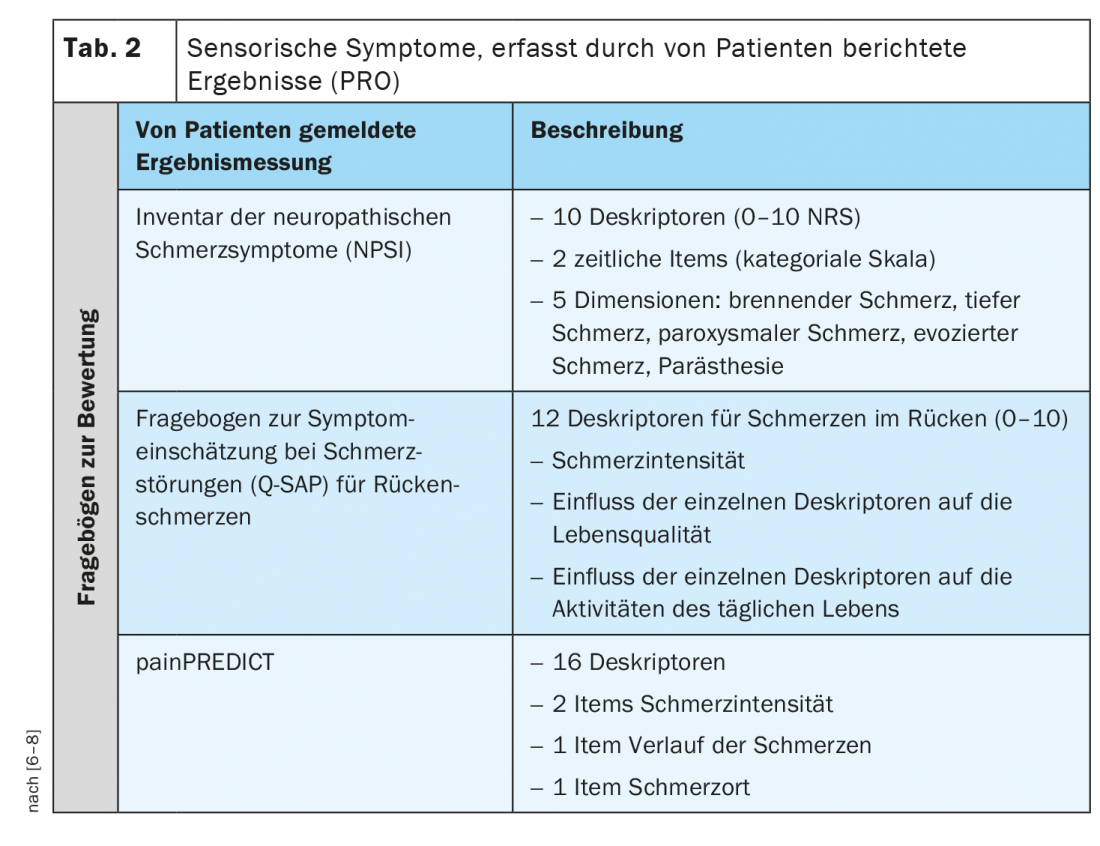
El Inventario de Síntomas de Dolor Neuropático (NPSI), por ejemplo, es un autocuestionario diseñado específicamente para evaluar los diversos síntomas del dolor neuropático. La versión final del NPSI incluye diez descriptores (más dos ítems temporales) que permiten discriminar y cuantificar cinco dimensiones diferentes y clínicamente relevantes de los síndromes de dolor neuropático sensibles al tratamiento. Las propiedades psicométricas del NPSI sugieren que podría utilizarse para caracterizar subgrupos de pacientes con dolor neuropático y comprobar si responden de forma diferente a distintos agentes farmacológicos u otras intervenciones terapéuticas [6].
El Q-SAP es un autocuestionario específico que registra los síntomas clásicos de dolor nociceptivo y neuropático de los pacientes con lumbalgia crónica en relación con su distribución local. Además, el cuestionario capta la intensidad de estos síntomas y su impacto en la calidad de vida y la funcionalidad, y puede utilizarse para evaluar el tratamiento. El autocuestionario consta de dos partes (para los síntomas de la espalda y, en su caso, de las piernas) y se probó en 152 pacientes con lumbalgia crónica con y sin radiculopatía. A diferencia de otros cuestionarios, el Q-SAP Espalda/Pierna evalúa no sólo la intensidad de los síntomas, sino también su impacto en la calidad de vida y la funcionalidad del paciente. Además, este cuestionario pregunta sobre los síntomas en función de su distribución anatómica [7].
painPREDICT es un cuestionario que utiliza una amplia gama de descriptores comunicados por los pacientes que pueden estar asociados a mecanismos de dolor neuropático y nociceptivo, y para examinar patrones de síntomas sensoriales. El cuestionario final incluía 20 ítems que abarcaban los siguientes ámbitos: Intensidad del dolor, localización del dolor, progresión del dolor y síntomas sensoriales. La agrupación híbrida de los datos del nuevo cuestionario reveló tres perfiles diferentes de síntomas sensoriales característicos en pacientes con dolor neuropático (NeP): “Nociceptores irritables”, “Dolor por desaferentación” y “Ataques de dolor con componente nociceptivo”. Aunque se encontraron algunas diferencias en la distribución de los perfiles sensoriales, todos los perfiles estaban representados en todos los grupos de etiología de la NeP [8].
Mensajes para llevarse a casa
- Existen subgrupos mecánicos en los pacientes con dolor
- Algunos subgrupos responden especialmente bien a los opiáceos
- Las herramientas de evaluación son:
– Perfiles sensoriales QST
– Perfiles sensoriales PRO
Congreso: Congreso Alemán del Dolor 2022
Literatura:
- Prof. Dr. Ralf Baron: Evaluación del dolor: la base para una terapia individual. Congreso Alemán del Dolor 2022, Simposio de la Industria; 21.10.2022.
- Baron R, et al: Dolor neuropático periférico: un principio organizador relacionado con el mecanismo basado en perfiles sensoriales. Dolor 2017; doi: 10.1097/j.pain.0000000000000753.
- Jain M, et al: Ensayo aleatorizado, doble ciego, controlado con placebo de ISC 17536, un inhibidor oral del potencial receptor transitorio ankyrin 1, en pacientes con neuropatía diabética periférica dolorosa: impacto de la función preservada de las fibras nerviosas pequeñas. Dolor 2022; doi: 10.1097/j.pain.0000000000002470.
- Demant DT, et al: El efecto de la oxcarbazepina en el dolor neuropático periférico depende del fenotipo del dolor: Un estudio aleatorizado, doble ciego, controlado con placebo y estratificado por fenotipos. Dolor 2014; doi: https://doi.org/10.1016/j.pain.2014.08.014.
- Gewandter JS, et al: Predicción de la respuesta al tratamiento con fenotipado sensorial en el dolor neuropático postraumático. Dolor 2022; doi: 10.1093/pm/pnac045.
- Bouhassira D, et al: Desarrollo y validación del Inventario de Síntomas de Dolor Neuropático. Dolor 2004; doi: 10.1016/j.pain.2003.12.024.
- Otto JC, et al: Validación del Cuestionario para la Evaluación de Síntomas en Trastornos de Dolor para Pacientes con Dolor de Espalda (Q-SAP). Eur J Pain 2020; doi: 10.1002/ejp.1690.
- Tölle TR, et al: painPREDICT: primeros datos provisionales del desarrollo de un nuevo cuestionario sobre el dolor notificado por el paciente para predecir la respuesta al tratamiento mediante perfiles de síntomas sensoriales. Curr Med Res Opin 2019; doi: 10.1080/03007995.2018.1562687.











