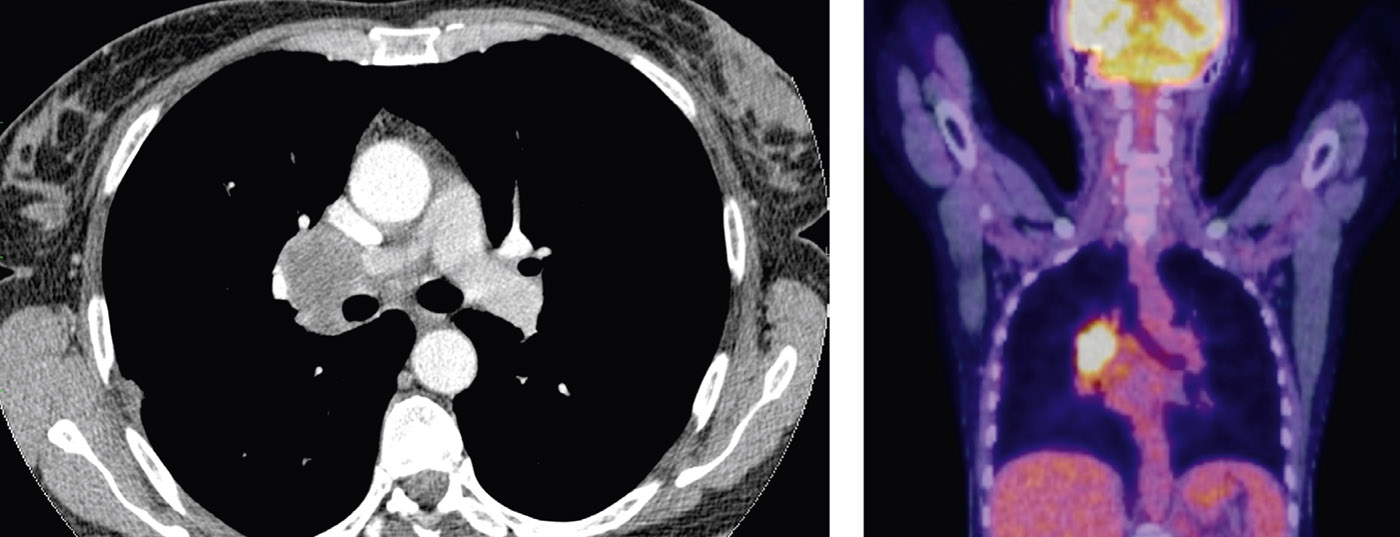
La elección de las modalidades de tratamiento del cáncer de pulmón depende de varios factores. La estadificación precisa, la evaluación de la operabilidad y el conocimiento de factores pronósticos como el número de estaciones ganglionares afectadas y la gradación son cruciales. El tratamiento estándar para los estadios iniciales es la cirugía primaria. Para los pacientes en estadios avanzados pero aún operables, la quimioterapia neoadyuvante puede mejorar la resecabilidad. Para aumentar las tasas de supervivencia del cáncer de pulmón, deben llevarse a cabo programas de cribado en individuos de riesgo.
El cáncer de pulmón, con una tasa actual de supervivencia a 5 años del 15,1%, sigue siendo una forma de cáncer con una mortalidad muy elevada. A pesar de la financiación masiva y de las mejoras en todas las modalidades de tratamiento disponibles -incluidas las terapias con anticuerpos de última generación-, la mortalidad ha permanecido invariable durante 30 años [1]. La razón de esta evolución insatisfactoria es el hecho de que el cáncer de pulmón sólo suele diagnosticarse cuando la enfermedad ya se encuentra en una fase avanzada.
Sin duda, el cáncer de pulmón podría curarse, sobre todo gracias a las opciones de tratamiento quirúrgico, pero en el momento del diagnóstico el 75% de los pacientes afectados ya no son curables. Esta posición de partida desfavorable sólo mejorará para los pacientes si se realiza un cribado sistemático del grupo de riesgo con TC de baja dosis según un algoritmo definido con precisión y si este cribado también lo pagan los fondos del seguro de enfermedad. Entonces el pronóstico podría mejorar realmente, como se ha documentado científicamente de forma impresionante [2], y la mortalidad por cáncer de pulmón disminuiría de forma continua y significativa. El papel de la cirugía cambiará a medida que surjan programas de cribado y, en consecuencia, aumenten los métodos quirúrgicos mínimamente invasivos y las resecciones limitadas [3].
Puesta en escena
La estadificación del cáncer de pulmón no microcítico (CPNM) se realiza según la clasificación TNM y la estadificación clínica según la AJCC [4]. Se realiza después de la estadificación y es muy relevante para la selección de las modalidades terapéuticas en la discusión obligatoria en la junta tumoral interdisciplinar. Una correcta estadificación del CPNM incluye broncoscopia con biopsia y TC y PET. Determinar el estadio exacto de los ganglios linfáticos (estadio N) es muy relevante para la planificación de la terapia quirúrgica. La PET tiene un gran peso en este caso, ya que proporciona resultados muy fiables en términos de valor predictivo negativo (VPN). Sin embargo, los ganglios linfáticos del mediastino positivos para la PET deben documentarse siempre histológicamente (por ejemplo, con ecografía endobronquial, biopsia transbronquial o mediastinoscopia), ya que la PET es insuficiente en términos de valor predictivo positivo (VPP). Esto también se aplica a la localización del tumor primario en el parénquima pulmonar. Si no hay histología transbronquial o al menos una citología al ras documenta malignidad, se recomienda la punción transtorácica o la resección toracoscópica en cuña para completar la estadificación [5–7].
Operatividad
La mayoría de los pacientes con CPNM son fumadores activos o ex fumadores con la correspondiente comorbilidad pulmonar y cardiaca (EPOC, enfisema, etc.). La llamada estadificación funcional es, por tanto, un componente importante antes de la indicación de una intervención quirúrgica. Las pruebas clave para ello son la prueba de función pulmonar, la ergometría y, en casos críticos, la espiroergometría en combinación con la gammagrafía de perfusión. Se recomienda seguir las directrices de la ESMO [8]. A efectos prácticos, una buena pauta sigue siendo el FEV1, que debería ser como mínimo de aproximadamente 1 litro después de la operación.
Factores pronósticos de la indicación
La planificación de una intervención quirúrgica en el CPNM es muy compleja y requiere un conocimiento detallado debido a la amplia gama de apariencia tumoral. Existen normas metodológicas claras para la indicación y el objetivo es proporcionar al paciente el tratamiento más adaptado o adecuado. ofrecer una terapia quirúrgica individualizada. Mientras que para los estadios iniciales (T1-2, N0, M0 o AJCC IA-IB) la atención se centra en los métodos de tratamiento mínimamente invasivos que salvan el parénquima, incluida la linfadenectomía de estadificación, para los estadios avanzados que aún pueden tratarse quirúrgicamente (T1-4, N1-2, M0 o AJCC IIA-IIIB) la atención se centra en optimizar las terapias oncológicas, radioterapéuticas y quirúrgicas multimodales. El cirujano debe tener un conocimiento detallado de los factores pronósticos importantes y ser capaz de ajustar la terapia también intraoperatoriamente, utilizando diagnósticos histopatológicos rápidos con la mayor frecuencia posible. Según los conocimientos actuales, los siguientes factores son factores pronósticos independientes para el tratamiento quirúrgico del CPNM, ponderados según su importancia [9–12]:
- Número de estaciones ganglionares afectadas
- Clasificación y diferenciación histológica
- Linfangioinvasión en la histología definitiva
- Número total de ganglios linfáticos afectados
- Respuesta con terapia neoadyuvante
- Sexo y edad del paciente
- Tamaño del tumor
Terapia quirúrgica de los estadios iniciales
Los tumores en estadios T1-T2 sin afectación de los ganglios linfáticos se denominan estadios iniciales y tienen un pronóstico correspondientemente bueno (Fig. 1) .
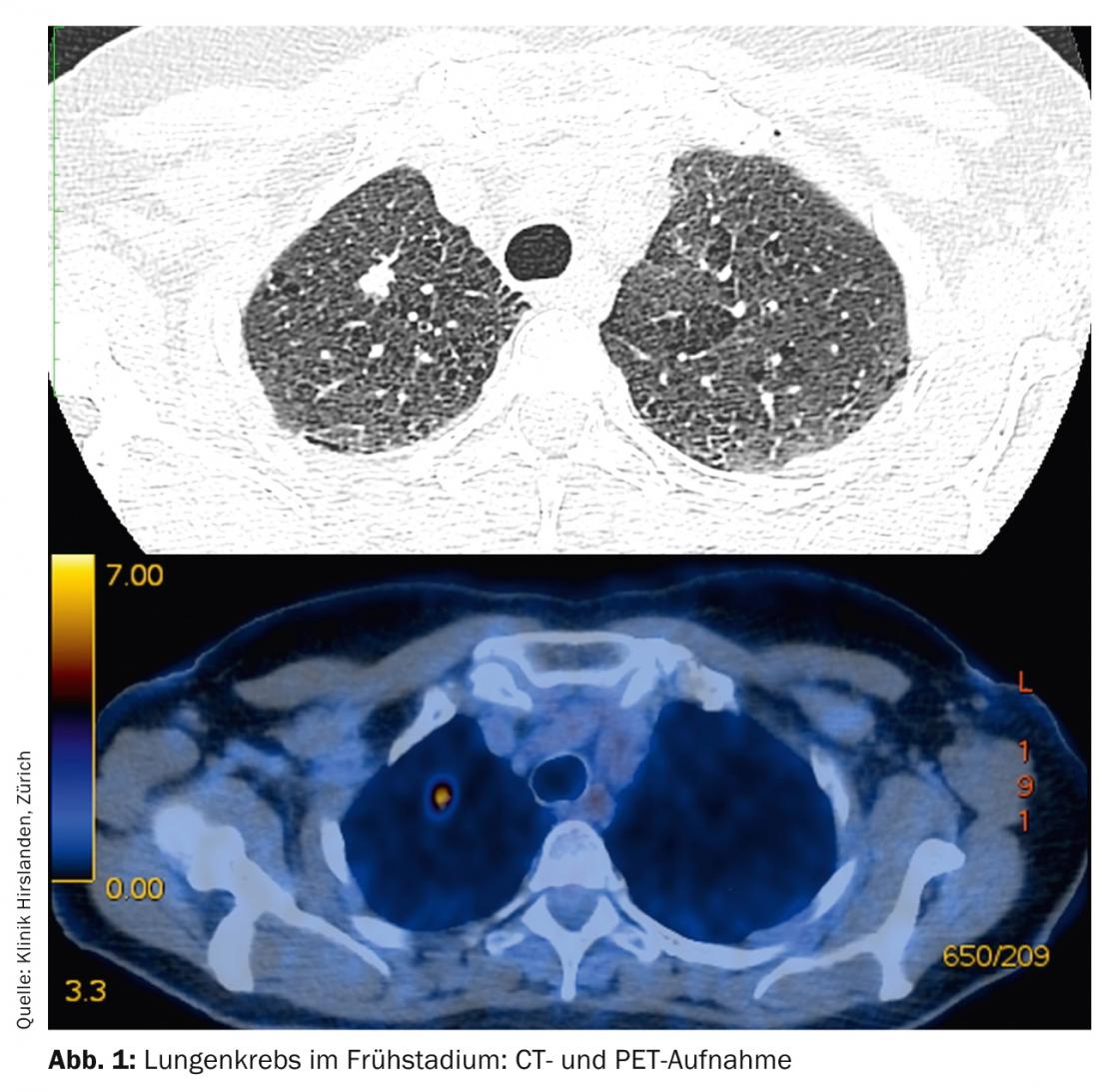
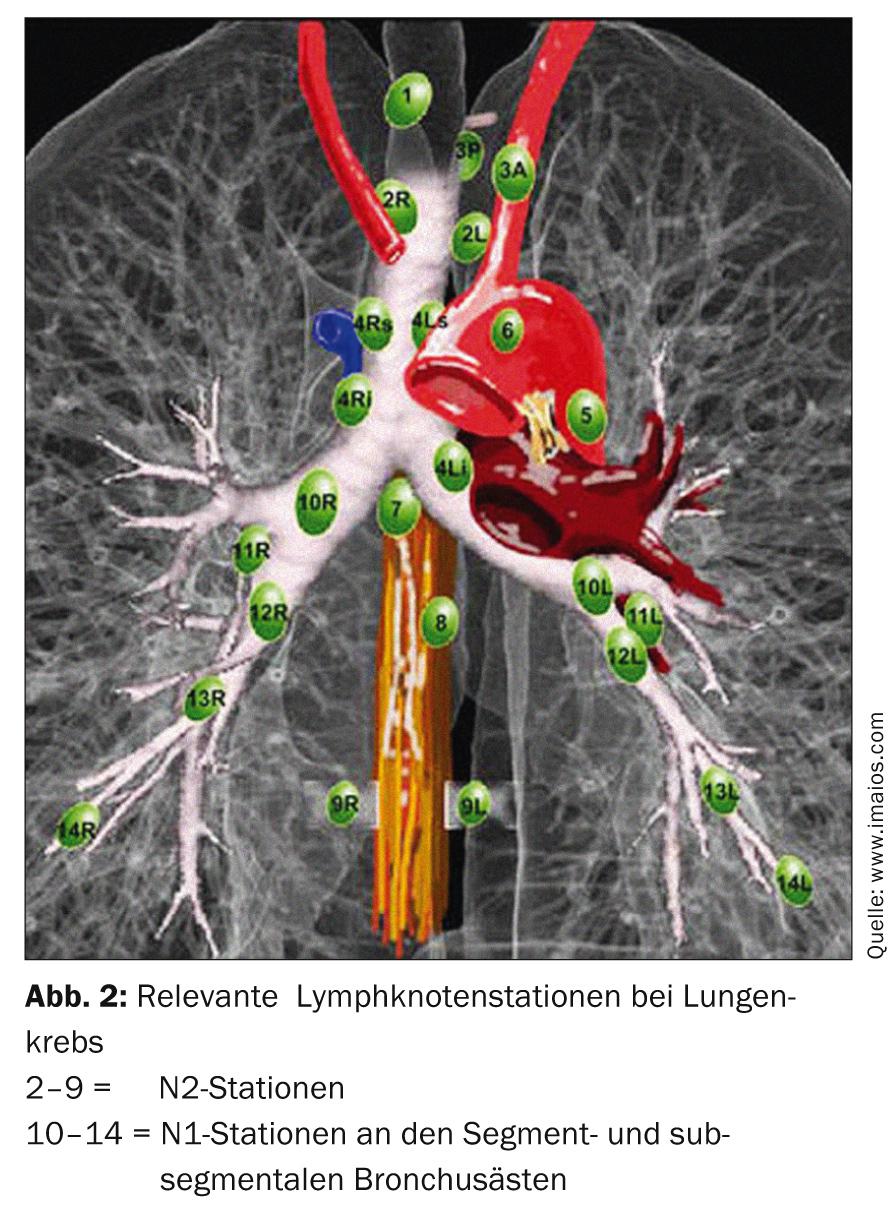
El tratamiento estándar es la terapia quirúrgica primaria. Dependiendo de la localización del tumor en el lóbulo pulmonar, puede ser necesaria una resección segmentaria o una lobectomía. Es obligatorio verificar el estadio N0 mediante un muestreo sistemático de los ganglios linfáticos del mediastino (Fig. 2). En caso de cambio intraoperatorio de estadio (sorprendente afectación N1 o N2), es necesario un ajuste inmediato de la terapia quirúrgica con linfadenectomía radical y lobectomía completa. La edad y el estado funcional del paciente también deben incluirse como criterios esenciales en esta decisión. Si un paciente ha sido sometido a una resección segmentaria y se comprueba en el postoperatorio que existen numerosos factores de riesgo pronóstico (linfangioinvasión, afectación ganglionar subsegmentaria, mala gradación, adenocarcinoma en hombres, etc.), es necesaria una lobectomía completa en el sentido de una segunda operación y debe discutirse la quimioterapia aditiva en la junta tumoral [13].
Terapia quirúrgica de estadios avanzados
Todos los estadios T con afectación N1 o N2 son estadios avanzados pero aún operables (IIA-IIIB). Existen morfologías muy diferentes en este grupo de pacientes y la planificación del tratamiento quirúrgico es correspondientemente compleja. Hay dos cuestiones cruciales para fijar el rumbo de los conceptos terapéuticos disponibles:
- ¿Hay una gran masa tumoral o ganglionar central o en los ganglios linfáticos? ¿cerca de la división bronquial principal o cerca de otros órganos mediastínicos (aorta, corazón)?
- ¿Están afectadas varias estaciones de ganglios linfáticos N2? Y si es así, ¿cuáles en relación con el lóbulo afectado por el tumor?
Si una de estas preguntas debe responderse con un “sí”, surge la cuestión del pretratamiento neoadyuvante. Si ambas preguntas pueden responderse negativamente, el paciente se trata principalmente con cirugía. El objetivo del pretratamiento neoadyuvante es mejorar la resecabilidad y conseguir pacientes con un pronóstico intacto. Después de, por lo general, tres ciclos de quimioterapia (por ejemplo, con cisplatino y docetaxel), tiene lugar la reestadificación. Si la respuesta es buena, la cirugía es el siguiente paso. Si no hay respuesta o incluso progresión de la enfermedad, el paciente no reúne los requisitos para una terapia quirúrgica; seguirá recibiendo quimioterapia o radioterapia con intención paliativa [14,15].
Caso 1: estadio IIIA, no voluminoso, T3 N1
En la paciente afectada, el diagnóstico por imagen muestra un adenocarcinoma originado en la língula, con afectación de los ganglios linfáticos N1 y dos tumores en el lóbulo (T3) (Fig. 3).

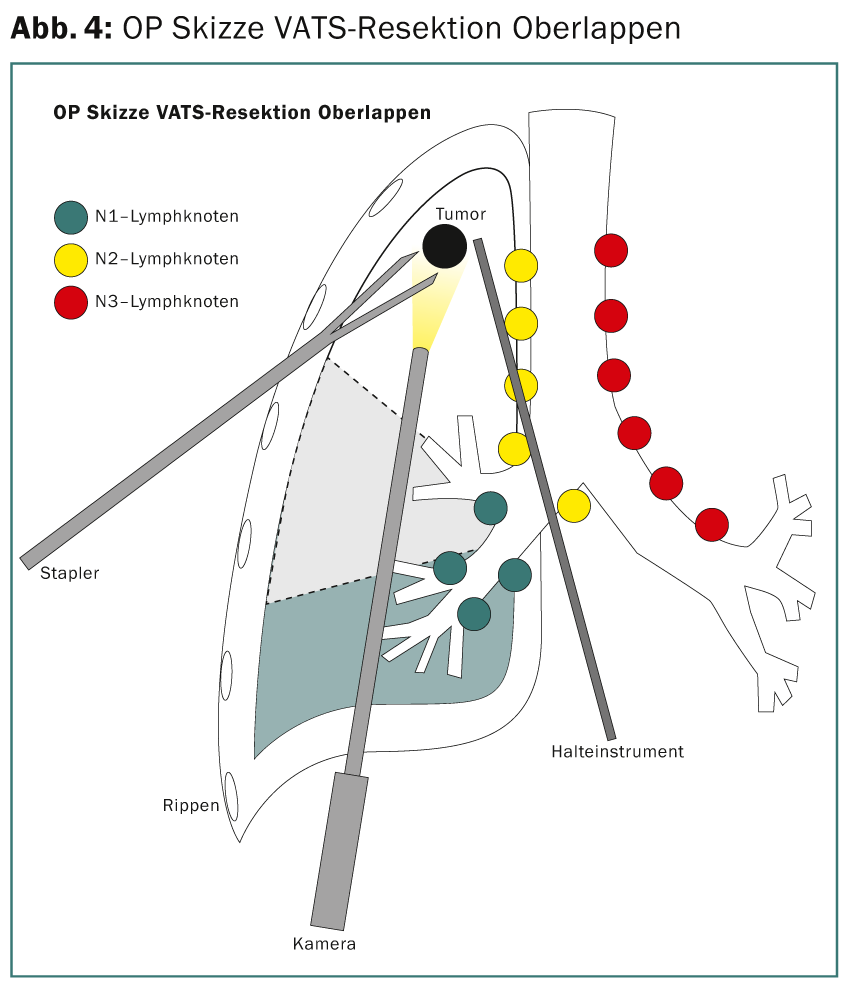
La estadificación preoperatoria con PET y ecografía endobraquial (EBUS) de las salas N2 no revela evidencia tumoral. Por lo tanto, la paciente reúne los requisitos para una terapia quirúrgica directa. Se realiza una resección toracoscópica del lóbulo superior (lobectomía VATS mínimamente invasiva [VATS thoracic surgery]) (Fig. 4) con linfadenectomía mediastínica extensa. Intraoperatoriamente, la resección R0 se confirma mediante un rápido diagnóstico histopatológico de los márgenes de resección y los ganglios linfáticos N2. El estadio tumoral definitivo TNM de la patología es pT3, pN1 (3 de 34), L1, V1, Pn0, R0. Debido a la situación de los ganglios linfáticos, se recomienda la quimioterapia adyuvante.
Caso 2: estadio IIIA, extenso (voluminoso), T2 N2
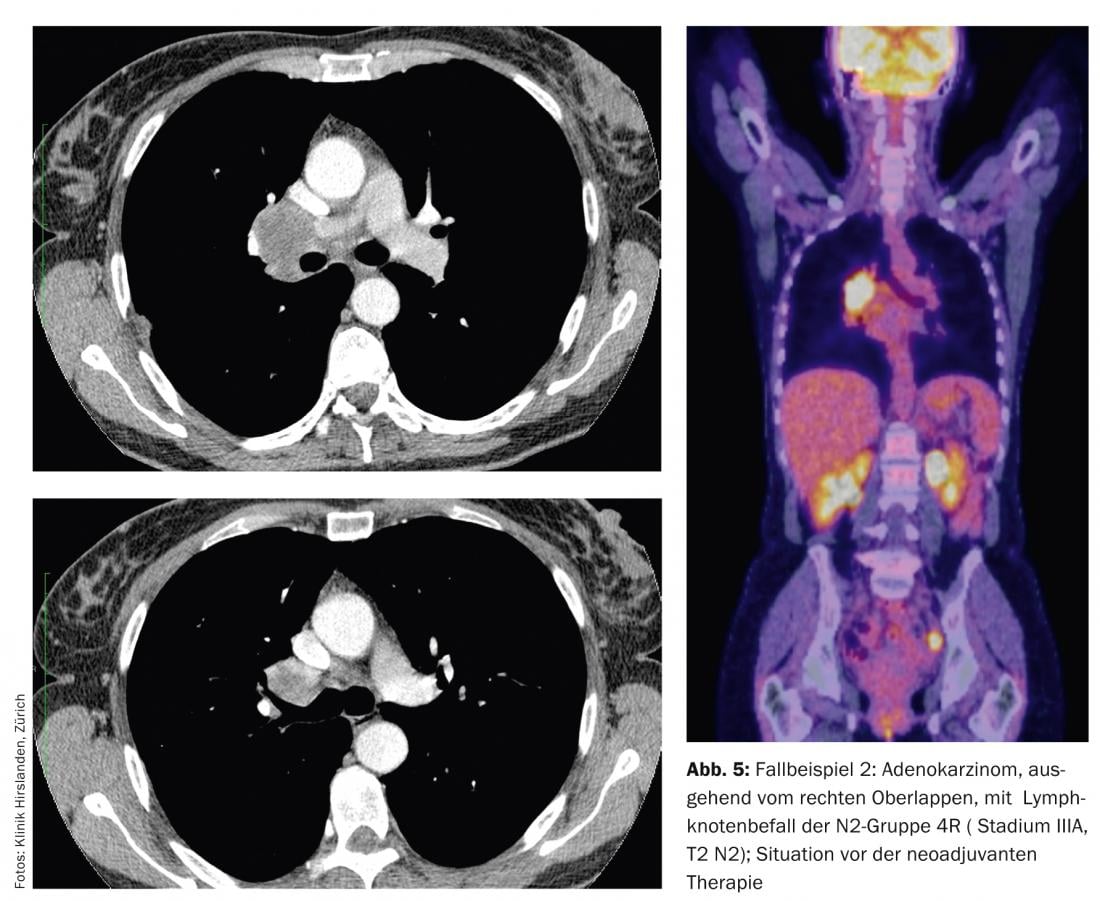
El diagnóstico por imagen muestra un adenocarcinoma originado en el lóbulo superior derecho con afectación de los ganglios linfáticos del grupo N2 4R (Fig. 5).
Esta infestación es muy voluminosa y se extiende hasta o más allá de la carina principal. La cirugía radical primaria no puede realizarse en esta zona. El tumor primario no es voluminoso y mide unos 5 cm en el estadio T2. La estadificación preoperatoria con PET y EBUS de las estaciones N2 no revela la detección de tumores en otras estaciones N2 o N3 contralaterales. No obstante, esta paciente es candidata a un pretratamiento neoadyuvante para reducir los hallazgos extensos y seleccionarla para la cirugía. Después de tres ciclos de quimioterapia, un nuevo TAC muestra una muy buena respuesta (estadiaje descendente) y ninguna nueva manifestación tumoral en el sentido de nuevos agrandamientos ganglionares, focos redondos o metástasis (Fig. 6) .

Así pues, la paciente reúne ahora los requisitos para una terapia quirúrgica secundaria. La resección abierta del lóbulo superior con resección en bloque del bronquio principal y reconstrucción broncoplástica (Fig. 7 ) da lugar a una resección R0 con confirmación intraoperatoria mediante diagnóstico histopatológico rápido de los márgenes de la incisión y de los ganglios linfáticos mediastínicos radicalmente despejados. El estadio tumoral definitivo TNM de la patología es ypT1a, ypN0 (0 de 29), L0, V0, Pn0, R0 (“y” denota el estado tras el pretratamiento neoadyuvante). Debido a la extensión peribronquial principalmente muy extensa, se recomienda en este caso la radiación consolidadora del mediastino para completar el concepto de terapia multimodal.

Perspectivas
El tratamiento de los estadios avanzados del CPNM es un reto interdisciplinar y de técnica quirúrgica. El pronóstico medio de supervivencia a 5 años para los pacientes afectados se sitúa entre el 23 y un máximo del 55%. La probabilidad de supervivencia es realmente buena para los tumores en estadio temprano. La cohorte del Programa Internacional de Acción contra el Cáncer de Pulmón en Estadios Tempranos (IELCAP) muestra curvas de supervivencia para los pacientes sometidos a cribado en estadios tempranos de más del 90% (¡supervivencia a 10 años!). En la actualidad, el pronóstico global del cáncer de pulmón es de sólo un 15,1% de supervivencia a 5 años en todos los estadios, incluido el cáncer de pulmón. inoperable. Todos los esfuerzos para mejorar esta cifra deben centrarse en la mejora de la prevención entre los jóvenes y en el cribado sistemático entre los grupos de riesgo (fumadores activos o ex fumadores, mayores de 50 años, más de 20 años-paquete). Entonces, la mala situación actual, con sólo un 15,1% de supervivencia a 5 años, puede mejorar significativamente.
Mensajes para llevar a casa
- Sólo una cuarta parte de los pacientes con cáncer de pulmón pueden recibir terapia quirúrgica y, por tanto, una posible cura.
- El cribado del grupo de riesgo es necesario para detectar las fases iniciales; un programa de cribado con TC de baja dosis reduce significativamente la mortalidad.
- El grupo de riesgo son los fumadores activos o ex fumadores mayores de 50 años con más de 20 paquetes-año.
- El profundo conocimiento de los factores pronósticos individuales y generales determina el concepto de terapia a medida, especialmente en los casos que requieren tratamiento quirúrgico.
Prof. Dr. med. Othmar Schöb
Literatura:
- Ferlay J, et al: Eur J of Cancer 2013; 49: 1374-1403.
- El equipo de investigación del ensayo nacional de cribado pulmonar: Reducción de la mortalidad por cáncer de pulmón con el cribado mediante tomografía computarizada de baja dosis. N Engl J Med 2011; 365: 395-409.
- Altorki NK, et al: J Thor Cardiovasc Surg 2014; 147(2): 754-764.
- Comité conjunto americano sobre el cáncer. 7ª edición.
- Sahiner I, et al: Quant Imaging Med Surg 2014; 4(3): 195-206.
- Shingyoji M, et al: Ann Thorac Surg 2014, Aug 19. pii: S0003-4975(14)01277-6. doi: 10.1016/j.athoracsur.2014. 05.078. [Epub ahead of print].
- Teran MD, et al: J Thorac Dis 2014; 6(3): 230-236.
- Vansteenkiste J, et al: Ann Onc 2014; 25: 1462-1474.
- Riquet M, et al: Ann Thorac Surg 2014; 98: 224-231.
- Ichinose J, et al: Chest 2014; 146;(3); 644-649.
- Kuo SW, et al: J Thorac Cardiovesc Surg 2014; 148(4): 1200-1207.
- Ito M, et al: Lungcan 2014; 85: 270-275.
- Mediratta N, et al: Cirugía cardio-torácica 2014; 46: 267-273.
- Jaklitsch MT, et al: J Surg Oncol 2006: 94(7): 599-606.
- Trodella L, et al: Ann Oncol 2014; 15: 389-398.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(1): 13-17