Para la mayoría de los pacientes con enfermedades respiratorias, la inhalación es el método de tratamiento más eficaz. En comparación con las vías de terapia sistémica (oral, i.v., i.m., s.c.), ofrece una clara ventaja terapéutica, ya que transporta la sustancia activa directamente a los pulmones. Sin embargo, un requisito previo para ello es que tanto el profesional como el paciente sepan utilizar correctamente el inhalador.
Con la inhalación, se pueden administrar dosis más pequeñas en comparación con otros métodos. El inicio de la acción es rápido y la incidencia de efectos secundarios es baja, según las demás ventajas enumeradas por el Prof. Dr. Omar S. Usmani del Imperial College de Londres en el Congreso Respiratorio Europeo (ERS) [1]. La cuestión primordial es cómo hacer llegar la dosis correcta al lugar adecuado: “Se puede tener el mejor fármaco, pero si el dispositivo inhalador no hace llegar el fármaco de forma eficaz y precisa a los pulmones, ¡entonces el fármaco no es eficaz! Para lograr este objetivo, tres aspectos son eminentes:
- Formulación y química del aerosol
- Desarrollo y diseño del dispositivo
- Entrenamiento y técnica de aplicación del paciente.
Formulación
El tamaño, la forma y la densidad de las partículas que se inhalan son importantes. Las partículas porosas de baja densidad se utilizan en antibióticos inhalados e insulina inhalada, y se están desarrollando partículas en forma de aguja basadas en amianto y virus filamentosos para su uso en corticosteroides inhalables.
El tamaño de las partículas influye en la cantidad total de principio activo que entra en los pulmones y en el lugar exacto al que llega. La mayoría de los dispositivos utilizados en la práctica alcanzan un rango respirable de 1 µm-5 µm [2]. Ya en 2005, un grupo dirigido por el profesor Usmani probó tres tamaños diferentes de partículas (1,5 µm, 3,0 µm y 6,0 µm) en pacientes asmáticos. Se ha demostrado que el uso de partículas más pequeñas consigue una mejor deposición pulmonar y una mayor penetración de estos aerosoles en los pulmones (Fig. 1) [3]. El mismo resultado se demostró posteriormente en pacientes con EPOC: las partículas más pequeñas logran una mejor deposición pulmonar en general y una mejor distribución por las vías respiratorias.
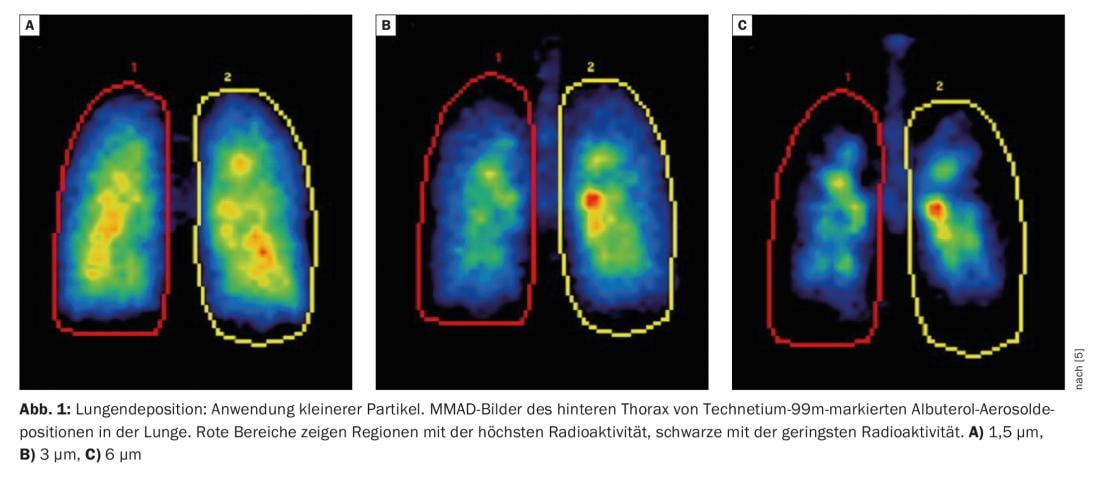
El Prof. Usmani señaló que el Informe GOLD 2022 [4] también hace referencia a la importancia de la deposición periférica y el tratamiento extrafino: “Para la administración de fármacos en las vías respiratorias inferiores y los pulmones, el tamaño de las partículas (diámetro aerodinámico medio de la masa) puede ser fino (2-5 µm) o extrafino (<2 µm), lo que significa que la fracción respirable total (partículas <5 µm), así como influye la cantidad y la localización de la deposición del fármaco (deposición más periférica con partículas extrafinas)”.
En los últimos tres o cuatro años se han producido grandes avances en el desarrollo clínico de la terapéutica con nanopartículas inhaladas, señaló el experto. El concepto subyacente consiste en una capa protectora, la parte terapéutica y moléculas diana, es decir, moléculas en la superficie de las nanopartículas que guían todo el paquete hasta su objetivo. Tales nanoterapéuticos están en desarrollo para los corticosteroides inhalados.
Desarrollo y tecnología de dispositivos
Los dispositivos inhaladores que se utilizan en la actualidad son principalmente inhaladores dosificadores presurizados (IDP), inhaladores de polvo seco (IPS), nebulizadores e inhaladores de niebla suave (IGS). Algunas de las innovaciones que médicos y pacientes pueden esperar incluyen
- MDI, que son de niebla suave (ya que la emisión de la niebla fina permite que el aerosol se transporte mejor y con mayor precisión a los pulmones),
- espaciadores antiestáticos que no necesitan preparación y pueden ser aplicados inmediatamente por el paciente,
- Nebulizadores de polvo seco que funcionan con pilas, son muy fáciles de usar, tienen un recordatorio de dosis y proporcionan retroalimentación,
- inhalador de niebla suave reutilizable,
- nebulizadores más pequeños que pueden sostenerse en la mano.
El Prof. Usmani destacó especialmente los “nebulizadores inteligentes”, cuyo modo de funcionamiento ya se conoce en el tratamiento de la hipertensión pulmonar y la fibrosis quística: nebulizadores portátiles de malla vibratoria, alimentados por pilas, que instruyen a los usuarios para que inhalen profunda y lentamente, teniendo en cuenta constantemente los cambios en la respiración de los pacientes. Los dispositivos pueden emitir los aerosoles siempre que el usuario inhale realmente, logrando así una deposición del 50-70%. De este modo, se minimiza la pérdida de aerosol durante la espiración.
Formación y tecnología de aplicación
El uso subóptimo del inhalador afecta a la eficacia clínica. Esto parece una obviedad, pero todavía no parece haber llegado del todo a la práctica, como lamentó el profesor Usmani. Esto no sólo se refiere a la a menudo escasa conformidad de los pacientes, sino también al manejo técnico y la aplicación del inhalador.
Con los dispositivos pMDI, los errores más comunes son no inhalar lo suficientemente despacio, no inhalar lo suficientemente profundo o no coordinar ambas cosas. La mayoría de los pacientes inhalaban demasiado rápido y, por tanto, no conseguían el mejor efecto posible. En cambio, con los inhaladores de polvo seco, la inhalación no sería lo suficientemente fuerte y profunda. Los DPI necesitarían un caudal de al menos 60 l/min para funcionar adecuadamente. En la vida real, esto no es alcanzable para muchos pacientes.
El profesor Usmani presentó el estudio PIFotal, que investigó el flujo inspiratorio máximo (FIP ) en pacientes con EPOC (n=1434) que utilizaban inhaladores de polvo seco como terapia de mantenimiento [5]. Se compararon la PIF óptima frente a la subóptima (sPIF). sPIF se ha definido como un PIF típico inferior al requerido para la unidad. La técnica de inhalación se evaluó y calificó mediante una evaluación estandarizada de las grabaciones de vídeo.
Los pacientes se clasificaron además en tres subgrupos clínicamente relevantes en función de su FPI:
- “Capaces y dispuestos”: pacientes con un FPI óptimo
- “Puede pero no lo hace”: Pacientes con una FPI típica inferior a la FPI óptima para su dispositivo, pero que son capaces de realizar una FPI máxima igual o incluso superior a la del grupo de FPI óptima.
- “No es posible”: Pacientes que tienen tanto su PIF típica como su PIF máxima por debajo de la PIF óptima para su dispositivo.
El 71% de los pacientes tenían un PIF óptimo, el 29% de todos los participantes no generaron un PIF óptimo para su DPI durante un procedimiento de inhalación típico [6]. El 16% de ellos mostraron que realmente eran capaces de generar un PIF óptimo para su dispositivo, pero no lo consiguieron durante el proceso de inhalación. Esto puede indicar que la sPIF es una característica potencialmente tratable en el tratamiento de la EPOC. El 13% restante se incluyó en el último grupo (“No es posible”), que no fue capaz de alcanzar la PIF óptima para su dispositivo ni siquiera con su PIF máxima. Este problema podría resolverse probablemente en el futuro con los DPI electrónicos multidosis, dijo el neumólogo. Dichos inhaladores de polvo seco podrían utilizar sensores digitales integrados para evaluar la inhalación mientras el paciente la realiza y tener en cuenta parámetros como la PIF para proporcionar una retroalimentación adecuada al usuario.
Por último, el profesor Usmani también advirtió a sus colegas: Los médicos no suelen tener conocimientos sobre los inhaladores porque no se enseñan en las universidades y escuelas superiores. En consecuencia, muchos no saben qué dispositivo es adecuado para cada tipo de paciente. De los más de 6.000 neumólogos y alergólogos, médicos generalistas, terapeutas respiratorios, enfermeros y farmacéuticos encuestados, sólo el 12% conocía las técnicas de aplicación correctas o cómo elegir los dispositivos adecuados. Además del desarrollo técnico y la formación de los pacientes, la autorreflexión de los médicos también es un factor en el camino hacia el uso óptimo de los inhaladores.
Congreso: Congreso ERS 2022
Literatura:
- Simposio: El futuro de la terapia inhalatoria en la EPOC. Congreso Internacional 2022 de la Sociedad Respiratoria Europea (ERS), Barcelona, 4.9.2022.
- Chrystyn H: Anatomía y fisiología en el parto: ¿podemos definir nuestros objetivos? Alergia 1999; 54: 82-87; doi: 10.1111/j.1398-9995.1999.tb04393.x.
- Usmani OS, Biddiscombe MF, Barnes PF: Deposición pulmonar regional y respuesta broncodilatadora en función del tamaño de las partículas de β2-agonistas. Am J Respir Crit Care Med 2005; 172: 1497-1504; doi: 10.1164/rccm.200410-1414OC.
- Informe GOLD 2022, p. 58; https://goldcopd.org/2022-gold-reports-2; última consulta: 9.11.2022.
- Leving M, Wouters H, de la Hoz A, et al: Impacto de la FPI, la técnica de inhalación y la adherencia a la medicación sobre el estado de salud y las exacerbaciones en la EPOC: protocolo de un estudio observacional en el mundo real (Estudio PIFotal EPOC). Pulm Ther 2021; 7(2): 591-606; doi: 10.1007/s41030-021-00172-7.
- Kocks JWH, Wouters H, Bosnic-Anticevich S, et al: Factores asociados al estado de salud y las exacerbaciones en el tratamiento de mantenimiento de la EPOC con inhaladores de polvo seco. npj Prim Care Respir Med 2022; doi: 10.1038/s41533-022-00282-y.
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2022; 4(4): 22-24 (publicado el 1.12.22, antes de impresión).











