La comprensión cada vez mejor de las relaciones patogenéticas del carcinoma de células renales ha contribuido al desarrollo de nuevos fármacos. Estos interfieren específicamente en las vías de señalización del VEGF, PDGF y mTOR. En los últimos años, también se han desarrollado terapias que dirigen el sistema inmunitario para combatir los tumores. ¿Dónde estamos hoy en el mRCC? ¿Qué dicen las directrices actuales?
El carcinoma de células renales es comparativamente raro en Suiza, con una incidencia de unos 950 casos y un 1,8% de muertes por cáncer al año. Los hombres se ven afectados con mucha más frecuencia que las mujeres (67,9% frente a 32,1%) y aproximadamente un tercio de los pacientes ya presentan metástasis locales o a distancia en el momento del diagnóstico [1]. En aproximadamente el 25% de los pacientes con enfermedad localizada se producen metástasis a distancia tras una nefrectomía curativa [2].
De los numerosos subtipos, el carcinoma de células renales de células claras es el más común, representando el 70-75% de los casos, y está asociado a la inactivación de los genes Von Hippel-Lindau (VHL), lo que conduce a un aumento de la actividad del factor inducido por la hipoxia (HIF) y, en última instancia, a la sobreexpresión del factor de crecimiento endotelial vascular (VEGF) y del factor de crecimiento derivado de las plaquetas (PDGF) [3,4]. La actividad de HIF también puede verse potenciada por la vía de señalización Mammalian Target of Rapamycin (mTOR) [5]. La comprensión de estas relaciones ha contribuido significativamente al desarrollo de nuevos fármacos que interfieren específicamente en las vías de señalización del VEGF, el PDGF y la mTOR (Fig. 1).
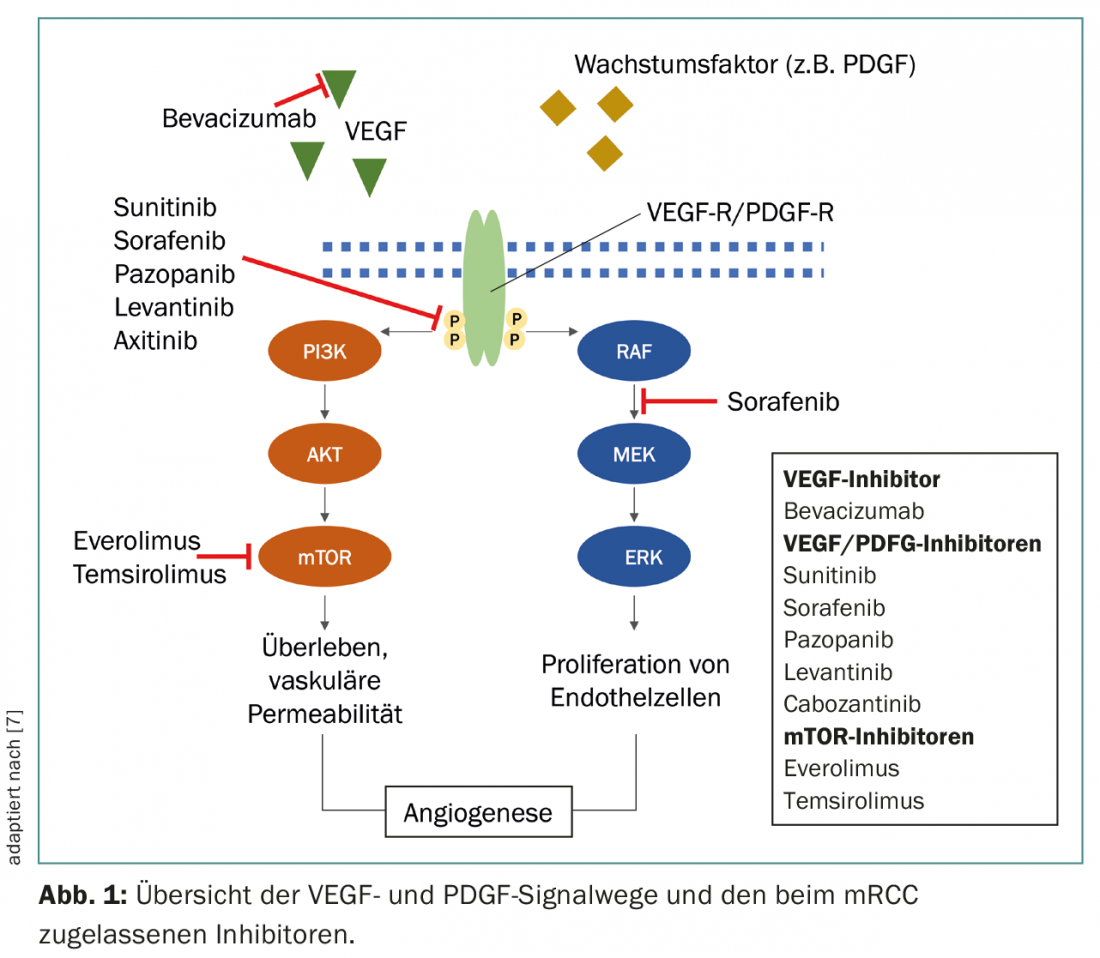
En los últimos años, también se han desarrollado terapias que dirigen el sistema inmunitario para combatir el tumor. La expresión de CTLA-4 y PD-1 por las células T activadas conduce a una reducción de la actividad de las células T en diferentes fases de la respuesta inmunitaria. El anticuerpo monoclonal (mAB) antiCTLA-4 ipilimumab y el mAB anti-PD-1 nivolumab ayudan a inducir una respuesta eficaz de las células T antitumorales mediante el bloqueo de estos receptores de punto de control [6].
Clasificación de los grupos de riesgo y directrices
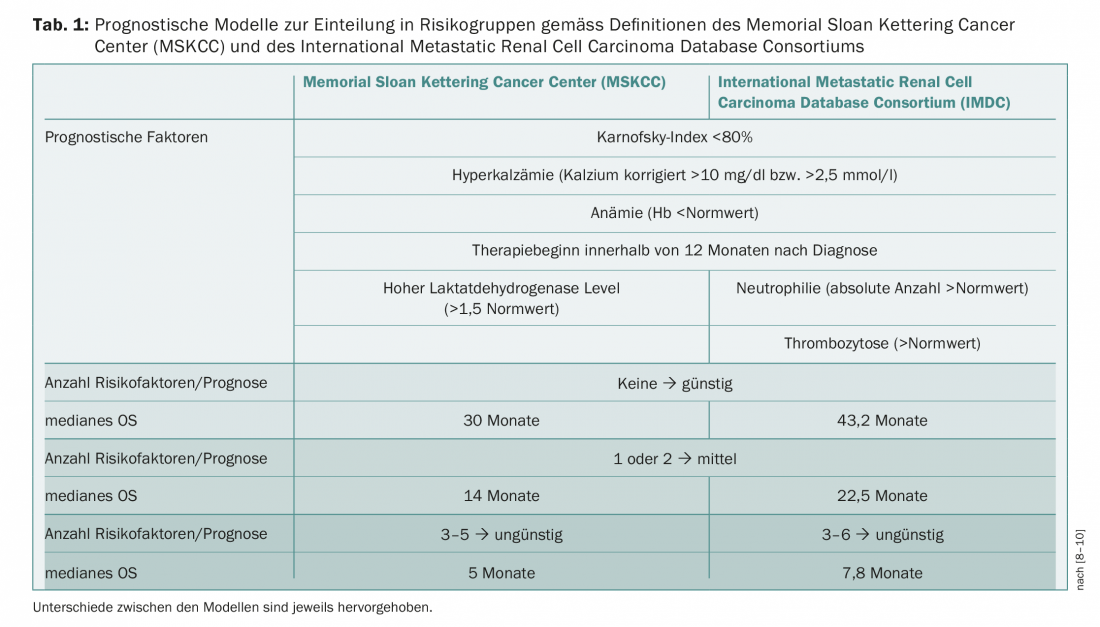
Los modelos de pronóstico y la clasificación de los pacientes en diferentes grupos de riesgo constituyen una base importante para las decisiones terapéuticas. Los criterios del Memorial Sloan Kettering Cancer Center (MSKCC) son anteriores al establecimiento de las terapias dirigidas [8]. Alternativamente, el Consorcio Internacional de la Base de Datos del Carcinoma Metastásico de Células Renales (IMDC) ha definido factores como base para la evaluación del riesgo [9,10]. Los dos sistemas difieren sólo en algunos puntos y dividen a los pacientes en grupos de riesgo favorable, intermedio y desfavorable (Tab. 1) . El tratamiento del CCRm ha estado en constante cambio desde la primera aprobación de una terapia dirigida (sunitinib, 2006). A principios de 2018 se publicaron nuevas directrices de la Asociación Europea de Urología (EAU) que, basándose en el estudio CheckMate-214, ya enumeran la terapia combinada con nivolumab/ipilimumab en pacientes con riesgo intermedio/desfavorable [11]. En el estudio, la combinación de nivolumab e ipilimumab logró una tasa de supervivencia a 1,5 años del 75% frente al 60% con sunitinib tras una mediana de seguimiento de 25,2 meses (HR 0,63, p<0,001). La mediana de la supervivencia sin progresión (SLP) fue de 11,6 meses en el grupo de nivolumab/ipilimumab y de 8,4 meses en el grupo de sunitinib; sin embargo, esta diferencia entre los brazos de tratamiento no fue estadísticamente significativa (HR 0,82, p=0,03) [12]. La tasa de respuesta objetiva fue del 42% frente al 27% (p<0,001) y la tasa de remisiones completas también fue mayor con la combinación de inmunoterapia (9%) que con sunitinib (1%). La terapia combinada ipilimumab/nivolumab ha sido aprobada recientemente en Suiza para el tratamiento del CCRm. Actualmente, la Asociación Suiza para la Investigación Clínica del Cáncer (SAKK) está llevando a cabo un ensayo de fase II con ipilimumab y nivolumab en primera o segunda línea de tratamiento (SAKK 07/17).
A continuación, se tratará principalmente la gestión de la terapia con los inhibidores de la tirosina quinasa (TKI) antiangiogénicos dirigidos y los inhibidores mTOR. La tabla 2 muestra una visión general de las directrices actuales centrándose en las sustancias aprobadas en Suiza.

La nefrectomía como tratamiento estándar en el CCRm
La nefrectomía ha sido una parte integral de la terapia del CCRm durante casi 20 años, ya que se ha demostrado que la cirugía previa a la terapia con interferón alfa (IFN-α) confiere un beneficio de supervivencia en comparación con el tratamiento con IFN-α solo [17,18]. Sin embargo, el papel de la nefrectomía en el contexto de las terapias antiangiogénicas dirigidas no ha quedado claro, aunque los estudios retrospectivos han tendido a confirmar el beneficio del procedimiento [19]. Los datos de la secuencia nefrectomía → sunitinib frente a sunitinib → nefrectomía (SURTIME) se presentaron en la ESMO 2017. Aunque el estudio se interrumpió antes de tiempo debido a la larga duración del reclutamiento de pacientes, puede utilizarse como fuente de datos prospectivos. No se mostraron diferencias en la mediana de la SLP a los 7 meses (42,0% frente a 42,9%, p>0,99) entre los grupos de tratamiento, pero sí una tendencia hacia una mejor supervivencia global (SG) en el grupo de cirugía secundaria (HR 0,57, IC 95% 0,34-0,95, p=0,032) [20]. Con el ensayo de fase III CARMENA, recientemente publicado, se dispone de datos prospectivos que demuestran la no inferioridad del tratamiento con sunitinib solo en comparación con la nefrectomía más sunitinib en pacientes de riesgo intermedio y desfavorable [21]. El estudio aleatorizó a 450 pacientes al tratamiento con nefrectomía/sunitinib o sunitinib. Los pacientes tratados sólo con sunitinib mostraron una mediana de SG más larga que el grupo de nefrectomía (18,4 frente a 13,9 meses, HR 0,89) y, en consecuencia, se cumplieron los criterios de no inferioridad del sunitinib [21]. Los autores concluyen que, aunque la nefrectomía puede ser útil para el control de los síntomas (macrohematuria, dolor renal), el tratamiento con un inhibidor del VEGF sin nefrectomía no presenta desventajas en términos de SG [21]. Si el riesgo es bajo, probablemente se seguirá optando por la nefrectomía para la mayoría de los pacientes en el futuro.
Elección de la terapia de primera línea
El sunitinib y el pazopanib son las terapias de primera línea más utilizadas en pacientes con riesgo favorable e intermedio, respectivamente [22]. Los datos del estudio CheckMate-214 y la aprobación de nivolumab/ipilimumab darán lugar a un cambio en el algoritmo terapéutico. También se esperan con interés los datos del ensayo IMmotion151 (atezolizumab y bevacizumab frente a sunitinib) sobre la supervivencia global . Sin embargo, la elección de la terapia de primera línea también se basa en las condiciones individuales de cada paciente y en cualquier comorbilidad [22]. El sunitinib duplicó con creces la mediana de la SLP (11 frente a 5 meses, HR 0,539, p<0,001) y alcanzó una mediana de la SG de más de dos años (26,4 frente a 21,8 meses, HR 0,821, p=0,051) en comparación con el IFN-α [23]. En el estudio de acceso expandido en condiciones reales, también se observó que el sunitinib tenía una mediana de SLP de 9,4 meses y una mediana de SG de 18,7 meses [24]. Tras más de diez años de experiencia, el sunitinib ha sustituido al IFN-α como tratamiento estándar de primera línea [25].
En el ensayo aleatorizado de fase III de no inferioridad COMPARZ, el pazopanib fue no inferior al sunitinib (9,5 meses) con una mediana de SLP de 8,4 meses (HR 1,05). La mediana de la SG también fue comparable entre las dos terapias (pazopanib: 28,3 meses, sunitinib 29,1 meses, HR 0,92), y la tasa de respuesta objetiva fue del 31% con pazopanib frente al 25% con sunitinib [26]. En un ensayo aleatorizado sobre la preferencia de los pacientes (PICES), el pazopanib obtuvo resultados estadísticamente significativos mejores que el sunitinib [27]. Como otra opción en la terapia de primera línea, se observó una mejora de 3,3 meses en la mediana de la SLP con la combinación de bevacizumab con IFN-α en comparación con IFN-α (8,5 frente a 5,2 meses, HR 0,71) [28]. En los pacientes con riesgo desfavorable, también se observó una prolongación significativa de la mediana de la SG con temsirolimus frente a IFN-α (10,9 frente a 7,3 meses, HR 0,73) [29].
Elección de la terapia de segunda línea y tratamientos de seguimiento
Además de la duración de la respuesta a la terapia de primera línea, la sintomatología del paciente y las comorbilidades existentes, las toxicidades individuales previas también influyen en la elección de la terapia de segunda línea [22,30]. Los pacientes que han experimentado efectos secundarios graves o pérdidas de calidad de vida con su terapia anterior pueden, por tanto, beneficiarse de un cambio de clase de fármaco [22]. Por ejemplo, la diabetes tipo 2 mal controlada puede empeorar con el uso de un inhibidor de mTOR, la enfermedad cardiovascular puede ser un factor de riesgo en el contexto de las terapias anti-VEGF y las enfermedades autoinmunes existentes deben tenerse en cuenta en el contexto de las terapias basadas en inhibidores de puntos de control [31–33].
En el ensayo de fase III AXIS, se logró una mediana de SLP (HR 0,66, p<0,0001) y una mediana de SG significativamente más largas con axitinib frente a sorafenib en la segunda línea de tratamiento (20,1 meses frente a 19,2 meses, HR 0,97, p=0,37) [34]. Además, en comparación con el everolimus, tanto el cabozantinib en el ensayo de fase III METEOR (21,4 frente a 17,1 meses, HR 0,70, p=0,0002) como el nivolumab en el ensayo de fase III CheckMate-025 (25,0 frente a 19,6 meses, HR 0,73, IC del 98,5% 0,57-0,93, p=0,002) condujeron a una mejora significativa de la mediana de SG [35,36]. Sin embargo, no se demostró ningún beneficio en la SLP con nivolumab (4,6 frente a 4,4 meses, HR 0,88, p=0,11) [36]. La combinación de lenvatinib y everolimus dio lugar a una prolongación significativa de la mediana de la SLP en comparación con everolimus (14,6 frente a 5,5 meses, HR 0,40, p=0,0005), pero asociada a toxicidades [37,38].
Terapia y gestión de los efectos secundarios
El éxito del tratamiento en el CCRm depende de la elección de la terapia, pero también de la gestión de los efectos secundarios.
En el estudio COMPARZ, se observaron diferentes perfiles de efectos secundarios con sunitinib y pazopanib, lo que puede influir en la elección individual de la sustancia [26]. La fatiga, el síndrome mano-pie y la mucositis oral aumentaron en el brazo de sunitinib y la alteración de los niveles de enzimas hepáticas y la pérdida de peso aumentaron en el brazo de pazopanib. La terapia del estudio se interrumpió con más frecuencia en el grupo de pazopanib que en el de sunitinib debido a efectos adversos [26].
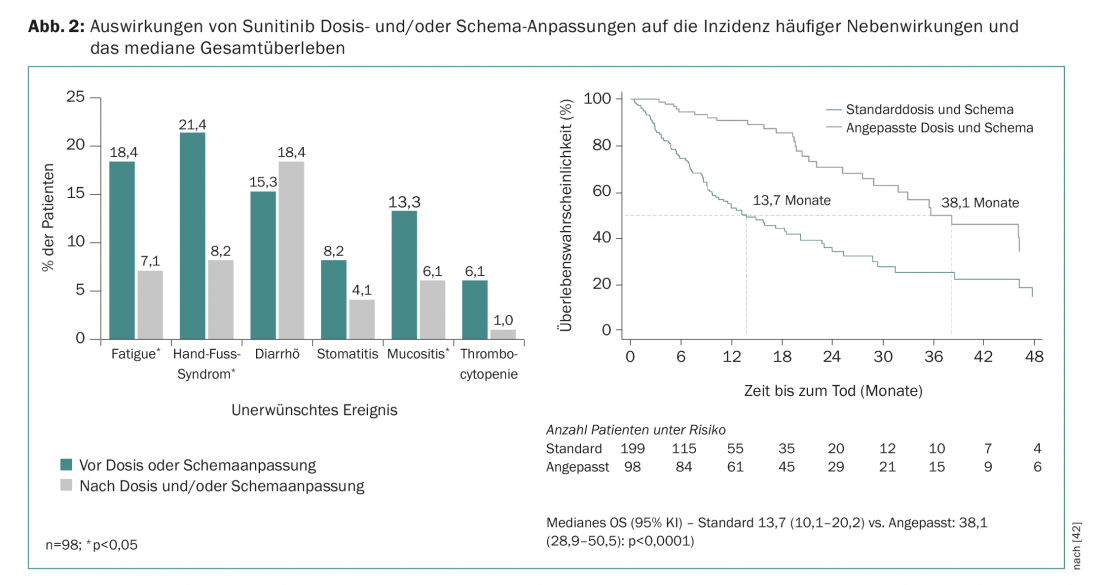
Los análisis farmacológicos retrospectivos indican que una mayor exposición al sunitinib se asocia a mejores resultados clínicos, pero también a una mayor tasa de acontecimientos adversos [39]. Actualmente se sabe por diversos estudios que ajustar el régimen de tratamiento con sunitinib de “4 semanas de terapia/2 semanas de descanso (4/2)” a “2 semanas de terapia/1 semana de descanso (2/1)” puede ayudar a reducir los efectos adversos más comunes sin comprometer la eficacia de la terapia [40,41]. Esto también lo confirman los datos del registro prospectivo y real STAR-TOR en Alemania. Los ajustes de la dosis y/o del régimen durante el tratamiento con sunitinib dieron lugar a una reducción de los acontecimientos adversos comunes (excepto la diarrea) y a una mejora de la mediana de la SG (Fig. 2) [42]. Los ajustes de dosis también son frecuentemente necesarios y comunes durante el tratamiento con pazopanib [43].
Outlook
Con la ahora amplia gama de opciones de tratamiento en el CCRm y los agentes adicionales que se esperan, la cuestión de la elección y secuencia óptimas del tratamiento sigue siendo un tema clave. Por ejemplo, la cohorte EuroTARGET está evaluando diferentes biomarcadores para personalizar la terapia del CCRm utilizando datos de pacientes tratados con sunitinib, pazopanib o sorafenib [44]. En el futuro, la gestión proactiva e individualizada de la terapia y los efectos secundarios también tendrá una influencia significativa en los resultados clínicos.
Mensajes para llevarse a casa
- En el riesgo intermedio/desfavorable, la nefrectomía paliativa primaria no ha mostrado una ventaja sobre la terapia primaria anti-VEGF en términos de supervivencia global. Si el riesgo es favorable, la nefrectomía citorreductora primaria sigue siendo la norma.
- En la terapia de primera línea, el sunitinib y el pazopanib se recomiendan para el riesgo favorable/intermedio, mientras que el temsirolimus puede utilizarse para el riesgo desfavorable o la histología no celular.
- Se puede utilizar nivolumab/ipilimumab si los costes están aprobados o dentro del estudio SAKK 07/17 y ahora también está aprobado en Suiza. El cabozantinib, por su parte, aún no cuenta con la aprobación para la primera línea.
- El tratamiento de segunda línea depende de diversos factores individuales, así como de la respuesta y las toxicidades durante la terapia de primera línea.
- Ajustar el régimen de tratamiento con sunitinib de “4 semanas de terapia/2 semanas de descanso (4/2)” a “2 semanas de terapia/1 semana de descanso (2/1)” puede ayudar a mejorar la tolerabilidad sin pérdida de eficacia del tratamiento.
Literatura:
- Krebsliga Schweiz: El cáncer en Suiza: cifras importantes. Estado Oct. 2017 www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf
- Choueiri TK, Motzer RJ: Terapia sistémica para el carcinoma de células renales metastásico. New England Journal of Medicine 2017; 376(4): 354-366.
- Clark PE: El papel de VHL en el carcinoma de células renales de células claras y su relación con la terapia dirigida. Kidney international 2009; 76(9): 939-945.
- Nickerson ML, et al: Identificación mejorada de las alteraciones del gen von Hippel-Lindau en los tumores renales de células claras. Investigación clínica del cáncer 2008; 14(15): 4726-4734.
- Thomas GV, et al: El factor inducible por hipoxia determina la sensibilidad a los inhibidores de mTOR en el cáncer de riñón. Nature medicine 2006; 12(1): 122-127.
- Sathianathen NJ, et al: Estado actual de las terapias inmunobásicas para el carcinoma metastásico de células renales. InmunoObjetivos y Terapia 2017; 6: 83-93.
- Rini BI, Small EJ: Biología y desarrollo clínico de la terapia dirigida al factor de crecimiento endotelial vascular en el carcinoma de células renales. Revista de Oncología Clínica 2005; 23(5): 1028-1043.
- Motzer RJ, Bacik J, Murphy BA, Russo P Mazumdar M: Interferón-Alfa como tratamiento comparativo para ensayos clínicos de nuevas terapias contra el carcinoma avanzado de células renales. Revista de Oncología Clínica 2002; 20(1): 289-296.
- Heng DYC, et al: Validación externa y comparación con otros modelos del modelo pronóstico del Consorcio Internacional de la Base de Datos del Carcinoma Metastásico de Células Renales: un estudio basado en la población. Lancet. Oncología 2013; 14(2): 141-148.
- Heng DYC, et al: Factores pronósticos de la supervivencia global en pacientes con carcinoma metastásico de células renales tratados con agentes dirigidos al factor de crecimiento endotelial vascular: resultados de un amplio estudio multicéntrico. Revista de Oncología Clínica 2009; 27(34): 5794-5799.
- Powles T, et al: Recomendaciones actualizadas de las directrices de la Asociación Europea de Urología para el tratamiento del cáncer renal metastásico de células claras de primera línea. Urología europea 2017.
- Motzer RJ, et al: Nivolumab más ipilimumab frente a sunitinib en el carcinoma avanzado de células renales. New England Journal of Medicine 2018; 378(14): 1277-1290.
- Directriz S3 Diagnóstico, terapia y seguimiento del carcinoma de células renales. Versión larga 1.2 – abril de 2017, número de registro AWMF: 043/017-OL.
- Escudier B, et al: Carcinoma de células renales: Guía de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimiento†. Anales de Oncología 2016; 27(5): v58-v68.
- NCCN: National Comprehensive Cancer Network Clinical Practice Guidelines in Oncology – Kidney Cancer Version 3.2018. NCCN.org Feb. 6 2018.
- www.swissmedicinfo.ch.
- Flanigan RC, et al: Nefrectomía seguida de interferón alfa-2b en comparación con interferón alfa-2b solo para el cáncer de células renales metastásico. New England Journal of Medicine 2001; 345(23): 1655-1659.
- Mickisch GH, Garin A, et al: Nefrectomía radical más inmunoterapia basada en interferón alfa comparada con interferón alfa solo en el carcinoma metastásico de células renales: un ensayo aleatorizado. Lancet 2001; 358(9286): 966-970.
- Culp SH: La nefrectomía citorreductora y su papel en el periodo actual de la terapia dirigida. Ther Adv Urol 2015; 7(5): 275-285.
- Bex A, et al: Nefrectomía citorreductora inmediata frente a diferida en pacientes con carcinoma metastásico de células renales (CCRm) sincrónico que reciben sunitinib (EORTC 30073 SURTIME. Anales de Oncología 2017; 28(5): v605-v649; doi: 10.1093/annonc/mdx440.
- Mejean A, et al: Sunitinib solo o tras nefrectomía en el carcinoma de células renales metastásico. The New England journal of medicine 2018. doi: 10.1056/NEJMoa1803675
- Osorio JC, et al: Optimización de los enfoques de tratamiento en el cáncer renal avanzado. Oncología 2017; 31(12): 919-926, 928-930.
- Motzer RJ, et al: Supervivencia global y resultados actualizados del sunitinib en comparación con el interferón alfa en pacientes con carcinoma metastásico de células renales. Revista de Oncología Clínica 2009; 27(22): 3584-3590.
- Gore ME, et al: Resultados finales del gran ensayo global de acceso ampliado con sunitinib en el carcinoma metastásico de células renales. Revista británica del cáncer 2015; 113(1): 12-19.
- Motzer RJ, et al: Sunitinib: Diez años de uso clínico y estudio con éxito en el carcinoma avanzado de células renales. The Oncologist 2017; 22(1): 41-52.
- Motzer RJ, et al: Pazopanib frente a sunitinib en el carcinoma metastásico de células renales. New England Journal of Medicine 2013; 369(8): 722-731.
- Escudier B, et al: Randomized, Controlled, Double-Blind, Cross-Over Trial Assessing Treatment Preference for Pazopanib Versus Sunitinib in Patients With Metastatic Renal Cell Carcinoma: PISCES Study. Revista de Oncología Clínica 2014; 32(14): 1412-1418.
- Rini BI, et al: Bevacizumab más interferón alfa en comparación con monoterapia con interferón alfa en pacientes con carcinoma metastásico de células renales: CALGB 90206. Journal of Clinical Oncology 2008; 26(33): 5422-5428.
- Hudes G, et al: Temsirolimus, interferón alfa o ambos para el carcinoma de células renales avanzado. New England Journal of Medicine 2007; 356(22): 2271-2281.
- Fischer S, et al: Secuencia de tratamiento en el carcinoma de células renales localmente avanzado y metastásico. Andrología y urología traslacional 2015; 4(3): 310-325.
- Johnson DB, et al: Terapia con inhibidores de puntos de control inmunitario en pacientes con enfermedades autoinmunes. Oncología 2018; 32(4): 190-194.
- Morviducci L, et al.: Everolimus es una nueva molécula contra el cáncer: efectos secundarios metabólicos como trastornos lipídicos e hiperglucemia. Investigación y práctica clínica de la diabetes 2018.
- Schmidinger M, et al.: Toxicidad cardiaca del sunitinib y el sorafenib en pacientes con carcinoma metastásico de células renales. Revista de oncología clínica : revista oficial de la Sociedad Americana de Oncología Clínica 2008; 26(32): 5204-5212.
- Rini BI, et al: Eficacia comparativa del axitinib frente al sorafenib en el carcinoma avanzado de células renales (AXIS): un ensayo aleatorizado de fase 3. Lancet 2011; 378(9807): 1931-1939.
- Motzer RJ, et al: Seguimiento a largo plazo de la supervivencia global del cabozantinib frente al everolimus en el carcinoma avanzado de células renales. Revista británica del cáncer 2018; 118(9): 1176-1178.
- Motzer RJ, et al: Nivolumab frente a everolimus en el carcinoma avanzado de células renales. The New England journal of medicine 2015; 373(19): 1803-1813.
- Motzer RJ, et al: Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, open-label, multicentre trial. Lancet Oncol 2015; 16(15): 1473-1482.
- Rothermundt C, et al.: Tratamiento de segunda línea para el cáncer renal metastásico de células claras: algoritmos de consenso de expertos. Revista mundial de urología 2017; 35(4): 641-648.
- Houk BE, et al.: Relación entre la exposición al sunitinib y los criterios de valoración de eficacia y tolerabilidad en pacientes con cáncer: resultados de un metaanálisis farmacocinético/farmacodinámico. Quimioterapia y Farmacología del Cáncer 2009; 66(2): 357-371.
- Atkinson BJ, et al: Resultados clínicos en pacientes con carcinoma de células renales metastásico tratados con esquemas alternativos de sunitinib. The Journal of Urology 2014; 191(3): 611-618.
- Najjar YG, et al: Un esquema de 2 semanas de inicio y 1 semana de fin del sunitinib se asocia a una menor toxicidad en el carcinoma metastásico de células renales. Revista Europea del Cáncer 2014; 50(6): 1084-1089.
- Boegemann M, et al.: Modificación del tratamiento con sunitinib en el carcinoma metastásico de células renales (CCRm) de primera línea (1L): Un análisis del registro STAR-TOR. Revista de oncología clínica 2018; 36(6_suppl): 602-602.
- Iacovelli R, et al: Resultado clínico de los pacientes que redujeron el sunitinib o el pazopanib durante el tratamiento de primera línea para el cáncer de riñón avanzado. Oncología urológica 2017; 35(9): 541.e547-541.e513.
- van der Zanden LFM, et al: Descripción de la cohorte EuroTARGET: A European collaborative project on TArgeted therapy in renal cell cancer-GEnetic- and tumour-related biomarkers for response and toxicity. Oncología urológica 2017; 35(8): 529.e529-529.e516.
InFo ONcOLOGíA & HEMATOLOGíA 2018; 6(4): 17-22.











