El estrechamiento de la válvula aórtica es el defecto valvular adquirido más frecuente y se corrige mediante AKE o TAVI. Sin embargo, a pesar de los avances en la terapia, a menudo se producen problemas de ritmo. ¿Qué hacer?
En Suiza, miles de pacientes se someten cada año a una sustitución quirúrgica de la válvula aórtica (SVA) o a una implantación transcatéter de la válvula aórtica (TAVI). En la mayoría de los casos, la indicación primaria es la estenosis calcificante de la válvula aórtica, que afecta al 3-5% de la población mayor de 75 años [1].
Las taquiarritmias, en particular la fibrilación auricular (FA) y los trastornos de la conducción auriculoventricular (AV), sobre todo el bloqueo de rama izquierda del haz de His (BRI) y el bloqueo AV de grado superior, se encuentran entre los problemas de ritmo más frecuentes antes, durante y después de un LCE quirúrgico o un TAVI. Estas arritmias aumentan tanto la morbilidad como la mortalidad, provocan estancias hospitalarias prolongadas e incrementan los costes.
El impacto clínico de estas arritmias en pacientes con vitium de la válvula aórtica es variado y el espectro de síntomas va desde la ausencia total de síntomas y molestias, pasando por palpitaciones ocasionales, fatiga, mareos, disnea o dolor torácico, hasta insuficiencia cardiaca grave clínicamente manifiesta, síncope, shock cardiogénico y muerte.
Fibrilación auricular – ¡Busque y encontrará!
La fibrilación auricular es la arritmia cardiaca más frecuente, con un fuerte aumento de su prevalencia con la edad: en personas mayores de 80 años, la prevalencia supera ya el 10% [1]. La prevalencia también aumenta en la insuficiencia renal, la EPOC, la insuficiencia cardiaca y en pacientes tras una intervención valvular (Fig. 1) [2]. En pacientes con estenosis grave de la válvula aórtica, esta prevalencia vuelve a aumentar de forma significativa y, según la literatura, es del 8-13% antes de la ECA quirúrgica y del 16-51% antes de la TAVI [3].
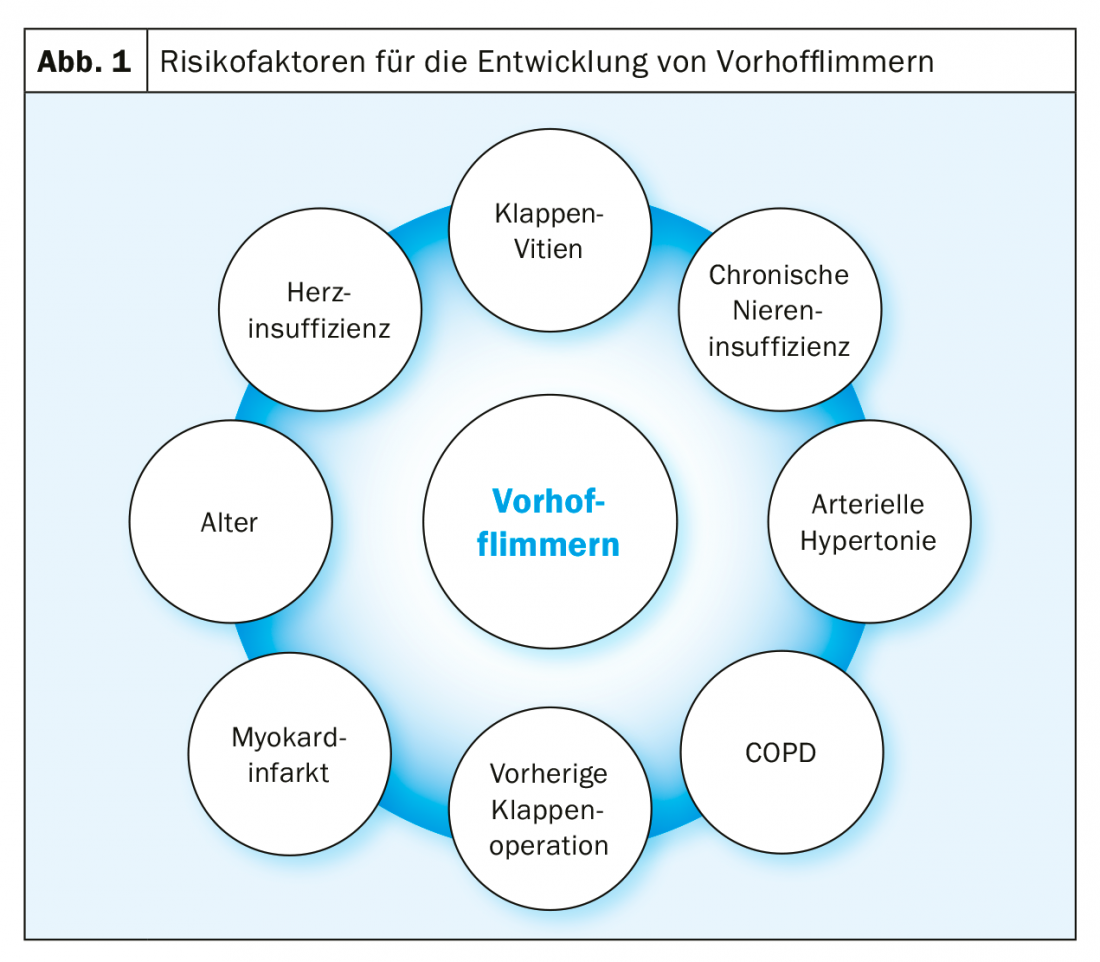
Esta prevalencia tan elevada de la FVC en la estenosis grave de la válvula aórtica se debe, por un lado, a la coincidencia de los factores de riesgo de ambas enfermedades: en general, los pacientes con estenosis grave de la válvula aórtica son en su mayoría muy ancianos. Por otro lado, el propio vitium también provoca cambios hemodinámicos, que dan lugar a una carga de presión en la aurícula izquierda y a una fibrosis consecutiva de la aurícula izquierda con cambios también eléctricos de las aurículas. En general, esta transformación del sustrato favorece la aparición de VHF (Fig. 2).
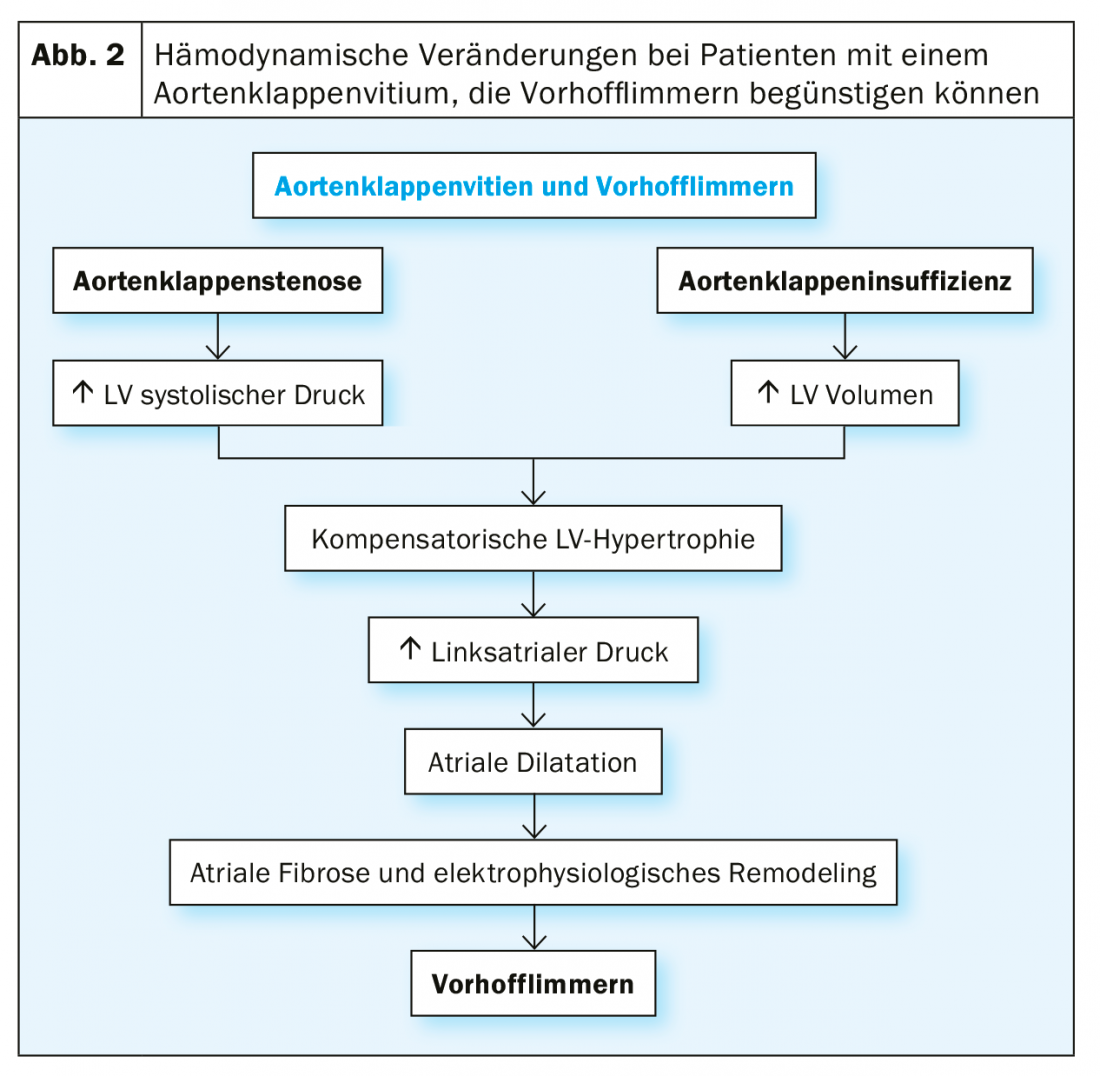
Especialmente en la ECA quirúrgica, se genera un estado hiperadrenérgico periintervencionista y se induce una respuesta inflamatoria cardiaca por el traumatismo quirúrgico, que se considera en parte responsable del desarrollo de la FVC periintervencionista.
Incluso después de una AKE quirúrgica o una TAVI, la VHF es la arritmia de nuevo diagnóstico más frecuente. La incidencia depende en gran medida del método de cribado utilizado: cuanto más prolongado es el seguimiento del ritmo, más frecuentemente se detecta el FVC.
En general, se describen altas tasas de incidencia de FVC tras la ECA quirúrgica y la TAVI (31-64% y 4-32%, respectivamente) [4]. Un estudio publicado recientemente por Kalra et al, en el que se analizaron los datos de 171.480 pacientes tras LCE quirúrgico y TAVI, halló una tasa de incidencia de FVC de aproximadamente el 50% en ambos grupos [2]. En el importante ensayo NOTION, 52 pacientes fueron monitorizados de forma continua mediante un registrador de eventos tras una AKE quirúrgica o una TAVI [4]. La incidencia de la VCVA fue del 100% tras la LCE quirúrgica y del 82% tras la TAVI. Tras la AKE quirúrgica, el nuevo diagnóstico de FA se produjo en los primeros 61 días en todos los pacientes y tras la TAVI en los primeros 41 días. La carga de arritmias en las 2 primeras semanas tras la AKE quirúrgica y la TAVI fue significativamente mayor (2,8%) en los pacientes tras la AKE quirúrgica en comparación con el 0,04% tras la TAVI (p=0,01). Sin embargo, la carga de arritmias disminuyó significativamente a los 3 meses en los pacientes tras una SLF quirúrgica [4].
Es probable que muchos de estos pacientes tuvieran una FVC preexistente pero asintomática. El infradiagnóstico de la FA asintomática es un problema general y no sólo afecta a los pacientes con estenosis grave de la válvula aórtica.
Un nuevo diagnóstico de FVC tras una ECA quirúrgica o una TAVI conlleva una prolongación de la hospitalización en comparación con los pacientes sin FVC (9 frente a 6 días para ambos grupos; p<0,001) [2]. En estos pacientes también se observa un aumento significativo de la mortalidad durante la hospitalización tras la ECA quirúrgica y la TAVI en comparación con los pacientes sin VCVA recién diagnosticada. Además, la mortalidad a 1 año de los pacientes con FVC incisional tras TAVI aumenta significativamente en comparación con los pacientes sin FVC recién diagnosticada (31% frente a 14%; p<0,01) [5].
La anticoagulación oral para la profilaxis de la tromboembolia debe utilizarse en todos los pacientes con FVC y riesgo aumentado de tromboembolia.
Trastornos de la conducción AV y necesidades de marcapasos
Los factores de riesgo más importantes de los trastornos de la conducción AV son la edad, la insuficiencia cardiaca, la cardiopatía coronaria, la hipertensión arterial y la diabetes mellitus [6]. Por lo tanto, no es sorprendente que las alteraciones de la conducción AV sean muy frecuentes en los pacientes, por lo general bastante mayores, con estenosis grave de la válvula aórtica: en el 10-20% de los pacientes que reciben una AKE quirúrgica o una TAVI, ya se ha implantado previamente un marcapasos [7]. Otros factores de riesgo de alteración de la conducción AV tras una TAVI son, en particular, el bloqueo completo de rama derecha del haz y el bloqueo AV de primer grado (Fig. 3).
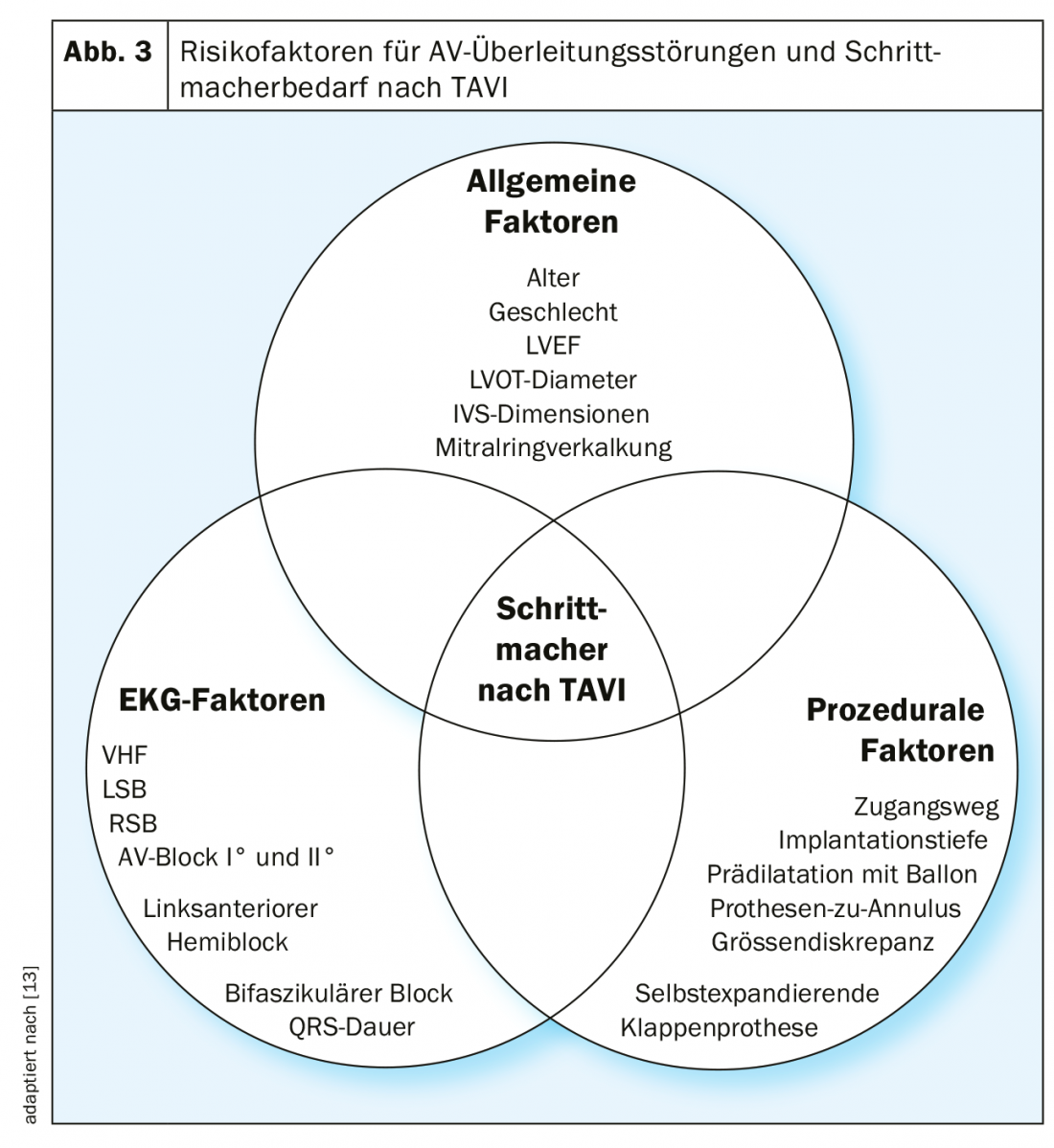
El desarrollo de trastornos de la conducción AV durante y después de la AKE quirúrgica o la TAVI también se debe a la estrecha relación anatómica de la válvula aórtica con el sistema de conducción. Así, el fascículo izquierdo discurre de forma relativamente superficial directamente por debajo de la válvula aórtica en el tracto de salida del ventrículo izquierdo. La compresión mecánica de esta región por una válvula aórtica profundamente implantada durante una TAVI, o la lesión de esta región durante una AKE quirúrgica, provocará un bloqueo de rama izquierda o incluso un bloqueo AV completo, este último especialmente en presencia de un bloqueo de rama derecha preexistente.
Si existe una válvula aórtica bicúspide o una estenosis de la válvula aórtica gravemente calcificada, también se observa una mayor prevalencia de anomalías de la conducción AV y de necesidad de marcapasos debido a la necesidad de un desbridamiento extenso.
La incidencia de defectos de conducción AV tras TAVI también depende del modelo de válvula implantada. En general, es mayor con las prótesis valvulares autoexpandibles que con los modelos expandibles con balón. El tamaño del anillo de la válvula aórtica en relación con el diámetro de la válvula protésica también influye, junto con la profundidad de implantación.
Los defectos de conducción auriculoventricular suelen producirse durante la implantación de la válvula o poco después, pero también pueden aparecer unos días después de la TAVI [8]. Esto último dificulta el manejo de estos pacientes y conduce a una indicación mucho más liberal para la implantación de marcapasos tras TAVI en comparación con la AKE quirúrgica. En cambio, tras la ECA quirúrgica, en caso de bloqueo AV completo, se espera hasta una semana y sólo se implanta un marcapasos si el bloqueo AV no se recupera.
La incidencia de bloqueo de rama izquierda del haz de His tras una AKE quirúrgica es del 3-4% y la incidencia de bloqueo AV completo persistente con necesidad de marcapasos es del 3-12% [8,9]. Por el contrario, la incidencia de bloqueo de rama izquierda tras TAVI es del 18-65% para las válvulas protésicas autoexpandibles y del 4-30% para las válvulas protésicas expandibles con balón [10]. Se reimplanta un marcapasos en el 25-28% de los pacientes tras una TAVI con una válvula protésica autoexpandible y en el 5-7% de los pacientes que han recibido una válvula protésica expandible con balón [10].
Es intuitivo suponer que el bloqueo completo de rama izquierda es desfavorable desde el punto de vista pronóstico debido a la disincronía ventricular asociada, especialmente en presencia de una función ventricular izquierda deteriorada concomitante. Del mismo modo, un nuevo bloqueo iatrogénico de rama izquierda del haz conlleva un riesgo de progresión de la alteración de la conducción AV a bloqueo AV completo.
En un metaanálisis, Regueiro et al. describen. en pacientes con un nuevo bloqueo de rama izquierda tras TAVI, una mayor tasa de implantación de marcapasos (RR 2,18; IC 95%, 1,28-3,70; p<0,01), una mayor mortalidad cardiaca (RR 1,39; IC 95%, 1,04-1,86; p=0,03) y un efecto negativo en la función de bombeo del ventrículo izquierdo durante el primer año tras el TAVI en comparación con los pacientes sin bloqueo nuevo de rama izquierda. [11]. Sin embargo, los datos son contradictorios a este respecto: otro metaanálisis, por ejemplo, no logró demostrar un aumento de la mortalidad en pacientes con un nuevo bloqueo de rama izquierda tras TAVI [12].
Proporcionar a los pacientes adecuados un marcapasos en el momento oportuno tras una TAVI sigue siendo un reto clínico difícil.
Literatura:
- Go AS, Hylek EM, Phillips KA, et al: Prevalencia de la fibrilación auricular diagnosticada en adultos. Jama 2001; 285: 2370.
- Kalra R, Patel N, Doshi R, et al: Evaluación de la incidencia de fibrilación auricular de nueva aparición tras la sustitución de la válvula aórtica. JAMA Intern Med 2019; 35294: 1-9.
- Tarantini G, Mojoli M, Ureña M, Vahanian A: Fibrilación auricular en pacientes sometidos a implantación de válvula aórtica transcatéter: epidemiología, momento, predictores y resultado. Eur Heart J 2017; 38: 285-293.
- Jørgensen TH, Thyregod HGH, Tarp JB, et al: Temporal changes of new-onset atrial fibrillation in patients randomized to surgical or transcatheter aortic valve replacement. Int J Cardiol Elsevier B.V.; 2017; 234: 16-21.
- Stortecky S, Buellesfeld L, Wenaweser P, et al: Fibrilación auricular y estenosis aórtica. Circ Cardiovasc Interv 2013; 6: 77-84.
- Kerola T, Eranti A, Aro AL, et al: Factores de riesgo asociados al bloqueo auriculoventricular. JAMA Netw open 2019; 2: e194176.
- Franzone A, Windecker S: El enigma de la implantación de un marcapasos permanente tras la implantación de una válvula aórtica transcatéter. Circ Cardiovasc Interv 2017; 10: 1-4.
- Roten L, Stortecky S, Scarcia F, et al: Conducción auriculoventricular tras la implantación de la válvula aórtica transcatéter y la sustitución quirúrgica de la válvula aórtica. J Cardiovasc Electrophysiol 2012; 23: 1115-1122.
- Khounlaboud M, Flécher E, Fournet M, et al: Predictors and prognostic impact of new left bundle branch block after surgical aortic valve replacement. Arch Cardiovasc Dis Elsevier Masson SAS; 2017; 110: 667-675.
- Auffret V, Puri R, Urena M, et al: Alteraciones de la conducción tras la sustitución percutánea de la válvula aórtica: estado actual y perspectivas de futuro. Circulation 2017; 136: 1049-1069.
- Regueiro A, Altisent OAJ, Trigo M Del, et al: Impact of new-onset left bundle branch block and periprocedural permanent pacemaker implantation on clinical outcomes in patients undergoing transcatheter aortic valve replacement. Circ Cardiovasc Interv 2016; 9: 1-10.
- Ando T, Takagi H: The Prognostic Impact of New-Onset Persistent Left Bundle Branch Block Following Transcatheter Aortic Valve Implantation: A Meta-analysis. Clin Cardiol 2016; 39: 544-550.
- Siontis GCM, Jüni P, Pilgrim T, et al: Predictors of Permanent Pacemaker Implantation in Patients With Severe Aortic Stenosis Undergoing TAVR. J Am Coll Cardiol Elsevier Inc; 2014; 64: 129-140.
CARDIOVASC 2019; 18(5): 10-12