En 2018, aproximadamente 10 millones de personas contrajeron la tuberculosis y 1,45 millones murieron. Un reto cada vez mayor es el cuidado de los pacientes con tuberculosis multirresistente (MDR-TB), para los que los dos fármacos más importantes en la terapia permanente de la tuberculosis -la isoniazida y la rifampicina- han perdido su eficacia.
En 2018, aproximadamente 10 millones de personas contrajeron la tuberculosis y 1,45 millones murieron. Un reto cada vez mayor es el cuidado de los pacientes con tuberculosis multirresistente (MDR-TB), para los que los dos principales fármacos utilizados en la terapia permanente de la tuberculosis -la isoniazida y la rifampicina- han perdido su eficacia. Probablemente, la farmacocinética diferente de los fármacos antituberculosos es la causa no infrecuente de la farmacorresistencia [1]. Sin embargo, en las regiones con una elevada proporción de TB-MDR en los nuevos diagnósticos, también se está observando con creciente frecuencia la transmisión directa de los patógenos MDR [2]. La terapia es larga y puede estar plagada de efectos secundarios, por lo que se necesita un equipo interdisciplinar y experimentado para gestionar el tratamiento. Según el informe anual de la Organización Mundial de la Salud (OMS), el éxito del tratamiento de la forma multirresistente de la tuberculosis es actualmente de sólo el 55-56% en todo el mundo [2,3]. La baja tasa de detección de casos de TB-MDR en todo el mundo sigue siendo problemática. Antes de tomar una decisión terapéutica sensata, debe disponerse de diagnósticos con cuya ayuda, si es posible, puedan determinarse todas las resistencias farmacológicas relevantes. Por ejemplo, de los 500.000 nuevos casos de TB-MDR estimados para 2018, sólo se diagnosticaron y notificaron 187.000. El número de casos que pudieron ser tratados fue correspondientemente bajo, 156.000. Dado que, según las estadísticas de la OMS, sólo alrededor de la mitad de ellos completan con éxito el tratamiento, más del 80% de los casos estimados de MDR permanecen incontrolados y contribuyen a la propagación de la enfermedad [2].
En Alemania, se notificaron 118 casos con TB-MDR en 2018, lo que corresponde a una cuota estable del 3,1% de los nuevos diagnósticos en los últimos años. En el informe de 2019 del Instituto Robert Koch (RKI), los resultados del tratamiento de los casos de tuberculosis MDR de 2017 están disponibles y sólo se pudo documentar el éxito del tratamiento en el 39% de los pacientes [4]. La fecha límite para la evaluación de estos resultados de tratamiento transmitidos al RKI fue el 1 de marzo de 2019. Sin embargo, en casi el 45% de los pacientes, la terapia no se había completado en el momento de la evaluación y, por lo tanto, se desconocía el resultado de la misma. Según la Oficina Federal de Salud Pública, en Suiza se diagnosticaron siete casos de TB-MDR en 2018 y diez casos en 2019 (Oficina Federal de Salud Pública, comunicación personal).
A continuación se explican con más detalle las recomendaciones de la OMS sobre el diagnóstico y el tratamiento de la tuberculosis farmacorresistente, que han cambiado significativamente en 2019 y 2020.
Diagnóstico
En los pacientes en los que se sospeche tuberculosis pulmonar por síntomas típicos o por una radiografía de tórax llamativa, deben examinarse al menos 2 muestras de esputo de buena calidad en busca de micobacterias según las recomendaciones de la OMS [5,6]. En los últimos años, las pruebas de amplificación de ácidos nucleicos (NAAT) para las formas pulmonares y extrapulmonares de la tuberculosis han adquirido la mayor importancia en el diagnóstico inicial. Las NAAT permiten distinguir el complejo M. tuberculosis de las micobacterias no tuberculosas (MNT). Con métodos automatizados como el Xpert® MTB/RIF, se puede esperar un resultado de la prueba para la identificación del patógeno y la resistencia a la rifampicina tras sólo unas horas. La nueva versión del Xpert® MTB/RIF Ultra mostró una sensibilidad global mejorada en comparación con la versión anterior (90% frente a 85% [6]), especialmente en la tuberculosis pulmonar paucibacilar sin detección microscópica de micobacterias (sensibilidad 77% frente a 67% [7]). Sin embargo, esta mejora vino acompañada de un deterioro de la especificidad (96% frente a 99% [6]). Especialmente en pacientes con antecedentes de tuberculosis en los últimos 5 años, es posible que aumenten los resultados falsos positivos [7].
La microscopia del esputo para detectar bacilos ácido-alcohol resistentes da una indicación de la carga bacteriana del esputo y, por tanto, del riesgo de infección. Sin embargo, la transmisión también es posible con microscopía negativa y NAAT positiva [8]. Siempre que se sospeche una tuberculosis, debe buscarse un cultivo del patógeno. Actualmente, el cultivo sigue siendo la norma para el diagnóstico de la tuberculosis. En comparación con los medios de cultivo sólidos, el cultivo líquido tiene una sensibilidad algo mayor, y el crecimiento de las micobacterias puede detectarse unas dos semanas antes gracias a este método.
Diagnóstico de la farmacorresistencia
A pesar de los retos metodológicos, las pruebas de resistencia cultural o fenotípica siguen siendo actualmente muy valoradas para la toma de decisiones terapéuticas clínicas en Alemania y Suiza [9]. Las pruebas de resistencia fenotípica de la isoniazida, la rifampicina, las fluoroquinolonas, los aminoglucósidos y los polipéptidos parecen ser más fiables en este caso que con otros fármacos antituberculosos [10]. Las razones son, por un lado, técnicas, como la inestabilidad de la sustancia de los carbapenems. En algunos casos, faltan valores umbral para la categorización “sensible”/”resistente” o no están suficientemente probados científicamente. Esto se aplica en particular a las importantes sustancias cicloserina/terizidona y ácido para-aminosalicílico (PAS) [11].
El cultivo de patógenos y las pruebas de resistencia fenotípica pueden llevar de 2 a 10 semanas. Durante este tiempo, habría que llevar a cabo una terapia calculada y alineada con los patrones de resistencia locales [12,13]. Los resultados de una prueba de resistencia biológica molecular o genotípica están disponibles mucho más rápido. En muchos casos, esto ya puede llevarse a cabo a partir de material directo (por ejemplo, esputo con patógenos). Los resultados deberían estar disponibles al cabo de unas horas o días y permitir el inicio de una terapia específica. Sin embargo, con las técnicas de biología molecular, actualmente no es posible detectar la resistencia a todos los fármacos disponibles. Además, pueden pasarse por alto resistencias que no estén asociadas a las mutaciones genéticas detectadas en las pruebas rápidas. Por lo tanto, los resultados de las pruebas biológicas moleculares rápidas deben confirmarse normalmente mediante pruebas de resistencia fenotípica. Cada vez más, la secuenciación del genoma completo está proporcionando resultados adicionales y ya está sustituyendo a las pruebas de resistencia fenotípica para los fármacos de primera línea en algunos países [14,15].
Nuevas recomendaciones de diagnóstico de la OMS
Los resultados de las pruebas biológicas moleculares muestran una buena concordancia con los resultados fenotípicos para algunos fármacos [15]. Por ello, desde 2020, la OMS recomienda las pruebas biológicas moleculares rápidas en los diagnósticos iniciales de patógenos, así como en los diagnósticos de resistencia, con preferencia a los métodos microscópicos y culturales. Esto se aplica en particular al NAAT Xpert® MTB/RIF y al Xpert® MTB/RIF Ultra de Cepheid en la tuberculosis pulmonar. Ambas pruebas indican la resistencia a la rifampicina además del diagnóstico del patógeno. Según la OMS, las pruebas Truenat® MTB, MTB Plus y MTB-RIF Dx de Molbio pueden utilizarse como alternativa. Para el diagnóstico del LCR en casos de sospecha de meningitis tuberculosa, se recomienda encarecidamente el uso del Xpert® MTB/RIF Ultra como prueba inicial. Para otros materiales de muestra en casos de sospecha de tuberculosis extrapulmonar, los datos analizados sólo justifican una recomendación débil principalmente para el Xpert MTB/RIF [7].
Los denominados ensayos de sonda de línea (LPA), como los comercializados por Hain Lifescience en , pueden utilizarse para diagnosticar la resistencia a la rifampicina y la isoniazida (GenoType® MTBDRplus) en muestras de esputo microscópicas o culturalmente positivas. Los LPA para fármacos de segunda línea (GenoType® MTBDRsl) pueden utilizarse en lugar de las pruebas fenotípicas para determinar la resistencia a las fluoroquinolonas (FQ) y la amikacina cuando se ha detectado previamente la resistencia a la rifampicina. La misma recomendación se aplica en caso de monorresistencia a la isoniazida antes de iniciar la terapia con fluoroquinolonas. La OMS sigue recomendando las pruebas de resistencia fenotípica cuando no se detecta resistencia al realizar las pruebas con LPA, pero la probabilidad de resistencia adicional más allá de la TB-MDR parece alta [6,7].
En el año en curso, la OMS evaluará la nueva prueba rápida NAAT Xpert® MTB/XDR para la determinación simultánea de la resistencia a la isoniazida, las fluoroquinolonas, la amikacina, la kanamicina, la capreomicina y la etionamida.
Secuenciación
La secuenciación del genoma completo (WGS) es una técnica que también puede detectar mutaciones raras asociadas a la farmacorresistencia. Además, la secuenciación puede aplicarse para analizar datos epidemiológicos y rastrear el origen de los brotes de tuberculosis [16–18]. Los laboratorios de referencia de Alemania ofrecen pruebas completas de resistencia fenotípica y genotípica, incluida la secuenciación, que deberían realizarse al menos para cada cepa de TB-MDR. Por ello, la interpretación de las mutaciones genéticas en términos de su relevancia clínica supone un reto en muchos casos y es una parte esencial de los actuales esfuerzos de investigación para generalizar el uso de esta tecnología [19]. Los laboratorios de referencia de Alemania y Suiza ofrecen ahora WGS.
Tratamiento de la tuberculosis con monorresistencia a la isoniazida
Se calcula que alrededor del 8% de los casos de tuberculosis en todo el mundo presentan resistencia a la INH sin resistencia a la RMP. En 2018, la OMS publicó por tanto una recomendación separada sobre la terapia para la monorresistencia a la INH, recomendando una terapia de 4 veces con levofloxacino junto con o en lugar de INH durante toda la duración de la terapia de 6 meses [20,21]. Esta recomendación fue adoptada en 2020 [22,23].
En Alemania, la proporción de cepas resistentes a la INH fue del 9,4% en 2018 [4], y en Suiza, según la Oficina Federal de Salud Pública, fue del 6,2% de las cepas de tuberculosis analizadas (Oficina Federal de Salud Pública, comunicación personal). La recomendación para la terapia de la monorresistencia a la INH (Tab. 1) se reevaluará en la actualización ya notificada de la directriz alemana. Por el momento, sin embargo, las recomendaciones de 2017 siguen siendo válidas para el tratamiento en Alemania. Un requisito previo importante para el tratamiento es la comprobación rápida y fiable de la resistencia a las fluoroquinolonas que suelen utilizarse en esta situación.
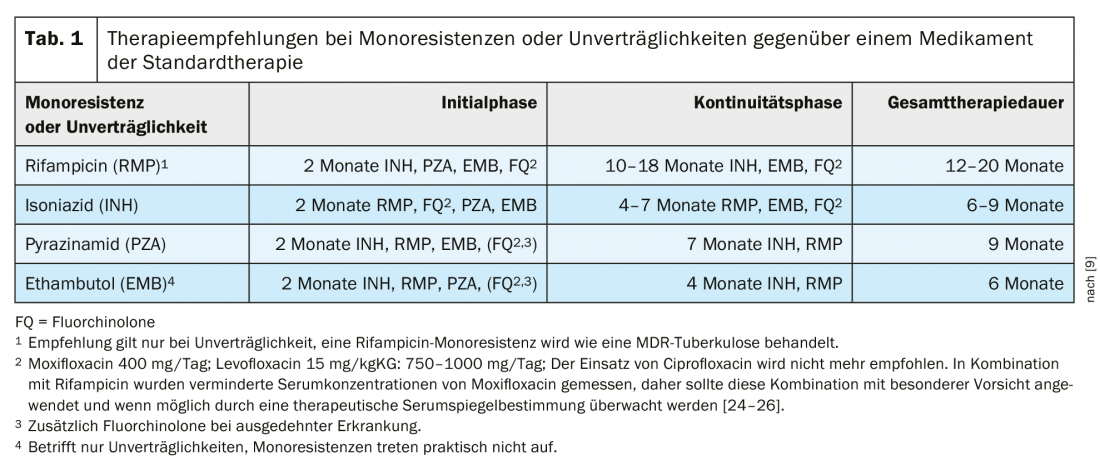
Tratamiento de la tuberculosis con monorresistencia o intolerancia a la rifampicina
En las recomendaciones de la OMS, la monorresistencia a la rifampicina se equipara a la tuberculosis MDR. La resistencia a la rifampicina (RR) rara vez se produce sin resistencia a la isoniazida. Dado que la ausencia de rifampicina tiene un grave impacto en el éxito de la terapia, la TB-MDR y la TB-RR se combinan a menudo en los documentos de la OMS. Las nuevas recomendaciones de la OMS comentan que en la MDR/RR, el uso de altas dosis de isoniazida (10 -15 mg/kgKG) es posible en el contexto de la terapia MDR en caso de sensibilidad probada o resistencia de bajo nivel a la isoniazida [21]. La directriz terapéutica alemana actual recomienda una terapia diferente de la resistencia a la rifampicina para los pacientes con intolerancia a la rifampicina (Tab. 1).
Tratamiento de la tuberculosis multirresistente
Las recomendaciones de la OMS se actualizaron inicialmente en 2019 basándose en las pruebas existentes [21]. En 2020, siguió una actualización completa de las recomendaciones con el Manual complementario asociado, que pretende enriquecer las recomendaciones con aspectos prácticos [22,23].
Los medicamentos disponibles para el tratamiento de la tuberculosis farmacorresistente han sido clasificados en nuevos grupos por la OMS desde 2018 (Tab. 2). Esta clasificación sigue siendo válida con las nuevas recomendaciones de 2020. Especialmente el nuevo fármaco bedaquilina, pero también el linezolid, reciben una prioridad mucho mayor con las nuevas recomendaciones. En este contexto, la recomendación de una terapia completamente oral representa un verdadero cambio de paradigma para la mayoría de los pacientes.
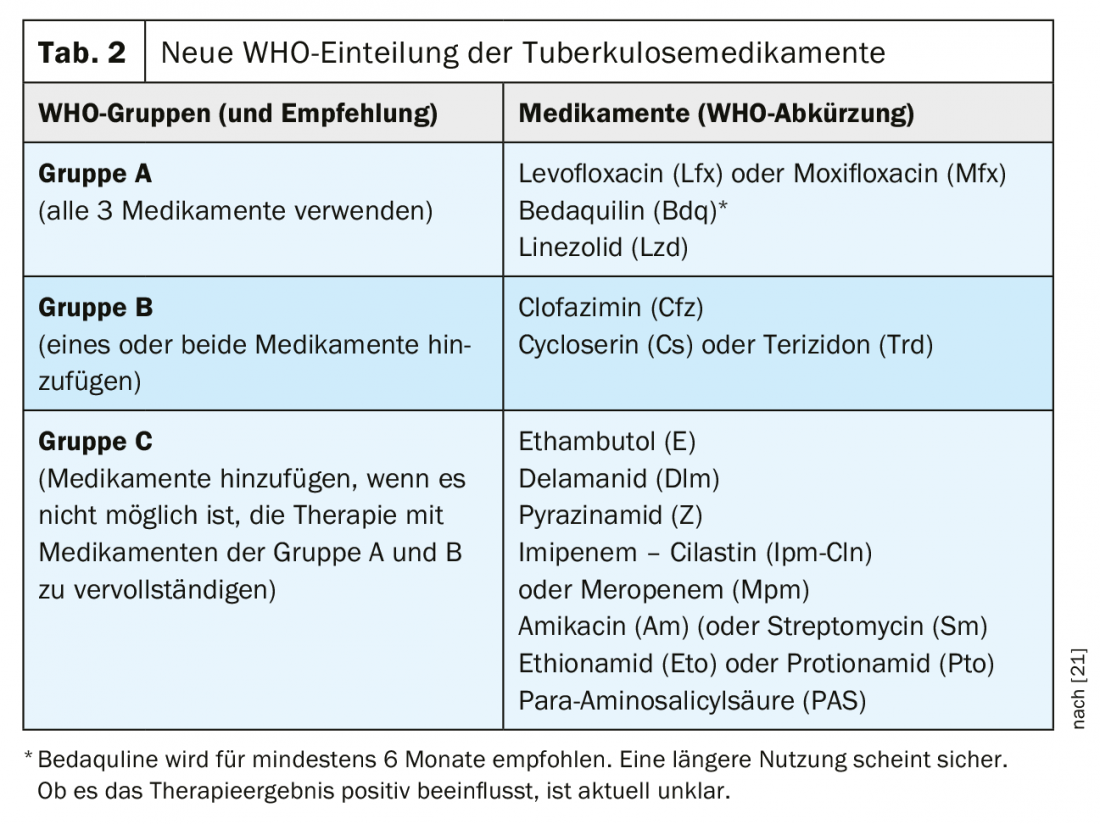
La OMS recomienda para la terapia de la tuberculosis MDR [27] una combinación de al menos cuatro fármacos con una eficacia inicialmente muy probable.
- Deben utilizarse los 3 fármacos del grupo A si es posible y complementarse con 1 fármaco del grupo B.
- Si sólo se pueden utilizar 1 ó 2 fármacos del grupo A, entonces se complementan ambos fármacos del grupo B.
- Si no es posible compilar una terapia completa a partir de los grupos A y B, ésta debe complementarse con fármacos del grupo C.
La Sociedad Respiratoria Europea (ERS), la Sociedad Torácica Americana (ATS) y la Sociedad de Enfermedades Infecciosas de América (IDSA) recomiendan al menos cinco fármacos eficaces en la fase intensiva, y cuatro fármacos después [28].
Por desgracia, a excepción de las fluoroquinolonas, las pruebas de resistencia para los fármacos de los grupos A y B sólo están establecidas en los laboratorios de referencia. Las nuevas recomendaciones de la OMS siguen sugiriendo una duración de 18-20 meses para esta terapia más prolongada. Sin embargo, se comenta que la duración de la terapia puede ajustarse a la respuesta individual al tratamiento de la TB-MDR. Para la mayoría de los pacientes con TB-MDR, una duración de la terapia de 15-17 meses tras la conversión del cultivo debería ser suficiente. Si se utiliza amikacina o estreptomicina, la fase intensiva con aminoglucósidos debe durar 6-7 meses en la mayoría de los casos [21].
Una innovación significativa es la reducción de la dosis de aminoglucósidos en la terapia de la TB-MDR. La OMS recomienda retirarlos de la terapia si es posible. Sólo debe seguir utilizándose la amikacina (alternativamente la estreptomicina) si no hay otra posibilidad de completar la terapia de la TB-MDR. En general, la capreomicina y la kanamicina ya no se recomiendan.
Con las nuevas recomendaciones de la OMS de 2020, el uso de la bedaquilina será ahora
- más allá de los 6 meses,
- simultáneamente con el nuevo fármaco delamanid
- o durante el embarazo
considerados suficientemente seguros. Los datos en los que se basan estas recomendaciones son limitados, por lo que debe ser posible realizar un buen seguimiento de la terapia, especialmente en este tipo de situaciones [22,23].
Declaración sobre las recomendaciones de la OMS desde una perspectiva alemana
Tras la actualización de las recomendaciones de la OMS en 2019, el Centro de Investigación Borstel (FZB) y la DZK publicaron una declaración conjunta apoyando las nuevas recomendaciones de la OMS.
Para el tratamiento MDR en Alemania, se recomienda el inicio de la terapia MDR consistente en cinco fármacos con bedaquilina, linezolid, levo o moxifloxacino, clofazimina y terizidona tras la evidencia biológica molecular de resistencia a la rifampicina y la exclusión de la resistencia a las fluoroquinolonas (gen gyrA en posición 90, 91 y 94 tipo salvaje). En caso de evidencia biológica molecular de resistencia a las fluoroquinolonas, debe implantarse un sistema de puerto intravenoso e iniciarse la terapia con bedaquilina, linezolid, clofazimina, terizidona, amikacina o meropenem/amoxicilina-ácido clavulánico. El objetivo sigue siendo administrar inicialmente al menos cinco sustancias eficaces. La elección de fármacos adicionales del grupo C debe hacerse en función de los resultados de las pruebas de resistencia [29].
La amikacina sólo se recomienda para el tratamiento de pacientes adultos con TB-MDR/RR:
- si no se puede elaborar un régimen terapéutico a partir de fármacos de los grupos A y B,
- los resultados de las pruebas de resistencia sugieren que el fármaco es eficaz y que puede garantizarse un estrecho seguimiento para detectar el desarrollo de efectos secundarios en una fase temprana [29].
Este seguimiento es factible en la mayoría de los centros especializados de Alemania y Suiza, por lo que la amikacina sigue siendo aquí una opción terapéutica. Las nuevas recomendaciones de la OMS de 2020 apoyan esta postura en las condiciones mencionadas [22].
En Suiza, no existen recomendaciones específicas para la terapia de la TB-MDR. Actualmente, la Oficina Federal de Salud Pública y la Liga Pulmonar recomiendan consultar a expertos en caso de resistencia a la rifampicina. Se puede contactar con los expertos los días laborables de 8 a 12 y de 14 a 17 a través del número de teléfono gratuito de la Liga Pulmonar Suiza 0800 388 388 . Dirigido por ellos, existe un grupo experto de clínicos, microbiólogos y especialistas en salud pública que debaten casos complejos y responden a las preguntas de los profesionales en una plataforma en línea.
Terapia a corto plazo de la tuberculosis multirresistente
Desde 2016, la OMS recomienda una terapia a corto plazo de entre 9 y 12 meses con una combinación fija de fármacos para determinados pacientes con TB-MDR, y con las nuevas recomendaciones favorece esto frente a una terapia individualizada más prolongada [22,23,30]. El requisito previo para este tratamiento a corto plazo es la sensibilidad demostrada del patógeno a las fluoroquinolonas e, idealmente, a todas las demás sustancias utilizadas. Además, el paciente no debe haber sido tratado previamente con ninguno de los fármacos utilizados durante más de 1 mes. En Europa, es probable que esto sólo se aplique a unos pocos pacientes, ya que una elevada proporción de casos de tuberculosis multirresistente presenta resistencias adicionales [12,31]. Por lo tanto, en la actualidad no se puede recomendar en Alemania un uso preferente de la terapia a corto plazo [9,29].
La combinación de medicamentos recomendada por la OMS en 2016 contenía aminoglucósidos, que ya no deben utilizarse. Ahora, datos recientes de Sudáfrica muestran que la terapia totalmente oral de corta duración con bedaquilina mejora los resultados del tratamiento y conduce a menos interrupciones del mismo [32]. Por lo tanto, para los pacientes con cepas de TB-MDR en los que se haya demostrado la susceptibilidad a las fluoroquinolonas y esté indicada una terapia a corto plazo, la OMS recomienda abandonar los aminoglucósidos en favor de la bedaquilina a partir de 2020. La terapia oral completa a corto plazo durante 9 -12 meses debe incluir bedaquilina, levo- o moxifloxacino, etionamida, etambutol, pirazinamida, isoniazida a dosis altas y clofazimina [22,23].
Nueva terapia combinada para la TB-MDR con resistencia a las fluoroquinolonas
La terapia combinada de bedaquilina, pretomanida y linezolid (BPaL) durante 6-9 meses ha sido aprobada en EE.UU. para el tratamiento de la tuberculosis extremadamente resistente (XDR-TB) y para el fracaso terapéutico de la MDR-TB desde el 14 de agosto de 2019. La Agencia Europea del Medicamento aprobó la pretonamida en julio de 2020 para el tratamiento de la tuberculosis XDR o MDR en ausencia de otras opciones terapéuticas. El nuevo nitroimidazol Pretomanid fue desarrollado por la organización sin ánimo de lucro TB-Alliance y la terapia combinada se probó en 109 pacientes de Sudáfrica. Un estudio abierto sin brazo comparador (Nix-TB) condujo a la aprobación, que pudo demostrar una buena eficacia con un éxito de tratamiento del 90% en situaciones complicadas de resistencia [33].
La OMS comparó los datos del ensayo Nix TB con los de pacientes que recibieron bedaquilina y linezolid como parte de una terapia combinada durante una media de 21-26 meses. Ambos grupos mostraron un éxito de tratamiento muy bueno del 97% (BPaL) y del 92% (grupo de comparación) [23]. El análisis de los datos del estudio Nix-TB mostró que los efectos secundarios graves bajo BPaL pueden producirse en el 25% de los pacientes. En el estudio Nix-TB se utilizó linezolid a una dosis de 1200 mg diarios. Esta dosis está aprobada para otras infecciones bacterianas con una duración más corta de la terapia. Las reacciones adversas al fármaco relacionadas con la dosis, como la depresión de la médula ósea y la neuropatía periférica, se produjeron con la frecuencia correspondiente en el estudio Nix-TB. Siguiendo la experiencia del estudio, la dosis de linezolid puede reducirse a 600-300 mg tras 4 semanas de terapia de dosis alta en caso de efectos secundarios relevantes. También parece posible una interrupción de la terapia de hasta 35 días. La duración total de la terapia con BPaL debe ser de al menos 6 meses. Si no se ha logrado la conversión del cultivo de esputo después de 4 meses, la duración de la terapia debe ampliarse a 9 meses [23].
El uso de BPaL está recomendado por la OMS sólo para los pacientes con TB-MDR con resistencia a las fluoroquinolonas para los que no se puede instaurar ninguna otra terapia. Además, el uso debe realizarse en condiciones de estudio y no debe haberse producido una terapia previa con bedaquilina o linezolid durante más de 2 semanas [23].
Actualmente se están realizando nuevos estudios con el objetivo de mejorar la tolerabilidad de la combinación de fármacos. Por ejemplo, el ensayo ZeNix está probando diferentes dosis de linezolid.
Conclusión y perspectivas
La incidencia mundial de la tuberculosis (TB) disminuye actualmente un 2% al año. Esta disminución dista mucho de ser suficiente para alcanzar los objetivos de la estrategia de la OMS para acabar con la tuberculosis [2]. La resistencia a los fármacos es un obstáculo importante en este sentido. Los cambios en las recomendaciones terapéuticas de la OMS para la TB-MDR que aquí se resumen son el resultado bienvenido de la creciente investigación en este campo. El establecimiento de diagnósticos moleculares y la aprobación de tres nuevos fármacos para el tratamiento de la TB-M/XDR (bedaquilina, delamanida y pretomanida) representan éxitos importantes. Sin embargo, el número de casos de TB-MDR estimados anualmente no está disminuyendo a un ritmo suficiente y sólo el 51% de los casos de TB confirmados a nivel mundial se sometieron siquiera a pruebas de resistencia a la rifampicina en 2018.
En Alemania y Suiza, el número de casos de TB-MDR es bajo y se dispone de recursos suficientes. La terapia se individualiza tras realizar pruebas exhaustivas de resistencia y puede conducir a un mayor éxito terapéutico [34,35]. Sin embargo, los mayores retos del control de la tuberculosis en el siglo XXI afectan principalmente a los países de alta incidencia con recursos limitados. Además de los avances innovadores en el diagnóstico y la terapia, la prevención y, en particular, el desarrollo de una vacuna eficaz tendrán una importancia decisiva en la lucha contra la tuberculosis. Existe una necesidad urgente de mejorar el acceso global a las opciones diagnósticas y terapéuticas existentes y nuevas para todos.
Mensajes para llevarse a casa
- La tuberculosis es una enfermedad rara en Suiza, pero 10 millones de personas la contraen cada año en todo el mundo.
- En la tuberculosis multirresistente, los dos fármacos más importantes de la terapia antituberculosa, la isoniazida y la rifampicina, ya no son eficaces.
- En Alemania y Suiza, la terapia se individualiza tras realizar exhaustivas pruebas de resistencia.
- Los métodos de biología molecular permiten un diagnóstico rápido para el inicio de una terapia dirigida. En la actualidad, los resultados aún deben confirmarse mediante pruebas fenotípicas.
- La compleja y prolongada terapia de la tuberculosis MDR debe ser guiada por expertos experimentados. La Liga Suiza del Pulmón ofrece servicios de asesoramiento gratuitos (tel.: 0800 388 388).
Literatura:
- Prideaux B, et al.: La asociación entre la actividad esterilizante y la distribución del fármaco en las lesiones tuberculosas. Nat Med 2015; 21(10): 1223-1227.
- Informe mundial sobre la tuberculosis 2019. Ginebra: Organización Mundial de la Salud 2019. Licencia: CC BY-NC-SA 3.0 IGO.
- Informe mundial sobre la tuberculosis 2018, Organización Mundial de la Salud Ginebra.
- Informe sobre la epidemiología de la tuberculosis en Alemania en 2018. Instituto Robert Koch 2019.
- Mase SR, et al: Rendimiento de los exámenes seriados de muestras de esputo en el diagnóstico de la tuberculosis pulmonar: una revisión sistemática. Int J Tuberc Lung Dis 2007; 11(5): 485-495.
- Manual operativo de la OMS sobre la tuberculosis. Módulo 3: diagnóstico – diagnóstico rápido para la detección de la tuberculosis. Ginebra: Organización Mundial de la Salud 2020. Licencia: CC BY-NC-SA 3.0 IGO.
- Directrices consolidadas de la OMS sobre la tuberculosis. Módulo 3: diagnóstico – diagnóstico rápido para la detección de la tuberculosis. Ginebra: Organización Mundial de la Salud 2020. Licencia: CC BY-NC-SA 3.0 IGO.
- Tostmann A, et al: Transmisión de la tuberculosis por pacientes con tuberculosis pulmonar con baciloscopia negativa en una gran cohorte en los Países Bajos. Clin Infect Dis 2008; 47(9): 1135-1142.
- Schaberg T, et al.: Tuberculosis Guideline for Adults – Guideline for Diagnosis and Treatment of Tuberculosis including LTBI Testing and Treatment of the German Central Committee (DZK) and the German Respiratory Society (DGP). Neumología 2017; 71(6): 325-397.
- Lange CI, Abukabar I, Alffenaar JW: Manejo de los pacientes con tuberculosis multirresistente/extensamente resistente a los fármacos en Europa: una declaración de consenso de TBNET. 2014.
- OMS, Technical report on critical concentrations for TB drug susceptibility testing of medicines used in the treatment of drug-resistant TB. 2018.
- Otto-Knapp R, et al: Resistencia a fármacos de segunda línea en inmigrantes con tuberculosis multirresistente en la región de Berlín. Neumología 2014; 68: 496-500.
- Lange C, et al: Manejo de los pacientes con tuberculosis multirresistente/extensamente resistente a los fármacos en Europa: una declaración de consenso de TBNET. Revista Respiratoria Europea 2014; 44: 23-63.
- Servicio Nacional de Infecciones de Salud Pública de Inglaterra. Servicio Nacional de Referencia sobre Micobacterias-Sur (NMRS-Sur). Manual del usuario 2019.
- Allix-Beguec C, et al: Predicción de la susceptibilidad a los fármacos de primera línea contra la tuberculosis mediante secuenciación del ADN. N Engl J Med 2018; 379(15): 1403-1415.
- Galagan JE: Perspectivas genómicas de la tuberculosis. Nat Rev Genet 2014; 15(5): 307-320.
- Nikolayevskyy V, et al: Secuenciación del genoma completo de Mycobacterium tuberculosis para la detección de la transmisión reciente y el rastreo de brotes: una revisión sistemática. Tuberculosis (Edinb) 2016; 98: 77-85.
- Merker M, et al: La evolución de la tipificación de cepas en el complejo Mycobacterium tuberculosis. Adv Exp Med Biol 2017; 1019: 43-78.
- Meehan CJ, et al: Secuenciación del genoma completo de Mycobacterium tuberculosis: normas actuales y cuestiones pendientes. Nat Rev Microbiol 2019; 17(9): 533-545.
- OMS, WHO treatment guidelines for isoniazid-resistant tuberculosis: Supplement to the WHO treatment guidelines for drug-resistant tuberculosis 2018; Organización Mundial de la Salud: Ginebra.
- OMS, Directrices consolidadas de la OMS sobre el tratamiento de la tuberculosis farmacorresistente 2019; Organización Mundial de la Salud Ginebra
- Directrices consolidadas de la OMS sobre la tuberculosis. Módulo 4: tratamiento – tratamiento de la tuberculosis farmacorresistente. Ginebra: Organización Mundial de la Salud 2020. Licencia: CC BY-NC-SA 3.0 IGO.
- Manual operativo de la OMS sobre la tuberculosis. Módulo 4: tratamiento – tratamiento de la tuberculosis farmacorresistente. Ginebra: Organización Mundial de la Salud 2020. Licencia: CC BY-NC-SA 3.0 IGO.
- Weiner M, et al.: Efectos de la rifampicina y del polimorfismo del gen de resistencia a múltiples fármacos en las concentraciones de moxifloxacino. Agentes antimicrobianos Quimioterápicos 2007; 51(8): 2861-2866.
- Nijland HM, et al.: La rifampicina reduce las concentraciones plasmáticas de moxifloxacino en pacientes con tuberculosis. Clin Infect Dis 2007; 45(8): 1001-1007.
- Alsultan A, Peloquin CA: Monitorización de fármacos terapéuticos en el tratamiento de la tuberculosis: una actualización. Medicamentos 2014; 74(8): 839-854.
- Ahmad N, et al: Correlatos del tratamiento en los resultados satisfactorios de la tuberculosis pulmonar multirresistente: un metaanálisis de datos de pacientes individuales. Lancet 2018; 392(10150): 821-834.
- Nahid P, et al: Tratamiento de la tuberculosis farmacorresistente. Una Guía Oficial de Práctica Clínica ATS/CDC/ERS/IDSA. Am J Respir Crit Care Med 2019; 200(10): e93-e142.
- Maurer B, et al.: Declaración conjunta sobre la nueva recomendación de la OMS para el tratamiento de la tuberculosis multirresistente y resistente a la rifampicina. Neumología 2019; 1-4 (en prensa).
- Directrices de la OMS para el tratamiento de la tuberculosis farmacorresistente – Actualización 2016.
- Günther G, et al: Tuberculosis multirresistente en Europa, 2010-2011. Enfermedades infecciosas emergentes 2015; 21: 409-416.
- Comunicación rápida: cambios clave en el tratamiento de la tuberculosis farmacorresistente. Ginebra: Organización Mundial de la Salud 2019 (WHO/CDS/TB/2019.26). Licencia: CC BY-NC-SA 3.0 IGO.
- Conradie F, et al: Tratamiento de la tuberculosis pulmonar altamente farmacorresistente. New England Journal of Medicine 2020; 382(10): 893-902.
- Olaru ID, et al: Régimen de tratamiento basado en la bedaquilina para la tuberculosis multirresistente. Eur Respir J 2017; 49(5).
- Heyckendorf J, et al: Curación sin recaída de la tuberculosis multirresistente en Alemania. Eur Respir J 2018; 51(2).
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2020: 2(3): 6-11