El síndrome de las piernas inquietas es una afección común y normalmente crónica cuyo tratamiento debe ajustarse una y otra vez a medida que avanza. En los últimos años, se dispone de estudios y recomendaciones sobre la terapia a largo plazo que prestan mayor atención al “aumento”, un efecto secundario paradójico de los agonistas dopaminérgicos, por lo que dan más importancia a los α2δ-ligandos y, en parte, a los opiáceos.
El síndrome de las piernas inquietas (SPI) es una afección neurológica común que afecta hasta al 4% de la población femenina y al 2% de la masculina. Aunque la gravedad de los síntomas suele variar de un día para otro y a lo largo de periodos más prolongados, el SPI suele durar toda la vida. Aunque sigue siendo controvertido si las alteraciones del sueño causadas por el SPI suponen un riesgo para las enfermedades cardio y cerebrovasculares, el impacto negativo del SPI grave en la calidad de vida de la persona afectada y de sus familiares está bien documentado.
Diagnóstico: pensar en los imitadores
Tras una larga época en la que apenas se conocía el SPI, el conocimiento de esta enfermedad ha crecido gratificantemente en los últimos años, tanto entre los médicos como entre los profanos en la materia. En este contexto, también se advirtió del peligro del sobrediagnóstico, que puede conducir a prescripciones innecesarias de medicamentos y a los correspondientes costes y efectos secundarios. La última clasificación de los trastornos del sueño y la vigilia (ICSD-3) aborda este problema esforzándose por lograr una mayor especificidad diagnóstica. Como antes, el diagnóstico del SPI se basa en cuatro criterios clínicos obligatorios:
- Ganas de mover las piernas, a menudo asociadas a sensaciones desagradables
- Refuerzo en reposo, es decir, en posición sentada y tumbada
- Clara mejoría durante la actividad física
- Intensificación de las molestias por la tarde o durante la noche.
Para hacer un diagnóstico de SPI, deben cumplirse los cuatro criterios o -dado que la duración de los síntomas puede extenderse a todo el día con el aumento de la gravedad de la enfermedad- haberse cumplido una vez en el curso de la enfermedad. Como quinto criterio, igualmente obligatorio, se añadió que la calidad de vida debe estar limitada por el alcance de las dolencias.
Estos criterios diagnósticos son obligatorios pero no específicos para el SPI. Los “imitadores del SPI”, como artropatías, edemas en las piernas, calambres en las piernas o “molestias posicionales” (sólo al sentarse, no al tumbarse, con alivio simplemente cambiando la posición de las piernas) son descritos a veces por los afectados utilizando términos similares a los del SPI, pero normalmente pueden diferenciarse bien haciendo preguntas específicas. En el diagnóstico diferencial de la polineuropatía (de fibras pequeñas), debe recordarse que ésta aumenta el riesgo de SPI y que, por tanto, pueden existir ambas causas de parestesia y de necesidad de mover las piernas en una misma persona. En los casos poco claros, resultan útiles los resultados de exámenes adicionales como la detección de movimientos periódicos de las piernas durante el sueño (PLMS) y la vigilia (PLMW), a menudo asociados al SPI, mediante polisomnografía o -de forma más rentable- mediante actigrafía ambulatoria de los pies y, en particular, la respuesta de los síntomas a dosis bajas de fármacos dopaminérgicos. Los antecedentes familiares típicamente positivos en el SPI idiopático no suelen ser fiables y la dificultad para conciliar el sueño, aunque típica, es demasiado inespecífica como criterio diagnóstico.
Tras el diagnóstico sindrómico del SPI, suelen ser útiles pocas pruebas de laboratorio en relación con los factores que pueden desencadenar o agravar el SPI, por ejemplo la insuficiencia renal o la carencia de hierro.
¿Quién necesita tratamiento?
No todas las personas que cumplen los criterios diagnósticos del SPI necesitan medicación. Se suele suponer que existe un grado de malestar que requiere tratamiento cuando los síntomas están presentes al menos dos o tres días por semana y perjudican claramente la calidad de vida del paciente. Existen varias escalas para evaluar la gravedad de la enfermedad, que permiten una evaluación muy importante del curso de la enfermedad. La escala Johns Hopkins (Tab. 1) es muy adecuada para la práctica porque también debería ser capaz de detectar el aumento en una fase temprana.

En primer lugar, deben identificarse los estimulantes y medicamentos que provocan el SPI y evitarlos si es posible (Tab. 2). Los antidepresivos pueden aumentar el SPI hasta en un 10% de los casos (especialmente la mirtazapina [Remeron®]), pero cerca del 70% de los pacientes con una comorbilidad de SPI y depresión se benefician de ellos. El tratamiento causal es posible especialmente para el SPI secundario como resultado de una carencia de hierro. Aunque aún no está claro qué pacientes con SPI se benefician de la sustitución con hierro, se recomienda a partir de una ferritina <50-75 μg/l. Si los preparados orales provocan un aumento insuficiente de la ferritina o se toleran mal, la administración intravenosa de hierro es una alternativa.

El tratamiento farmacológico de los movimientos periódicos de las piernas durante el sueño (PLMS) sin la presencia simultánea de molestias del SPI en el estado de vigilia bajo el concepto de “trastornos de los movimientos periódicos de las piernas” (PLMD) sólo debe llevarse a cabo con gran precaución, pequeñas dosis de fármaco y bajo una estrecha vigilancia de las molestias subjetivas como el cansancio, la somnolencia o el insomnio, de modo que se evite en cualquier caso el aumento.
La elección del primer medicamento
Si no se consigue una mejoría suficiente con las medidas enumeradas, existen varias clases de medicamentos para el tratamiento del SPI (tab. 3) . La elección de la medicación depende de la gravedad y la frecuencia de los síntomas, las comorbilidades y los posibles efectos secundarios de la medicación (tab. 4).
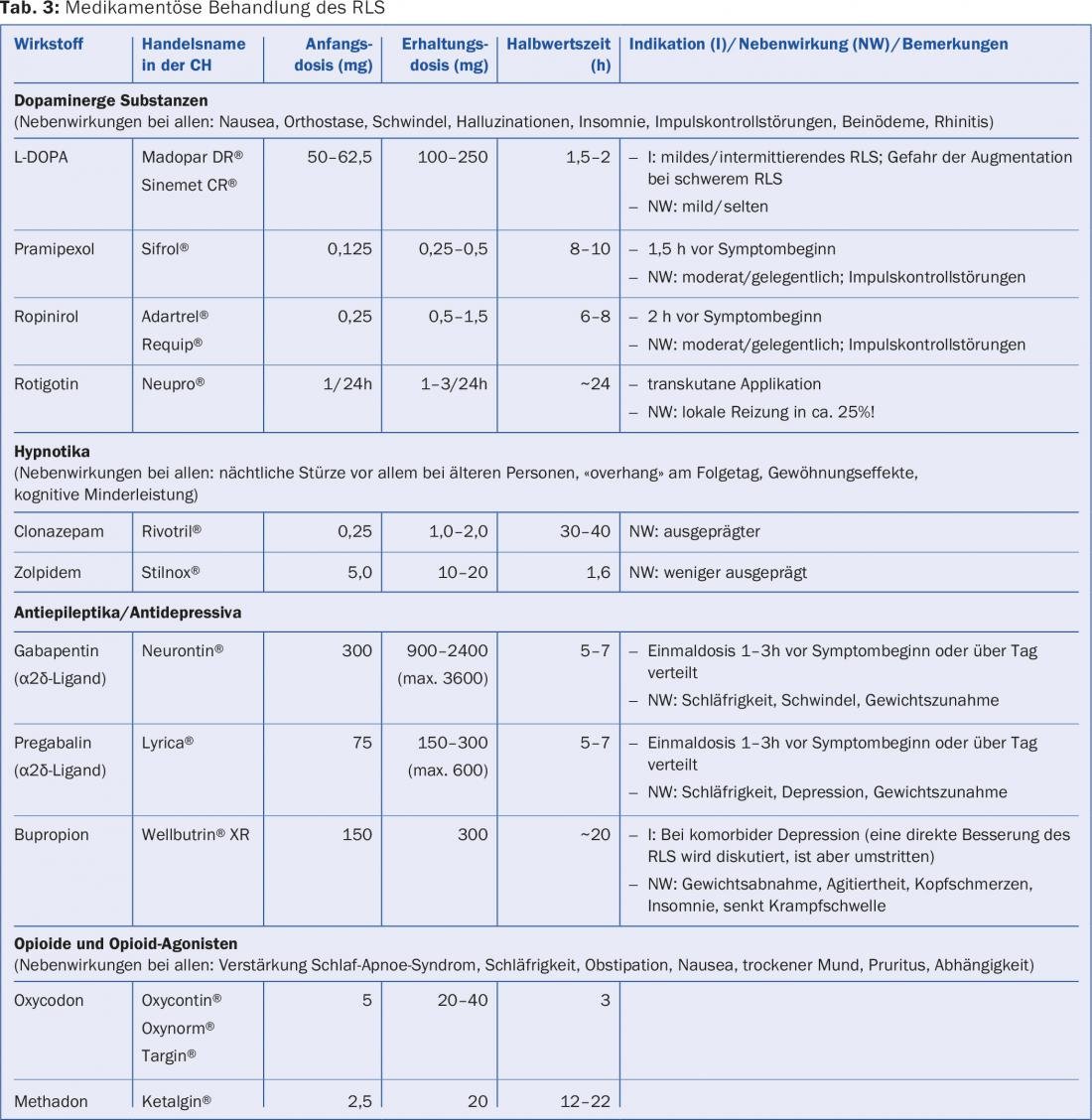

Los más conocidos son los diversos agonistas de la dopamina (DA) que probablemente sean los más recetados en la actualidad, mientras que la L-DOPA sólo puede recomendarse en raras ocasiones para los síntomas muy leves e intermitentes del SPI.
La eficacia a corto plazo de la DA ha quedado demostrada en diversos estudios. Suelen ser una buena elección, sobre todo para los pacientes que sólo necesitan un medicamento ocasionalmente, por ejemplo, cuando van al quirófano por la noche. Entonces, por ejemplo, puede tomarse un DA de acción corta (pramipexol, ropinirol) una o dos horas antes de los síntomas esperados.
Las dudas sobre el éxito a largo plazo de los dopaminérgicos son cada vez más actuales debido a la no tan rara pérdida de eficacia y al efecto secundario más importante y, por desgracia, relativamente común, el aumento. Además de los efectos secundarios que suelen ser fáciles de reconocer, como las náuseas, la somnolencia diurna con peligro de microsueño o incluso el insomnio, los pacientes deben ser especialmente conscientes de los trastornos del control de los impulsos, a menudo no reconocidos, como el descontrol de la alimentación, las compras y el juego, pero también la hipersexualidad, antes de iniciar la terapia y durante las revisiones.
Recientemente, por tanto, algunos expertos han recomendado los α2δ-ligandos (pregabalina y gabapentina) como fármacos alternativos de primera línea. Especialmente en el caso de pacientes con trastornos dolorosos comórbidos, por ejemplo en el contexto de una polineuropatía, su uso primario tiene sentido en cualquier caso. La pregabalina puede recomendarse además para el trastorno de ansiedad generalizada comórbido, que es frecuente en el SPI. Estos fármacos también se asocian a efectos secundarios comunes pero normalmente reversibles, como somnolencia, mareos y aumento de peso. En un estudio comparativo de un año con pregabalina y pramipexol, la pregabalina se interrumpió con más frecuencia debido a los efectos secundarios, aunque la eficacia fue comparable.
En el curso natural del SPI, siempre hay también fases espontáneas con síntomas leves, por lo que la farmacoterapia establecida debe interrumpirse a modo de prueba en un paciente sin síntomas o con pocos síntomas.
Si los pacientes ingresan en un hospital o en una residencia de ancianos, les recomendamos que descarguen la hoja de información para el ingreso hospitalario de la página web www.restless-legs.ch y la entreguen a los médicos y al personal de enfermería responsables.
Cuando el tratamiento ya no funciona
Si un paciente con SPI experimenta una reaparición de los síntomas bajo un tratamiento farmacológico previamente eficaz, lo primero que hay que buscar son cambios de comportamiento y enfermedades concomitantes que puedan exacerbar el SPI. La reducción de la actividad física, el aumento del consumo de alcohol o el insomnio por otros motivos (por ejemplo, permanecer demasiado tiempo tumbado) pueden exacerbar el SPI. La medicación recién recetada o la interrupción de una medicación opiácea tomada durante mucho tiempo son otras causas de deterioro. Al igual que con el diagnóstico inicial, debe buscarse de nuevo una carencia de hierro.
Los pacientes que toman medicación dopaminérgica deben tener en cuenta la posibilidad de un aumento, cuya incidencia anual es de alrededor del 10% en los que siguen un tratamiento prolongado. Se entiende como la reaparición o el rápido empeoramiento de los síntomas del SPI bajo tratamiento en el plazo de unas semanas, en el que los síntomas aparecen cada vez más temprano en el transcurso del día, se producen tras un periodo de latencia más corto en reposo (tras sentarse o tumbarse) y también afectan a regiones corporales que antes no estaban afectadas, como los brazos. Además de la duración del tratamiento, es probable que la dosis elevada y los aspectos farmacocinéticos (más comunes con los preparados de acción corta, especialmente la L-DOPA) y la ferritina baja favorezcan el desarrollo del aumento. Por tanto, como medida preventiva, tiene sentido evitar las dosis elevadas de fármacos dopaminérgicos y, en el mejor de los casos, utilizar formas galénicas de acción más prolongada.
Si el aumento se produce con un DA de acción corta, puede hacerse un intento inicial de controlar los síntomas que aparecen a primera hora del día repartiendo la dosis total no modificada en varias tomas (es decir, también a primera hora del día). Otra opción es cambiar a una forma de liberación sostenida de pramipexol o ropinirol o a la DA rotigotina, que se aplica transcutáneamente y por tanto es eficaz durante todo el día, esta última ocasionalmente causa intolerancia cutánea además de los efectos secundarios habituales de la DA. Aumentar la dosis diaria de DA conlleva un alivio de los síntomas a corto plazo, pero aumenta el aumento a largo plazo, lo que también debe señalarse a los afectados.
Si estas medidas no conducen al éxito, deberá cambiarse a otra clase de sustancia, principalmente un α2δ-ligando. Dado que la interrupción de la medicación dopaminérgica exacerba el SPI a corto plazo, el fármaco alternativo debe dosificarse hasta el rango recomendado antes de reducir gradualmente el DA.
Por último, como se demostró en 2013 en un estudio más amplio con oxicodona/naloxona, los opiáceos, incluida la metadona, son una opción para los pacientes cuyo SPI no puede tratarse adecuadamente con DA y α2δ-ligandos (solos o en combinación). Además de los riesgos de dependencia y sobredosis, que también son relevantes en el uso de opiáceos para otras indicaciones, desde el punto de vista de la medicina del sueño, es especialmente importante señalar la posible intensificación de un trastorno respiratorio asociado al sueño. En general, el uso a largo plazo de opiáceos para el SPI debe discutirse con un especialista.
El tratamiento del SPI durante el embarazo, que desgraciadamente suele ir acompañado de un aumento de los síntomas, sigue siendo difícil. Tanto los DA como los α2δ-ligandos no deben utilizarse durante este tiempo. La sustitución de una carencia de hierro reviste aquí especial importancia.
Aunque aún escasean los buenos datos a largo plazo, la mayoría de los pacientes con SPI pueden ser ayudados a largo plazo con los fármacos disponibles en la actualidad. Sin embargo, se producen cursos graves con resistencia a la terapia. Además de una buena cooperación entre los proveedores de atención primaria y los especialistas, el apoyo de los grupos de autoayuda también puede ser valioso para los afectados (www.restless-legs.ch).
Para saber más:
- Allen RP, et al: Comparación de la pregabalina con el pramipexol para el síndrome de las piernas inquietas. N Engl J Med 2014; 370(7): 621-631.
- García-Borreguero D, et al: El tratamiento a largo plazo del síndrome de las piernas inquietas/enfermedad de Willis-Ekbom: directrices basadas en la evidencia y guía de mejores prácticas de consenso clínico: un informe del Grupo Internacional de Estudio del Síndrome de las Piernas Inquietas. Sleep Med 2013; 14: 675-684.
- Sateia M: Clasificación internacional de los trastornos del sueño. Tercera edición. Academia Americana de Medicina del Sueño 2014. ISBN: 0991543416.
- Trenkwalder C, et al, RELOXYN Study Group: Prolonged release oxycodone-naloxone for treatment of severe restless legs syndrome after failure of previous treatment: a double-blind, randomised, placebo-controlled trial with an open-label extension. Lancet Neurol 2013; 12: 1141-1150.
PRÁCTICA GP 2016; 11(1): 7-11