Los sarcomas de partes blandas son tumores malignos poco frecuentes del tejido conjuntivo. La terapia es multidisciplinar y debe ser determinada por un centro de sarcomas. Las lesiones “whoops” son extirpaciones no planificadas de sarcomas de tejidos blandos sin diagnóstico ni tratamiento previos. Imagen. Las lesiones Whoops se producen en el 20-50% de todos los pacientes con sarcomas de tejidos blandos. Las lesiones Whoops se asocian a una mayor tasa de recidiva local y a un peor pronóstico. El tejido tumoral permanece tras resecciones no planificadas. Por lo tanto, debe realizarse una resección extensa, lo que puede conllevar una gran morbilidad, un aumento de las complicaciones o incluso la pérdida del miembro. En Suiza, todas las disciplinas relacionadas con los sarcomas se han organizado a nivel nacional (www.sarcoma.ch) y han publicado directrices terapéuticas para evitar diagnósticos y tratamientos erróneos de los sarcomas de tejidos blandos.
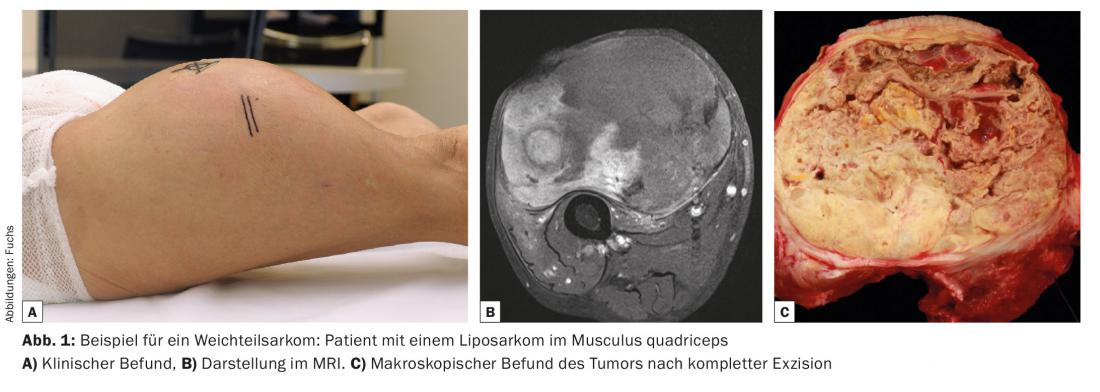
Los sarcomas de partes blandas representan menos del 1% de todos los tumores malignos en adultos. Los sarcomas de tejidos blandos pueden aparecer en pacientes de cualquier edad y se dan con la misma frecuencia en mujeres y hombres. Alrededor del 50% de los sarcomas de partes blandas se localizan en las extremidades, siendo la extremidad inferior la más comúnmente afectada. En principio, sin embargo, es posible que se produzca en cualquier lugar. Histológicamente, los sarcomas de partes blandas forman un grupo muy heterogéneo, y la nomenclatura es correspondientemente compleja. A excepción de los tumores malignos de la vaina nerviosa periférica de origen neuroectodérmico, derivan de células mesodérmicas y se agrupan según el presunto origen celular: Los liposarcomas surgen de las células grasas (Fig. 1), los rabdomiosarcomas del músculo esquelético estriado y los leiomiosarcomas del músculo liso. Sin embargo, también existen entidades, como el sarcoma pleomórfico de células fusiformes, en las que se desconoce el origen celular. A pesar de la inmensa diversidad, sobre todo estructural, el comportamiento biológico de todos los sarcomas de partes blandas es muy similar, por lo que a menudo se consideran un grupo uniforme en el diagnóstico y la gestión.
Diagnóstico de los sarcomas de partes blandas
La mayoría de los pacientes con sarcoma de tejidos blandos acuden a la consulta con una inflamación indolora de los tejidos blandos. No existen signos clínicos claros para distinguir un tumor maligno de un tumor benigno de los tejidos blandos. Un crecimiento rápido del tumor o un tamaño superior a 5 cm, especialmente si está localizado subfascialmente, son sospechosos de malignidad. Si la masa es menor de 5 cm pero está adherida a la fascia profunda o a las estructuras circundantes, también se sospecha de malignidad. Debido a los hallazgos a menudo poco claros desde el punto de vista clínico, en el tratamiento de los sarcomas de partes blandas es crucial el diagnóstico adicional por imagen y, posiblemente, la biopsia. Si se sospecha un sarcoma, es obligatorio realizar más pruebas de imagen. La resonancia magnética se considera el procedimiento de elección. Un medio de contraste adicional (gadolinio) aumenta la precisión diagnóstica. Las ventajas del examen por RM en comparación con la ecografía son la mejor representación morfológica del tumor y la mejor cartografía de la localización anatómica con referencia a estructuras neurovasculares importantes.
La Junta Consultiva Nacional Suiza sobre Sarcomas ha elaborado unas directrices para orientar al médico tratante (“requisitos mínimos para la realización de pruebas”). Las directrices están disponibles gratuitamente en www.sarcoma.ch y proporcionan una valiosa orientación sobre qué situaciones justifican la realización de más pruebas de imagen o una biopsia.
Biopsia
En principio, todos los tumores de tejidos blandos superficiales y subcutáneos de más de 5 cm y todos los tumores subfasciales deben someterse a una biopsia antes de la resección quirúrgica. Es obligatorio que la biopsia sea realizada por un miembro del equipo que posteriormente llevará a cabo la resección quirúrgica. La mayoría de las veces, los sarcomas de partes blandas se biopsian guiados por ecografía; en algunos casos, es necesaria una biopsia guiada por TC. Una aspiración con aguja fina a menudo produce demasiado poco tejido para hacer un diagnóstico claro desde el punto de vista histológico y molecular. Por ello, la biopsia en sacabocados se considera el patrón oro. La biopsia es sencilla en términos de técnica manual, pero a menudo intelectualmente exigente en términos de planificación. Dado que existe el riesgo de transportar células tumorales al tejido circundante con la biopsia, el tracto de la biopsia también debe extirparse durante la operación posterior. Por este motivo, la biopsia debe estar alineada con la incisión cutánea quirúrgica posterior. El trayecto de la biopsia nunca debe estar cerca de vasos o nervios ni cruzar compartimentos anatómicos no afectados. Del mismo modo, debe evitarse a toda costa la formación de un hematoma para prevenir una mayor diseminación local del tumor.
Terapia de los sarcomas de partes blandas
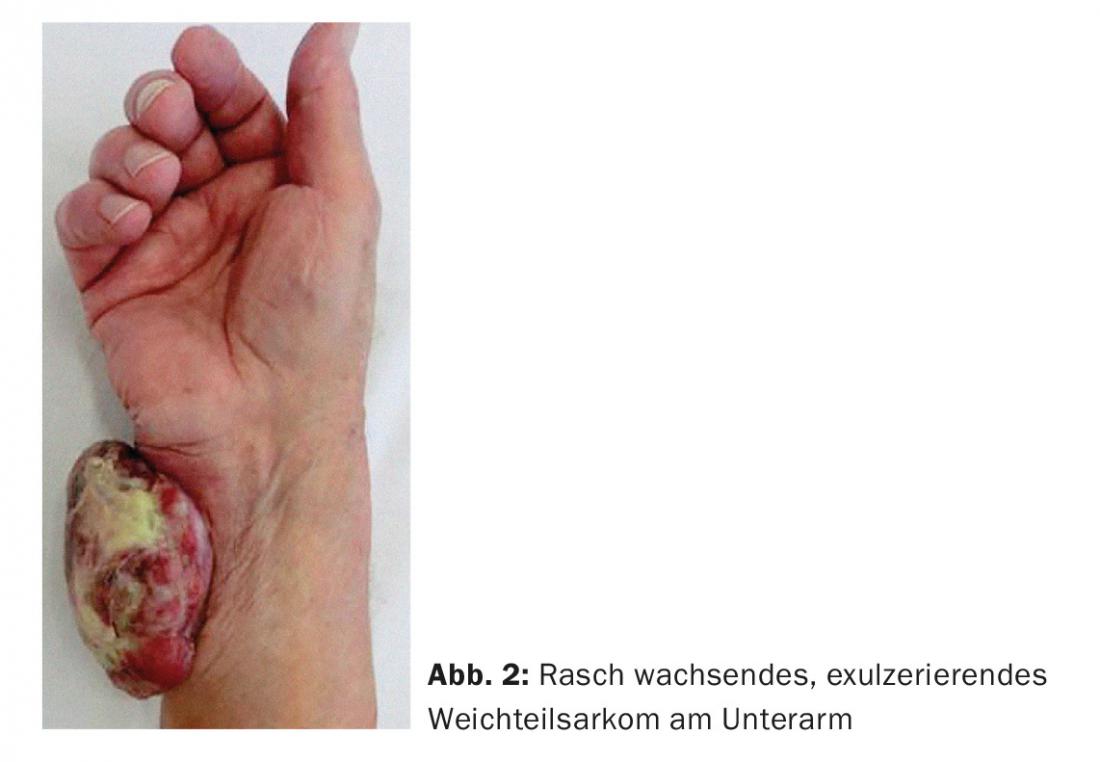
Si el diagnóstico de sarcoma de tejidos blandos se confirma mediante biopsia tras la sospecha inicial en la resonancia magnética, se determina un plan de tratamiento en la junta multidisciplinar de sarcomas. El tratamiento local suele realizarse mediante terapia combinada, es decir, resección quirúrgica en combinación con radiación. Independientemente de la presencia o no de metástasis en el momento del diagnóstico, los pacientes con sarcoma de tejidos blandos requieren un tratamiento local para evitar complicaciones locales. Si no se trata, el tumor puede llegar a ser muy grande, comprometer las estructuras neurovasculares y ulcerarse a través de la piel (Fig. 2 ), llegando a poner en peligro la extremidad en su conjunto.
El objetivo de la resección quirúrgica es extirpar completamente el sarcoma preservando los márgenes de resección libres de tumor y, al mismo tiempo, preservar al máximo la función de la extremidad. A menudo se trata de un acto de equilibrio que debe discutirse individualmente con cada paciente antes de la operación.
Se administra radioterapia a todos los pacientes para esterilizar la zona circundante y lograr así un mejor control local que con la cirugía sola. La radioterapia puede administrarse antes o después de la cirugía, aunque en un ensayo controlado aleatorio de Canadá, la terapia preoperatoria mostró resultados ligeramente mejores [1]. Sin embargo, la ventaja de la radioterapia preoperatoria es principalmente que la dosis y el volumen de radiación son menores que con la radioterapia postoperatoria, lo que a su vez conlleva menos efectos secundarios a largo plazo.
La quimioterapia para los sarcomas de tejidos blandos aún no es estándar, sino opcional para los pacientes de alto riesgo. Los metaanálisis muestran una tasa de respuesta de alrededor del 5-10% con respecto a la supervivencia y las metástasis. Por lo tanto, el beneficio de esta terapia es pequeño y a menudo no puede predecirse.
La lesión Whoops
Las lesiones Whoops son resecciones tumorales sin diagnóstico preoperatorio previo y sin que el cirujano haya pensado en la posibilidad de un sarcoma. A menudo, un hallazgo a la palpación lleva a sospechar el diagnóstico de una alteración benigna (“lipoma”). El bulto se reseca quirúrgicamente y el análisis patológico revela un hallazgo maligno, para sorpresa del cirujano. Dado que los sarcomas de partes blandas son muy poco frecuentes y, por tanto, no se piensa en ellos como diagnóstico, la bibliografía informa de un tratamiento inadecuado e inapropiado por parte de los médicos cirujanos en hasta un 20-50% de los casos.
Aclaraciones tras la lesión de Whoops
Tras una resección imprevista de un sarcoma de partes blandas, es imperativo que el tratamiento posterior continúe en un centro especializado en sarcomas. El primer paso es una revisión completa de todos los hallazgos, informes e imágenes existentes. Las muestras de tejido disponibles deben ser reevaluadas por un patólogo de referencia para su control con el fin de evitar errores de diagnóstico. Se examina clínicamente al paciente prestando especial atención a la localización y el curso de la cicatriz quirúrgica, la presencia de hematoma, los posibles puntos de drenaje y el tipo de cierre de la herida. Todos estos factores pueden conducir a la propagación de las células tumorales a compartimentos anatómicos originalmente no afectados y, por lo tanto, deben tenerse en cuenta en el tratamiento posterior.
A continuación, se realiza una estadificación completa para mostrar la afectación tumoral local y sistémica. La estadificación local se realiza mediante IRM y contraste para buscar tejido tumoral remanente en la zona quirúrgica y evaluar la posible contaminación de una resección previa no planificada. A menudo existe la dificultad de que los cambios cicatriciales postoperatorios normales no siempre pueden distinguirse claramente del tejido tumoral residual. Así pues, la sensibilidad de la RM tras una resección no planificada es sólo del 64%. La estadificación sistémica incluye siempre un TAC de tórax y un TAC de abdomen y pelvis si hay un diagnóstico de liposarcoma mixoide o leiomiosarcoma.
Tratamiento de una lesión de Whoops
En la gran mayoría de los casos, se reseca la zona operada. El objetivo en este caso es extirpar el sarcoma restante y el tejido potencialmente contaminado con márgenes de resección suficientes. La justificación de una resección se basa en la observación de que, tras una resección no planificada, casi siempre se encuentra tejido tumoral residual, al menos microscópicamente (24-60%). Este hecho puede influir en el pronóstico posterior del paciente. La posresección suele ser difícil debido al tejido cicatricial, las capas anatómicas alteradas y la falta de una masa que pueda servir de guía. Las cicatrices mal situadas y los lugares de salida de drenajes anteriores complican aún más la situación.
A diferencia de las resecciones primarias planificadas de los sarcomas de partes blandas, en las que la radioterapia forma parte integral de la terapia, el papel de la radioterapia en el tratamiento de las lesiones Whoops sigue estando menos claro y debe debatirse individualmente en la junta de sarcomas. La radiación sola sólo se utiliza cuando la resección posterior sería demasiado mutilante para la paciente. Los datos actuales muestran un pronóstico ligeramente mejor cuando la cirugía se combina con radiación [2].
La quimioterapia es controvertida en el tratamiento de las lesiones de Whoops. Los datos disponibles son escasos y a menudo de calidad insuficiente. Sin embargo, si las metástasis ya están presentes en la primera estadificación antes de la posresección, sin duda hay que hablar al menos de la quimioterapia con la paciente.
Consecuencias de una lesión Whoops
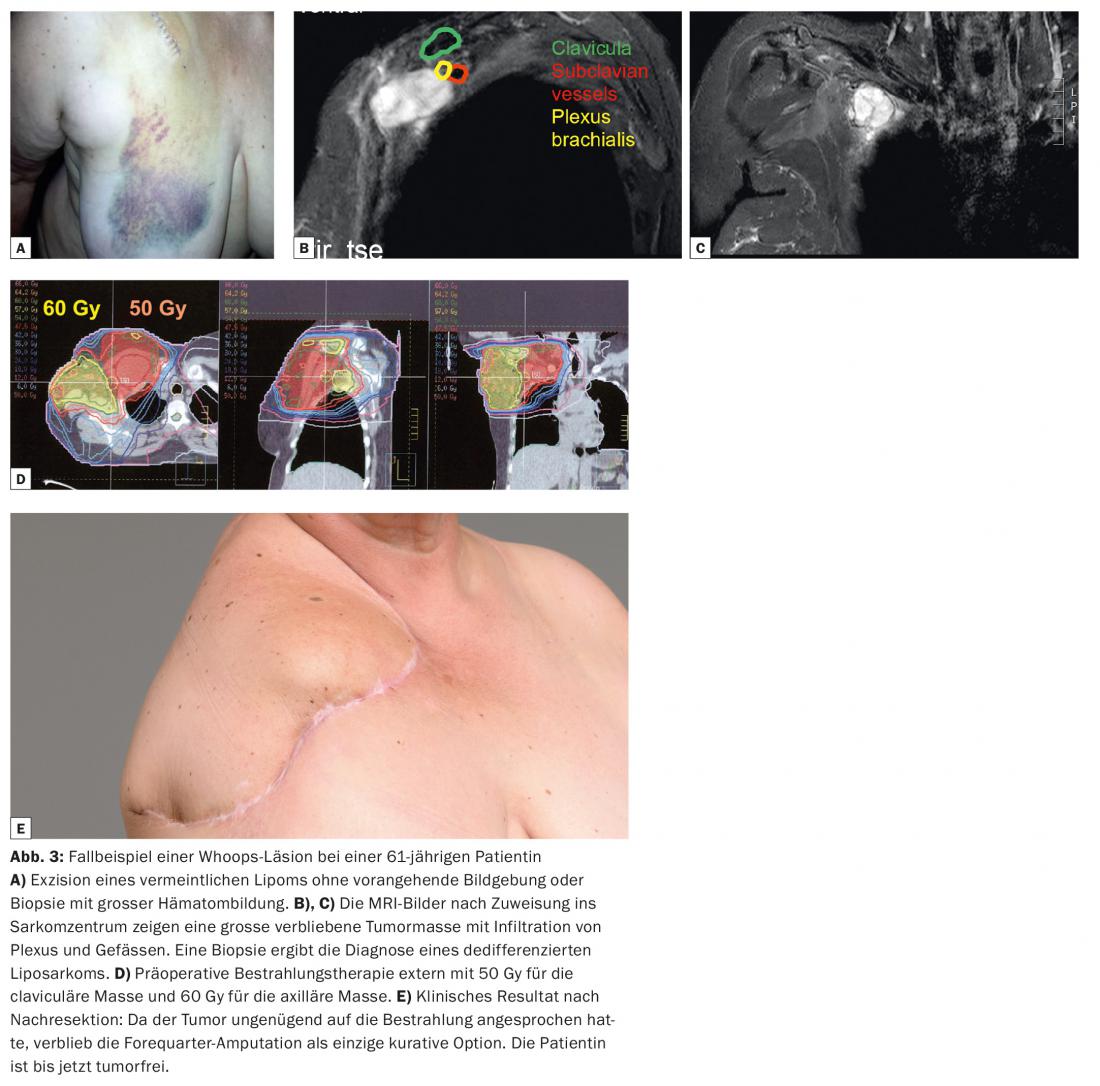
Las extirpaciones imprevistas e incorrectas de un sarcoma de tejidos blandos tienen consecuencias de largo alcance para el paciente afectado. En general, la tasa de supervivencia a 5 años es menor y la tasa de recidiva local mayor que en los pacientes con una terapia interdisciplinar adecuada [3–5]. En la literatura se han descrito tasas de recidiva local tras lesiones Whoops de hasta el 39%. Además, la supervivencia específica de la enfermedad a los cinco años, del 69,8%, es significativamente inferior que con la resección planificada (87,5%). La resección posterior de la antigua zona quirúrgica puede dar lugar a grandes defectos en la piel y los tejidos blandos. Por lo tanto, debe utilizarse un colgajo de tejido blando o un injerto de piel con mucha más frecuencia (hasta en un 30% de los casos) para lograr una cobertura suficiente del tejido blando. Esto conlleva una mayor tasa de complicaciones perioperatorias y peores resultados funcionales. Como muestra nuestro estudio de caso (Fig. 3), a veces hay que plantearse incluso una amputación, que podría haberse evitado en primer lugar.
Resumen
Las extirpaciones no planificadas de sarcomas de partes blandas pueden producirse en un 20-50% de los pacientes con sarcoma de partes blandas recién diagnosticado. Por lo tanto, éstos ya deberían ser remitidos en primer lugar a un centro de sarcomas. La resección del lecho tumoral suele recomendarse tras una resección imprevista, a menudo en combinación con radioterapia, con el fin de extirpar lo más completamente posible el tejido tumoral que suele quedar. La cirugía posterior a la escisión es más extensa que la cirugía primaria, da lugar a una mayor morbilidad y requiere con mayor frecuencia una amplia reconstrucción de los tejidos blandos. Tras una lesión Whoops, la radiación por sí sola parece no ser suficientemente eficaz, pero se utiliza como terapia adyuvante a la cirugía si debe considerarse la cirugía para mutilar. Las escisiones no planificadas de sarcomas de partes blandas se asocian a una mayor tasa de recidiva local y a un pronóstico generalmente peor. Por ello, la Junta Consultiva Nacional Suiza sobre Sarcomas (www.sarcoma.ch) ha elaborado una serie de directrices para prevenir los errores de diagnóstico y la mala gestión.
Literatura:
- O’Sullivan B, et al: Radioterapia preoperatoria frente a postoperatoria en el sarcoma de partes blandas de las extremidades: un ensayo aleatorizado. Lancet 2002; 359(9325): 2235-2241.
- Jones DA, et al: Gestión de la escisión no planificada para el sarcoma de tejidos blandos con radioterapia preoperatoria seguida de resección definitiva. Am J Clin Oncol 2014.
- Chandrasekar CR, et al: El efecto de una escisión no planificada de un sarcoma de tejidos blandos sobre el pronóstico. J Bone Joint Surg Br. 2008; 90(2): 203-208.
- Noria S, et al: Enfermedad residual tras la escisión no planificada de un sarcoma de partes blandas de una extremidad. J Bone Joint Surg Am 1996; 78(5): 650-655.
- Potter BK, et al: Recidiva local de la enfermedad tras escisiones no planificadas de sarcomas de tejidos blandos de alto grado. Clin Orthop Relat Res 2008; 466(12): 3093-3100.
Bibliografía adicional, Documento clave:
- Pretell-Mazzini J, et al: Escisión no planificada de sarcomas de partes blandas: conceptos actuales para la gestión y el pronóstico. J Bone Joint Surg Am 2015; 97(7): 597-603.
Bibliografía adicional del editor
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(8): 26-29











