Los linfomas MALT afectan con mayor frecuencia al estómago. Causalmente, existe una fuerte asociación con la gastritis por Helicobacter pylori (Hp) (más del 90% de los pacientes). Con una antibiosis adecuada, el Hp puede erradicarse, lo que conduce a una remisión completa en casi el 80% de los pacientes con linfoma MALT en fase inicial. El diagnóstico del linfoma MALT recae en gran medida en el ámbito de la evaluación morfológica del patólogo. La translocación específica t(11;18)(q21;q21) tiene una importancia conceptual, fisiopatológica, pronóstica, predictiva y, cada vez más, terapéutica.
El tejido linfoide asociado a la mucosa (MALT) es un segundo compartimento, biológicamente diferente, junto al tejido linfoide somático nodal. La importancia conceptual y la mejor comprensión de los linfomas de origen extraganglionar frente a los equivalentes ganglionares tienen su origen en el trabajo de Isaacson y Wright hace 30 años con la descripción inicial del linfoma MALT (MALTL) en estómago, pulmón, glándula salival y tiroides [1]. El reconocimiento de frecuencias variables de aberraciones genéticas en el MALTL de diferentes procedencias da cada vez más importancia a la especificidad de los órganos. Sin embargo, entre muchos otros, el estómago sigue siendo el órgano más frecuentemente afectado por el MALTL.
El concepto de infección
En sentido estricto, el desarrollo del concepto MALT comienza en realidad otros 20 años antes con la descripción del “linfoma mediterráneo” en el intestino delgado, caracterizado por la malabsorción y la formación de inmunoglobulina (Ig) abortiva formada por cadenas pesadas α defectuosas sin cadenas ligeras, para el que se acuñó el término “enfermedad de la cadena α” [2].
En el caso del linfoma, más tarde también conocido como “enfermedad inmunoproliferativa del intestino delgado” (IPSID), los estadios tempranos podían entrar en remisión bajo antibiosis, naciendo así la idea del tumor sensible a los antibióticos desencadenado por antígenos (Ag) [3]. Con la asociación documentada con la gastritis por Helicobacter pylori (Hp) en más del 90% de los pacientes con MALTL, la relación causal entre la infección previa por Hp y el posterior desarrollo del tumor fue rápida
establecido [4].
Helicobacter pylori
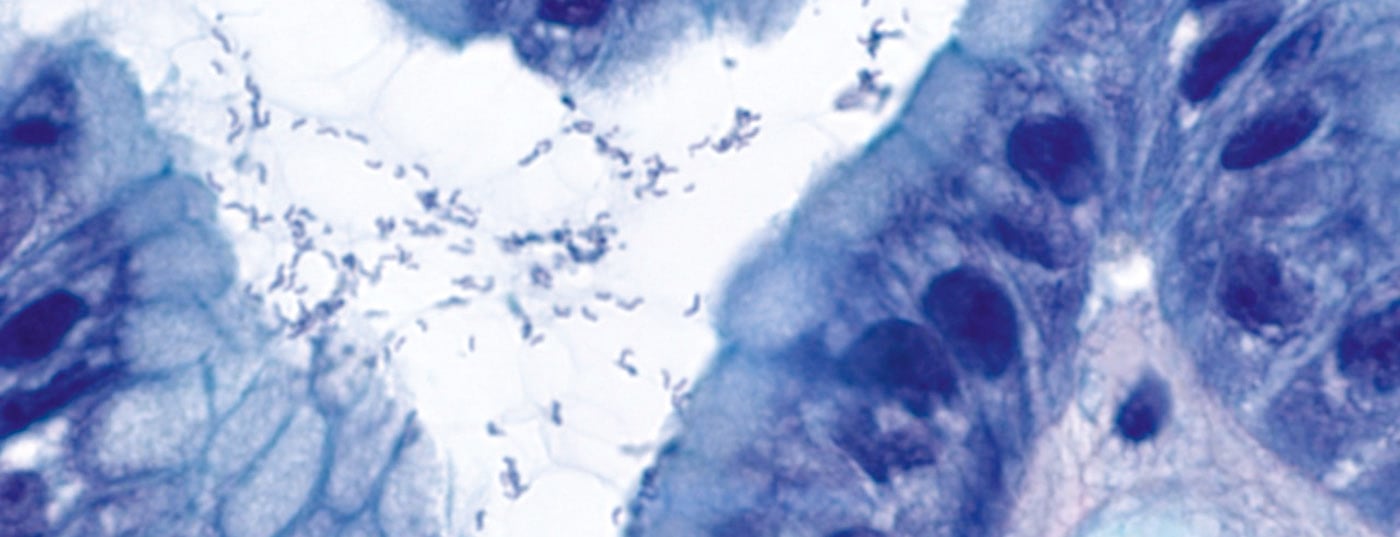
También han pasado 30 años desde la primera descripción de Hp (Fig. 1 ) como “bacilos curvos no identificados en el estómago de pacientes con gastritis y ulceración péptica” por Barry Marshall y John Robin Warren [5]. Ambos recibieron el Premio Nobel de Medicina en 2005 por este descubrimiento. En concreto, la infección por Hp provoca gastritis crónica y conduce a la adquisición de tejido linfoide asociado a la mucosa, a partir del cual la selección clonal puede dar lugar al MALTL.
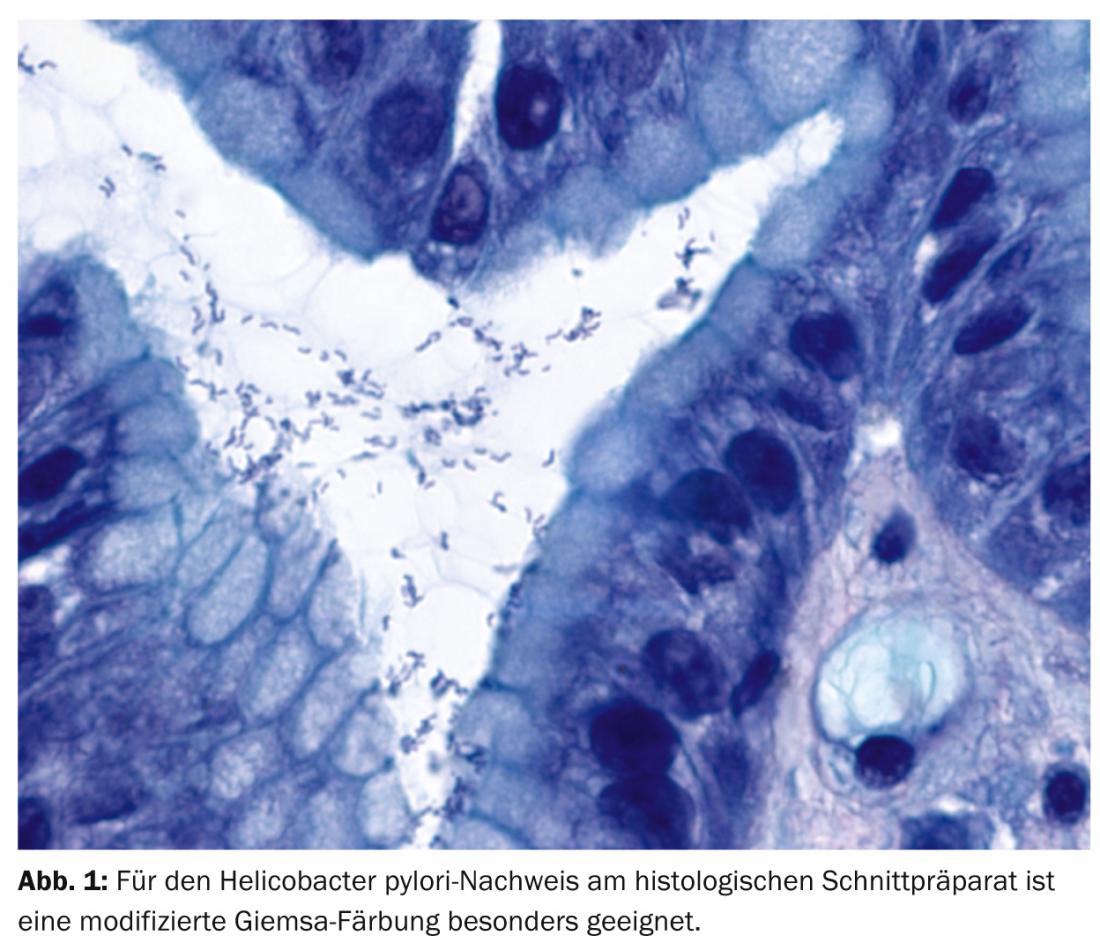
La estimulación indirecta y directa de los linfocitos B por Ag desencadenada por Hp está mediada por células presentadoras de Ag y linfocitos T intratumorales específicos de Hp. La respuesta inmunitaria, es decir, la producción de anticuerpos anti-Hp y de Ig idiotípicas, no puede eliminar eficazmente el Ag. Sin embargo, el Hp puede erradicarse con una antibiosis adecuada y puede lograrse una remisión completa del linfoma en casi el 80% de los pacientes en la fase inicial del MALTL [6].
Una mejor comprensión del revolucionario cambio de paradigma terapéutico para tratar con éxito un tumor con antibióticos procede del continuo biológico de infiltraciones linfoproliferativas en el estómago que comienza con la gastritis Hp y termina con el linfoma de células B transformado altamente maligno.
Hp-positivo/Hp-negativo
A falta de una norma de referencia, se realizan pruebas combinadas para la detección de Hp en pacientes sintomáticos, por lo que la detección suele ser falsa negativa en caso de tratamiento prolongado con bloqueantes H2. Clínicamente, los distintos tipos de Hp difieren en términos de virulencia, asociándose las cepas Cag-A+ con una morbilidad significativamente mayor en los pacientes.
Alrededor del 10% de los pacientes con MALTL son Hp-negativos; es probable que tengan un peor pronóstico en términos de supervivencia global. Es comprensible que la terapia de erradicación por sí sola rara vez consiga curarlas, por lo que es necesaria una terapia antitumoral. El Helicobacter heilmannii sólo interviene en alrededor del uno por mil de todas las infecciones por Hp en humanos.
Vacunación contra la Hp
Con una incidencia media de la infección por Hp del 30% y el riesgo asociado de desarrollar gastritis B, úlcera gástrica, MALTL o incluso carcinoma gástrico, la urgencia de la profilaxis es evidente. Hasta la fecha, sin embargo, las vacunas contra el Hp sólo se han utilizado en ratones en el laboratorio. No obstante, en el experimento se puede lograr una reducción significativa de la colonización bacteriana, lo que también demuestra que las vacunas desencadenan una respuesta inmunitaria en el huésped y que, por tanto, tienen potencial de erradicación. Sin embargo, la respuesta inmunitaria natural permanece ligada a las células T reguladoras, lo que a su vez limita la eliminación del Hp. Cabe esperar más de futuros conceptos de vacunación que puedan eludir o anular la regulación inmunitaria ligada al huésped [7].
Morfología
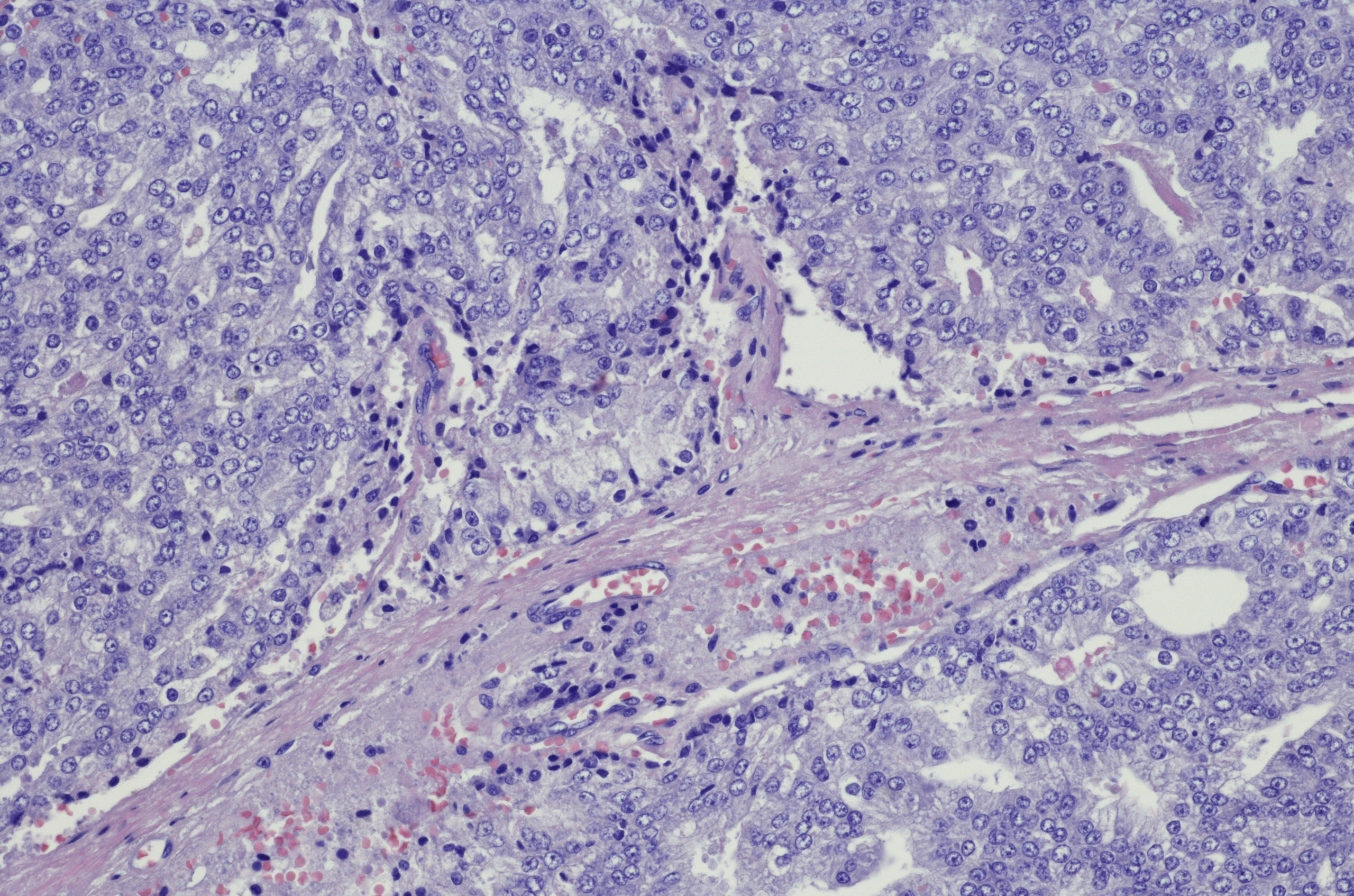
En el enfoque rutinario del patólogo, el diagnóstico del MALTL recae en gran medida en el ámbito de la morfología. Así, la biopsia gástrica muestra un linfoproliferado difuso en la mucosa y la submucosa con focos de infiltración bastante circunscritos en el epitelio superficial y el cuerpo glandular, las denominadas lesiones linfoepiteliales (Fig. 2).
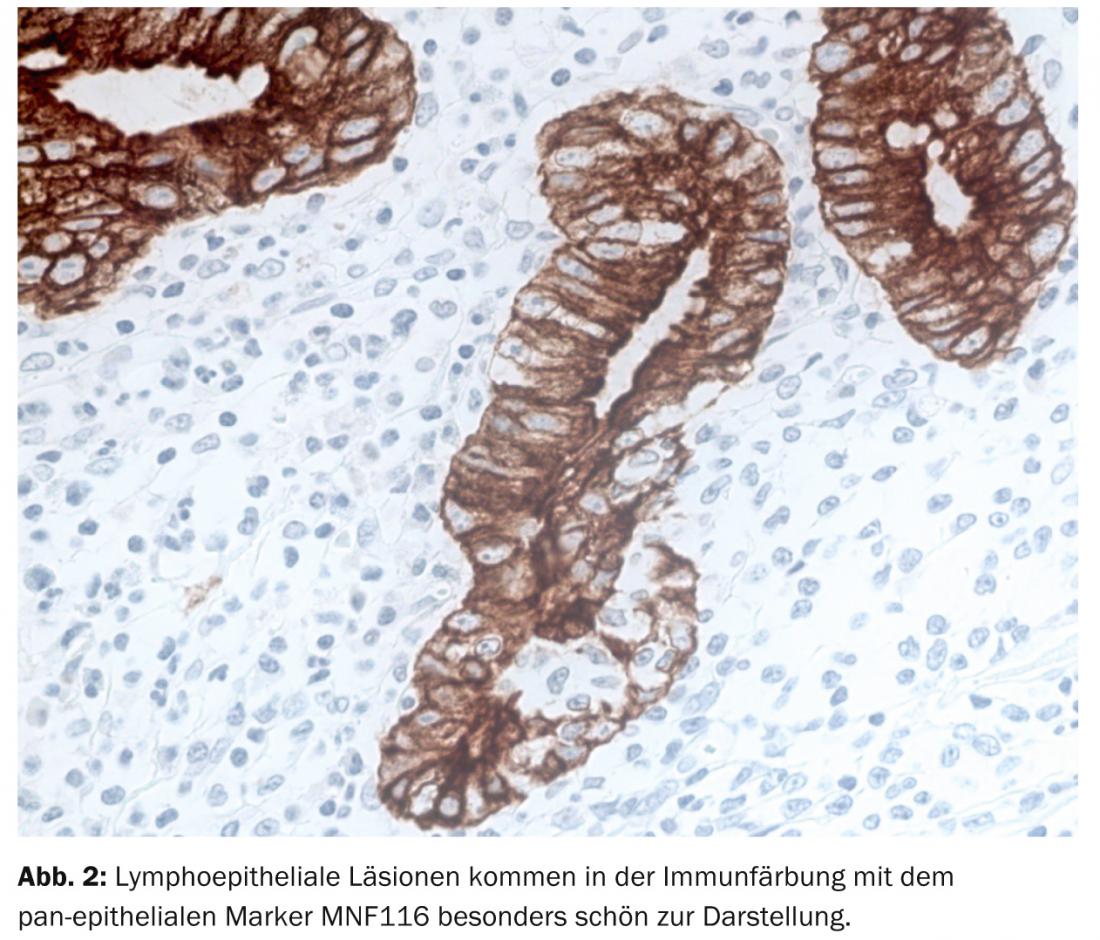
Se encuentran folículos linfáticos reactivos residuales intratumorales, que en un primer momento son dejados de lado por el tumor, pero que posteriormente son colonizados por éste. Citomorfológicamente, las células tumorales son de tamaño pequeño a mediano y de forma variable centrocitoide, linfocitoide o monocitoide. Además, el MALTL muestra una diferenciación de células plasmáticas típicamente dirigida contra el epitelio de superficie. Al igual que en otros linfomas de baja malignidad, en el MALTL también es posible la transformación en linfoma blástico.
Perfil inmunológico
Según la clasificación vigente de la OMS de 2008, el MALTL no tiene un perfil inmunológico específico y, por tanto, no puede definirse en términos de inmunofenotipo. Más bien, simplemente permanece como la última opción en términos de diagnóstico diferencial en comparación con otros linfomas de células B poco malignos, quasi per exclusionem. La positividad es obligatoria para CD20 y, como expresión de la diferenciación de las células plasmáticas, suele ser incluso algo más pronunciada para CD79a, mientras que la detectabilidad de Ig monotípicas depende en gran medida de la calidad de la biopsia. Típicamente, existe positividad para CD21, CD35, CD43, Bcl-10, IRTA-1 y T-bet, pero todos ellos pueden expresarse como marcadores inespecíficos en otros subtipos de linfoma. En última instancia, el factor más útil para el diagnóstico es probablemente la falta de detección de CD10 o de ciclina D-1 y SOX-11 en la diferenciación del linfoma folicular y el linfoma de células del manto.
Marcadores moleculares
En la interpretación de las infiltraciones linfoproliferativas equívocas de células B en el estómago, el análisis de clonalidad en la PCR tiene un diagnóstico diferencial importancia, pero en última instancia la detección de la clonalidad es pragmáticamente irrelevante para las consecuencias terapéuticas inmediatas, ya que la erradicación de Hp con antibióticos se realiza tanto para la gastritis Hp policlonal como para el MALTL monoclonal en la fase temprana dependiente de Ag. A modo de inserción, cabe señalar que la “gastritis clonal” es diagnosticada con mucha más frecuencia por los gastroenteropatólogos de lo que sería correctamente reconocida por los hematopatólogos [8].
Del mismo modo, la detección de una rotura del gen MALT-1 no desempeña ningún papel en el diagnóstico rutinario del MALTL, aunque más adelante hablaré del significado más preciso de la translocación t(11;18)(q21;q21) en el MALTL gástrico.
Biología molecular específica de MALTL
Diagnósticamente, la translocación recíproca recurrente t(11;18)(q21;q21) que da lugar al híbrido de fusión quimérico BIRC3(API2)-MALT1 es la aberración estructural más específica en el MALTL gástrico [9], que puede detectarse en el 30-50% de los pacientes mediante análisis FISH (Fig. 3).
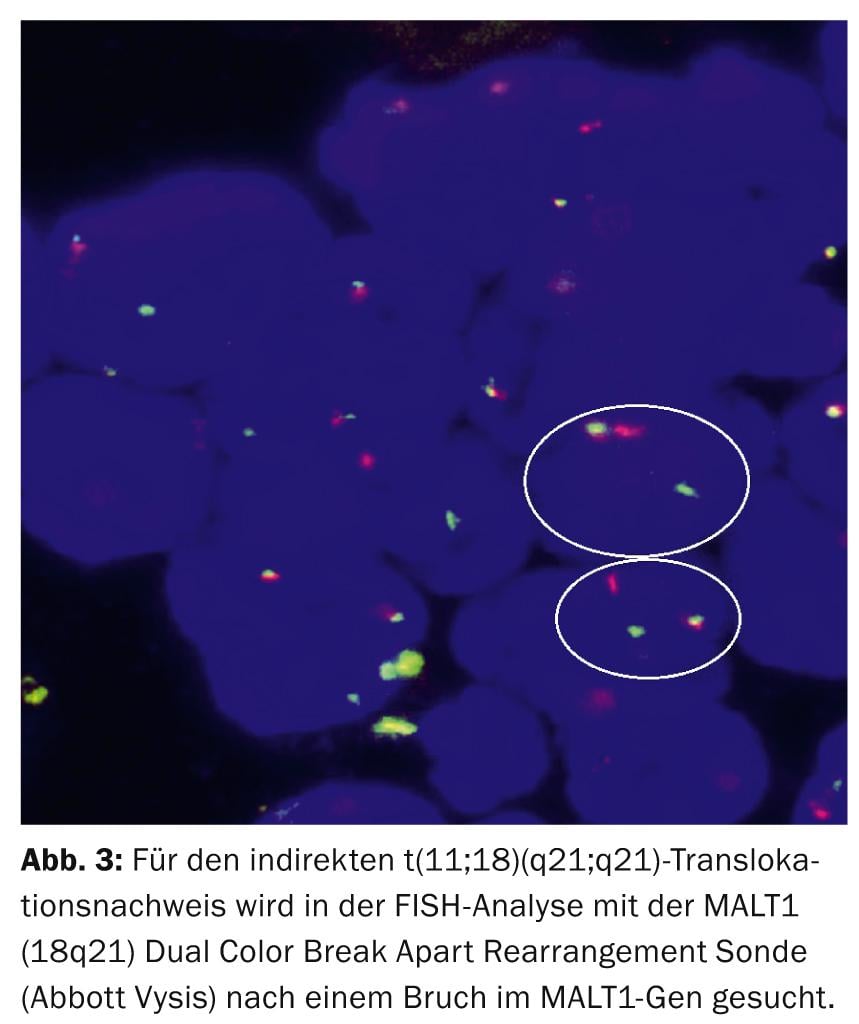
Fisiopatológicamente, la t(11;18)/BIRC3(API2)-MALT1 en sinergia con las translocaciones t(1;14)/BCL10-IGH y t(14;18)/IGH-MALT1 y la mutación TNFAIP3 conduce a la inhibición sincrónica de la apoptosis y la activación de NF-κB a través de la interacción oncogénica de MALT1 y BCL10.
Desde el punto de vista pronóstico, la t(11;18) suele caracterizar a los casos con alta estabilidad cariotípica como única aberración genética y es protectora frente a una posible transformación blástica. La translocación t(11;18) se detecta con mayor frecuencia en el MALTL con un estadio inicial avanzado y un curso más agresivo, progresión tumoral y diseminación a otros órganos, y se asocia con mayor frecuencia a cepas de Hp Cag-A+.
Predictivamente, en el MALTL t(11;18)-positivo, el desarrollo tumoral no está desencadenado por el Hp y, en consecuencia, el 78% de estos pacientes también son refractarios a la terapia sólo con la erradicación del Hp. Sin embargo, el supuesto fracaso terapéutico más frecuente se debe a que el intervalo de control es demasiado corto y, por tanto, a la impaciencia del paciente o del oncólogo. También es importante diferenciar claramente entre la colonización persistente por Hp de la mucosa gástrica, la evidencia histológica de infiltrados linfoides residuales en la biopsia gástrica repetida o simplemente un clon de células B persistente en la PCR.
Desde el punto de vista terapéutico, recientemente se ha probado directamente la actividad antitumoral de los inhibidores de MALT1 in vitro [10].
Biología molecular inespecífica del MALTL
Por el contrario, las translocaciones t(3;14)/FOX-P1-IGH, t(3;14)/BCL6-IGH y t(8;14)/C-MYC-IGH se encuentran exclusivamente en MALTL transformados blasticamente como aberraciones genéticas estructurales inespecíficas. Las anomalías numéricas frecuentes, como la trisomía 3, que se asocia en un 80% a las trisomías 11, 12 o 18, la inestabilidad de los microsatélites/el desequilibrio alélico, la inactividad del TP53 o una deleción del p16 quedan por mencionar en aras de la exhaustividad.
Mensajes para llevar a casa
- El linfoma de células B altamente maligno del estómago puede considerarse una transformación blástica si se detecta un reordenamiento Ig isoclonal y la firma de expresión génica es idéntica a la del MALTL, aunque los mecanismos moleculares para ello aún no se hayan aclarado por completo.
- El Helicobacter heilmannii (Hh, Gastrospirillium hominis) sólo interviene en alrededor del uno por mil de todas las infecciones por Helicobacter en humanos. Los casos raros de linfoma MALT asociado al Hh pueden remitir por completo con una terapia de erradicación antibiótica, análoga a la del Hp.
- “El tumor es una enfermedad genética”: la translocación t(11;18)(q21;q21)/BIRC3(API2)-MALT1 es el biomarcador molecular más importante del linfoma MALT gástrico y tiene importancia diagnóstica, conceptual, fisiopatológica, pronóstica, predictiva y terapéutica.
PD Dr. med. Sergio B. Cogliatti
Literatura:
- Isaacson PG, Wright DH: Linfoma maligno extranodal que surge del tejido linfoide asociado a la mucosa. Cáncer 1984; 53: 2515-2524.
- Frand U, et al: Linfoma maligno en Israel – un estudio epidemiológico sobre 399 casos. Harefua 1963; 65: 83-86.
- Galian A, et al: Estudio patológico de la enfermedad de la cadena alfa con especial énfasis en la evolución. Cáncer 1977; 39: 2081-2101.
- Doglioni C, et al: Alta incidencia de linfoma gástrico primario en el noreste de Italia. Lancet 1992; 339: 834-835.
- Marshall BJ, Warren JR: Bacilos curvos no identificados en el estómago de pacientes con gastritis y ulceración péptica. Lancet 1984; 323: 1311-1315.
- Wotherspoon AC, et al: Regresión del linfoma gástrico primario de células B de bajo grado de tipo tejido linfoide asociado a mucosa tras la erradicación del Helicobater pylori. Lancet 1993; 342: 575-577.
- Czinn SJ, Blanchard T: Vacunación contra la infección por Helicobater pylori. Nat Rev Gastroenterol Hepatol 2011; 8: 133-140.
- Hummel M, et al: Los criterios de Wotherspoon combinados con el análisis de clonalidad de células B mediante tecnología avanzada de reacción en cadena de la polimerasa discriminan el linfoma gástrico de zona marginal encubierto de la gastritis crónica. Gut 2006; 55: 782-787.
- Mathijs B, Marynen P: t(11 ;18)(q21 ;q21) BIRC3/MALT1. Atlas Genet Cytogenet Oncol Haematol 2002; 6: 34-36.
- Burgess DJ: Asalto al MALT1. Nature Reviews Cancer 2013; 13: 80-81.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(1): 22-26