En el Congreso de la EHA celebrado en Milán, el mieloma múltiple fue el centro de atención de varios actos. ¿Qué resultados producen actualmente los inhibidores del proteasoma y los fármacos inmunomoduladores y qué prometen para el futuro? ¿Cómo se puede mejorar la situación terapéutica de los pacientes mayores? Tres expertos proporcionaron información al respecto.
(ag) En relación con el uso de la pomalidomida en el mieloma múltiple avanzado recidivante y refractario (rrMM), el Prof. Meletios Dimopoulos, MD, Atenas, Grecia, afirmó: “Basándonos en las pruebas actualmente disponibles, la pomalidomida y las dosis bajas de dexametasona se toleran bien en el rrMM y constituyen una opción de tratamiento eficaz para los pacientes que han agotado la terapia con lenalidomida y bortezomib.” La dosis inicial óptima es de 4 mg/tgl. Pomalidomida en los días 1-21 de cada ciclo de 28 días, independientemente de las comorbilidades. Según el Prof. Dimopoulos, no es necesario utilizar la dosis de 4 mg/tgl. Ajustar al deterioro de la función renal de leve a moderado (CrCl ≥45 ml/min). Sin embargo, debe llevarse a cabo una estrecha vigilancia de los efectos secundarios. La dexametasona se administra en dosis de 40 mg semanales. Para pacientes mayores de 75 años, reducir a 20 mg.
“El tratamiento debe continuarse hasta que se produzca una progresión o toxicidades inaceptables. Es posible modificar la dosis en pacientes con neutropenia, trombocitopenia y otros acontecimientos adversos de grado 3 – 4. Debe considerarse la profilaxis para prevenir las infecciones y el tromboembolismo venoso (TEV)”, afirma el experto. Una de ellas incluye, por ejemplo, la administración de factor estimulante de colonias de granulocitos (G-CSF) en los ciclos 1-3 para prevenir la neutropenia, antibióticos (ciclos 1-3) para reducir el riesgo de infección y tromboprofilaxis (aspirina y heparina fraccionada de bajo peso molecular en alto riesgo) para minimizar el riesgo de TEV en todos los pacientes.
Paisaje terapéutico 2014
El Prof. Paul G. Richardson, MD, de Boston, resumió la situación de los nuevos agentes de la siguiente manera:
Los inhibidores del proteasoma (IP) y los fármacos inmunomoduladores (IMiD) muestran mejoras significativas en la supervivencia libre de progresión y global [1]. A medida que se conoce mejor su modo de acción, surgen nuevas combinaciones terapéuticas. Un problema grave es la disminución de la duración de la respuesta y de las tasas de supervivencia cuando se suman los regímenes terapéuticos de rescate que han tenido éxito [2]. Los inhibidores del proteasoma de nueva generación, como el carfilzomib, se están investigando actualmente en combinación con lenalidomida y dexametasona en ensayos de fase III.
- La función inmunitaria en la línea de base parece ser un punto de inflexión clave para el éxito. Puede ser posible dirigirse a ellos (con el bloqueo PD1/PDL1).
- Los anticuerpos monoclonales muestran actividad en formas de alto riesgo de la enfermedad y representan nuevas vías de acción (al igual que otros inmunoterápicos). El daratumumab, un anticuerpo monoclonal CD38 humano, demostró una destrucción eficaz de las células tumorales que expresan CD38 en estudios in vitro. Por lo tanto, se sospecha de su eficacia clínica. Actualmente se está investigando el efecto sinérgico de una combinación de daratumumab, lenalidomida y dexametasona. Los resultados [3] se presentaron en ASCO 2014 y son prometedores en cuanto al perfil de seguridad y actividad.
- Muchos otros de los llamados “inhibidores de moléculas pequeñas” ofrecen esperanzas. El Prof. Richardson también presentó en la ASCO de este año un estudio sobre el inhibidor de la histona deacetilasa (HDAC) panobinostat: Demostró que la combinación de panobinostat más bortezomib más dexametasona mejoraba la supervivencia libre de progresión de forma muy significativa (concretamente en una mediana de 3,9 meses) en comparación con los otros dos agentes por sí solos. Las tasas de respuesta completa también fueron casi el doble en comparación con el brazo de control [4].
El factor “edad
El Prof. Dr. med. Thierry Facon, de Lille, habló sobre las opciones terapéuticas de los pacientes recién diagnosticados de MM que no son aptos para un trasplante de células madre: “El mieloma múltiple es principalmente una enfermedad de ancianos. Sin embargo, una edad más avanzada casi siempre descarta el trasplante.
¿Cuáles son las opciones para esta población? En el estudio FIRST [5], pudimos demostrar que la terapia oral continua con lenalidomida + dosis bajas de dexametasona era significativamente superior a la combinación triple de melfalán + prednisona + talidomida y lenalidomida + dexametasona durante 18 ciclos.” La supervivencia libre de progresión fue de 25,5, 21,2 y 20,7 meses, respectivamente. También encontramos un beneficio de esta opción de tratamiento en el análisis provisional de la supervivencia global. Así que hay que considerar el régimen continuo como una nueva norma aquí”.
Los factores asociados a una menor supervivencia durante la terapia con melfalán + prednisona + talidomida y/o bortezomib incluyen según un metaestudio [6]:
- Edad (>75 años)
- Insuficiencia renal
- efectos secundarios cardíacos/infecciosos graves
- Terminación de la terapia
Un estudio presentado también en el Congreso de la EHA de 2014 halló un riesgo significativamente mayor de toxicidades y malos resultados (supervivencia global) en los pacientes frágiles (es decir, de edad avanzada, con comorbilidades y en mal estado cognitivo y funcional) [7].
Retos para el futuro
En consecuencia, según el Prof. Facon, en los últimos años se han realizado grandes progresos en aquellos pacientes con MM que son aptos para un trasplante de células madre.
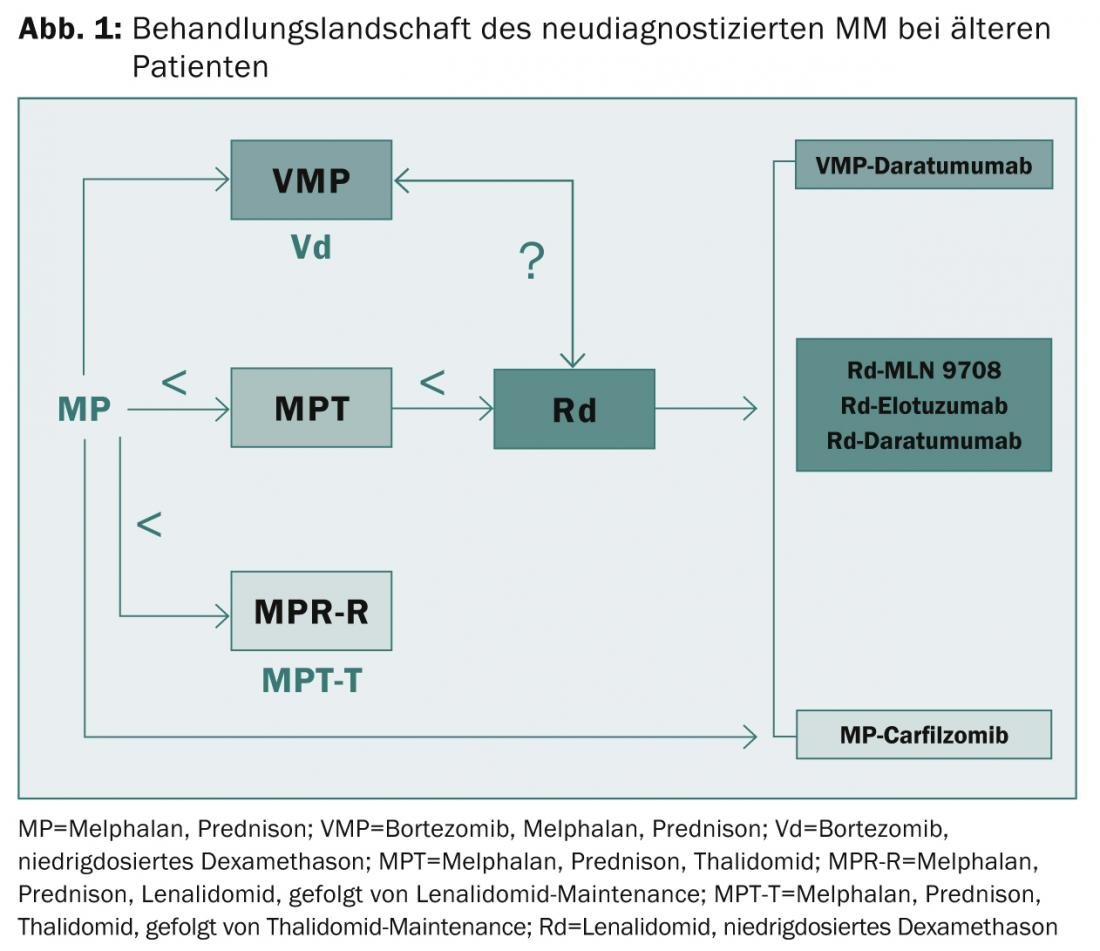
están fuera de cuestión. La mediana de supervivencia libre de progresión se prolongó de unos 10-15 a 25-30 meses y la supervivencia global de unos 30 a 60 meses. “Sin embargo, los pacientes de alto riesgo siguen sufriendo un resultado muy malo incluso con los nuevos agentes de primera generación”, resumió el experto. “Por tanto, la necesidad de opciones de tratamiento innovadoras y de una evaluación de riesgos adecuada sigue siendo grande. Los pacientes frágiles plantean un reto permanente. En este contexto, puede ser útil para evaluar con precisión la función de los órganos, las comorbilidades, las fragilidades y las discapacidades”, explicó el profesor Facon. “La IP, los IMiD y los anticuerpos monoclonales de segunda y tercera generación desempeñarán un papel crucial en la resolución de estos problemas en el futuro (Fig. 1)“.
Fuente: Congreso EHA 2014, 12-15 de junio de 2014, Milán
Literatura:
- Kumar SK, et al: Blood 2008 Mar 1; 111(5): 2516-2520.
- Kumar SK, et al: Mayo Clin Proc 2004 Jul; 79(7): 867-874.
- Plesner T, et al: J Clin Oncol 2014; 32: 5s (suppl; abstr 8533).
- Richardson PG, et al: J Clin Oncol 2014; 32: 5s (suppl; abstr 8510).
- Facon T, et al: EHA 2014 #Abstract S643.
- Bringhen S, et al: Haematologica 2013 Jun; 98(6): 980-987.
- Mina R, et al: EHA 2014 #Abstract P354.
InFo Oncología y Hematología 2014; 2(6): 31-32