La endocarditis infecciosa es una infección del endocardio y especialmente de las valvas de la válvula con una incidencia anual de 3-10/100.000 personas. Con una mortalidad y morbilidad elevadas, las estrategias de prevención, como el cumplimiento de la profilaxis antibiótica (PA) en pacientes con afecciones cardiacas preexistentes, son una prioridad absoluta. Las directrices actuales limitan la AP a los pacientes de alto riesgo y a los procedimientos realizados principalmente en el área bucodental.
La endocarditis infecciosa (EI) es una infección del endocardio y, en particular, de las valvas de la válvula, con una incidencia anual de entre 3 y 10 por cada 100.000 personas [1–3]. La característica principal de la EI son las vegetaciones valvulares infectadas, que pueden embolizarse en el organismo y formar otros focos sépticos de infección. El pronóstico de la enfermedad es malo, con una mortalidad intrahospitalaria del 15-20% y a un año del 30% [1,4]. La morbilidad en los supervivientes es elevada, con riesgo residual de recidiva, nueva infección o deterioro progresivo de la función valvular, que puede asociarse a insuficiencia cardiaca y a la necesidad de nuevas intervenciones médicas y quirúrgicas [1,4]. A pesar de las mejoras en las terapias médicas y quirúrgicas de los últimos 30 años, la EI sigue siendo una de las enfermedades infecciosas más mortíferas.
Con una mortalidad y una morbilidad persistentemente elevadas, las estrategias de prevención como el cumplimiento de la profilaxis antibiótica (PA) en pacientes con afecciones cardiacas preexistentes son una prioridad absoluta. Las directrices de la AP sobre endocarditis fueron establecidas por primera vez por la Asociación Americana del Corazón (AHA) en 1955, aunque las directrices han cambiado considerablemente desde su introducción. Así, muchos países y sociedades profesionales han modificado las directrices y las han adaptado a sus propias necesidades. Además, en 2008 se llevó a cabo una simplificación.
La necesidad de blindaje antibiótico se ha limitado a los pacientes de alto riesgo, y los pacientes con riesgo intermedio de EI ya no se incluyen en la mayoría de las directrices actuales. Entre ellos se incluyen la válvula aórtica bicúspide, el prolapso de la válvula mitral, así como la comunicación interventricular (CIV) y el conducto persistente botálico (CAP). Debido a la falta de datos clínicos (especialmente la ausencia de un ensayo controlado aleatorizado sobre el tema), la AP para prevenir la EI sigue siendo un tema controvertido. Actualmente, las siguientes directrices son válidas para Suiza: las directrices de la AHA de 2007 [3], las directrices de la AP revisadas en 2008 por Flückiger et al. [5] y las Directrices de la ESC de 2015 [6]. Desde 2008, no se han revisado las directrices suizas sobre profilaxis de la endocarditis [5]. Dado que existen ciertas divergencias con respecto a las Directrices del CES 2015 [6] sobre el tema, nos gustaría aprovechar esta oportunidad para debatir algunos puntos e innovaciones.
Antecedentes históricos: el camino hacia la simplificación y la restricción
La EI como entidad patológica fue descrita por primera vez en 1870 por Winge et al. descrito [8]. La hipótesis de que las bacterias pueden entrar en la circulación durante un procedimiento dental invasivo y causar así una EI fue planteada por primera vez por Lewis y Grant en 1923, aunque esta tesis no fue demostrada hasta 1935 por Okell y Elliott. Así, estos autores pudieron deducir que el 61% de los pacientes tienen hemocultivos positivos para Streptococcus viridans tras la extracción dental, mientras que se sabe que el Streptococcus viridans se identifica como germen causante en el 40-45% de los casos de EI. Conociendo el efecto antimicrobiano de las sulfonamidas, se postuló por primera vez en 1930 que una AP podría conducir a una reducción de la frecuencia de las EI. Primero Hirsch et al. demostró una reducción de la bacteriemia estreptocócica con penicilina en un ensayo aleatorio, allanando el camino para las primeras directrices oficiales de la AHA sobre la profilaxis de la endocarditis en 1955.
Directrices suizas para la profilaxis de la endocarditis
Después de que Moreillon publicara las primeras directrices suizas sobre el tema en 2000 [9], éstas se simplificaron considerablemente en 2008. Esto se basó en las siguientes consideraciones:
- Las actividades cotidianas como cepillarse o masticar tienen más probabilidades de causar EI que la cirugía dental
- Incluso con una eficacia del 100% de un PA, sólo se puede evitar un pequeño número de EI con PA
- Los pacientes de alto riesgo tienen más probabilidades de sufrir un curso letal de EI que otros pacientes
- Hay que tener en cuenta los efectos secundarios de los antibióticos y sus costes.
Las directrices suizas revisadas de 2008 sobre la profilaxis de la endocarditis [5] se basan en las de la AHA de 2007 [3] y en las de la AP alemana de 2007 [10]. El uso de profilaxis antibiótica para prevenir la EI se considera generalmente justificado porque la EI es poco frecuente pero se asocia a una elevada mortalidad y morbilidad. Además, la prevención farmacológica breve es preferible a la terapia prolongada de una infección, especialmente en pacientes con enfermedad cardiaca previa o episodios previos de EI que corren riesgo de recurrencia. Además, las bacterias de la flora bucal, gastrointestinal y del tracto urogenital pueden favorecer la EI. En última instancia, la eficacia de un PA para prevenir la EI sólo pudo demostrarse en experimentos con animales, pero es muy probable que un PA sea eficaz en humanos.
Medidas perioperatorias generales no específicas
Es importante cumplir las medidas perioperatorias generales, como una higiene dental, oral y cutánea exhaustiva en todos los pacientes, especialmente en el grupo de alto riesgo [6]. Una buena higiene bucal es mucho más importante en todos los casos que un antibiótico en algún momento de la vida, ya que la bacteriemia se produce a diario incluso al masticar y cepillarse los dientes. Evitar los piercings y los tatuajes también es muy importante en este contexto. Si existen heridas en el momento de la intervención, deben desinfectarse cuidadosamente. Además, cualquier foco infeccioso debe tratarse adecuadamente con antibióticos y erradicarse cualquier patógeno para reducir la colonización bacteriana. En los pacientes de alto riesgo, debe reservarse la indicación de catéteres venosos centrales y exámenes invasivos, y deben observarse urgentemente las medidas de higiene hospitalaria.
Indicaciones para la profilaxis de la endocarditis
La AP sólo se recomienda en pacientes de alto riesgo sometidos a procedimientos bien definidos que se asocian a un mayor riesgo de bacteriemia (Tab. 1) . Los pacientes que reciben profilaxis antibiótica perioperatoria no necesitan profilaxis contra la endocarditis porque las bacterias que se encuentran durante la cirugía programada ya están cubiertas por la administración del antibiótico elegido específicamente.
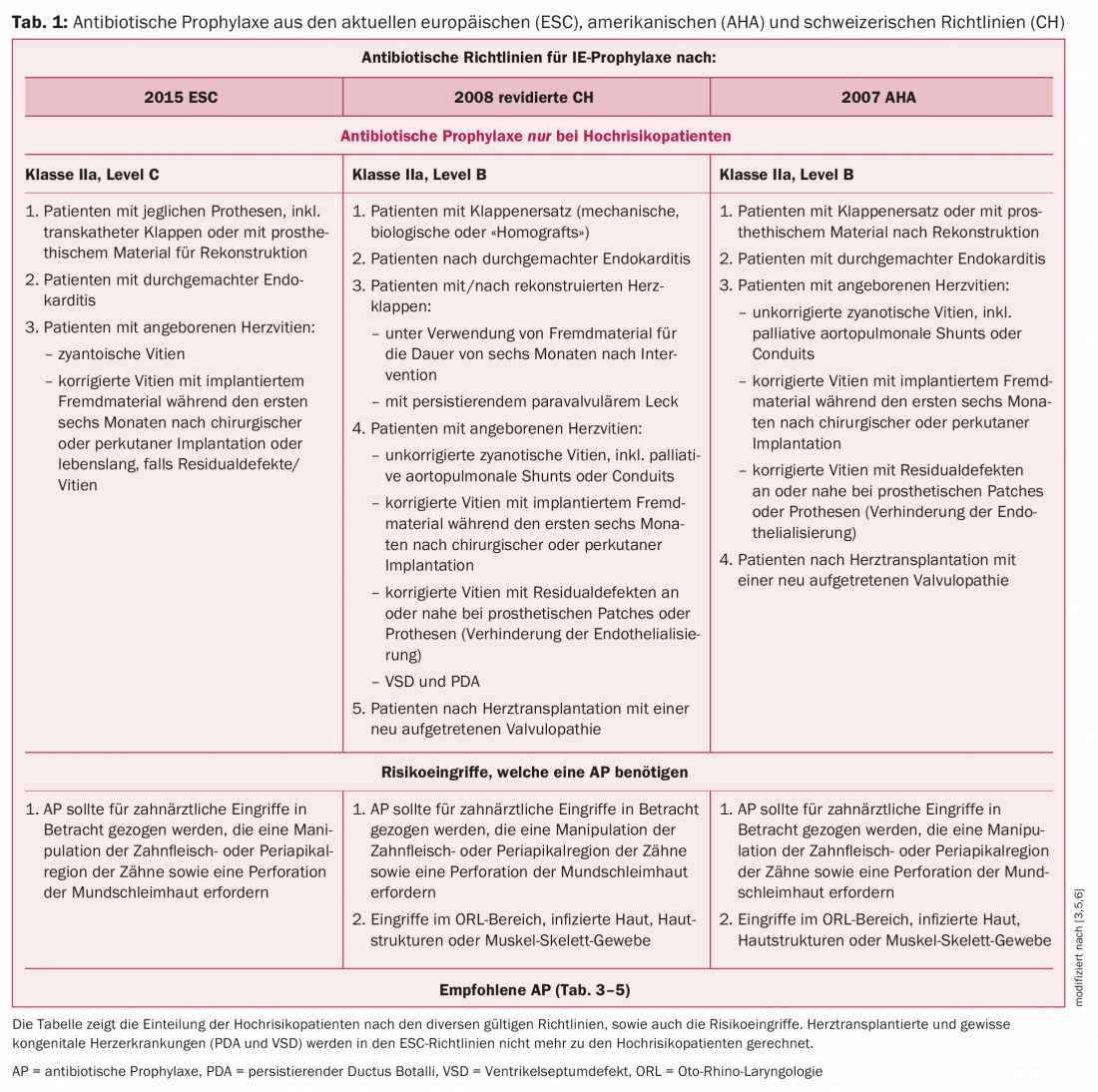
Los pacientes de alto riesgo se definen de forma diferente según las directrices. A grandes rasgos, este grupo puede dividirse en pacientes con material protésico, pacientes con cardiopatía congénita o endocarditis previa. Mientras que las directrices de la AHA y de Suiza seguían considerando a los pacientes con trasplante de corazón como pacientes de alto riesgo, las directrices europeas de 2015 ya no tienen en cuenta a este grupo para la profilaxis de la endocarditis. Se trata de un tema controvertido y existen diferentes opiniones al respecto según el grupo de trabajo. Debido a la inmunosupresión con mal pronóstico en la EI, así como a la valvulopatía presente con frecuencia (por ejemplo, regurgitación tricúspide como consecuencia de biopsias cardiacas repetidas), seguimos recomendando la AP antes de las intervenciones de alto riesgo, a diferencia de las directrices de la ESC. Para más detalles sobre la definición de pacientes de alto riesgo, véase la tabla 1 y la tabla 2.

Clasificación de la PA según las intervenciones y los sistemas de órganos
La PA se define como una dosis única (peroral o parenteral) de un antibiótico administrada 30-60 minutos antes de la intervención. El objetivo es maximizar la eficacia del antibiótico durante el procedimiento. Para pequeñas intervenciones, sobre todo procedimientos dentales o en la piel, se favorece la administración peroral, para intervenciones más grandes y/o anestesia la administración parenteral. AP como dosis única antes de limitar la intervención a los procedimientos dentales para prevenir el desarrollo de EI como resultado de una bacteriemia transitoria. Todos los demás procedimientos en el tracto respiratorio, la zona cutánea, el tracto urogenital y el tracto gastrointestinal sin evidencia de infección ya no son una indicación de AP [6]. Una excepción importante es la cirugía abdominal electiva, en la que se recomienda una única dosis parenteral (profilaxis antibiótica perioperatoria). En caso de infecciones preexistentes, el AP debe considerarse como la primera dosis de un tratamiento antibiótico más duradero y necesario. En este caso, recomendamos consultar a un infectólogo para ajustar de forma óptima la terapia antibiótica. Las recomendaciones de dosis para la profilaxis de AP única presuponen una función renal y hepática normal. El ajuste de la dosis no suele ser necesario para las dosis únicas, pero sí lo es, por supuesto, para las terapias a largo plazo. Las directrices de AP para los niños son muy similares a las de los adultos. La única diferencia en este caso es la dosis de antibióticos.
Procedimientos dentales
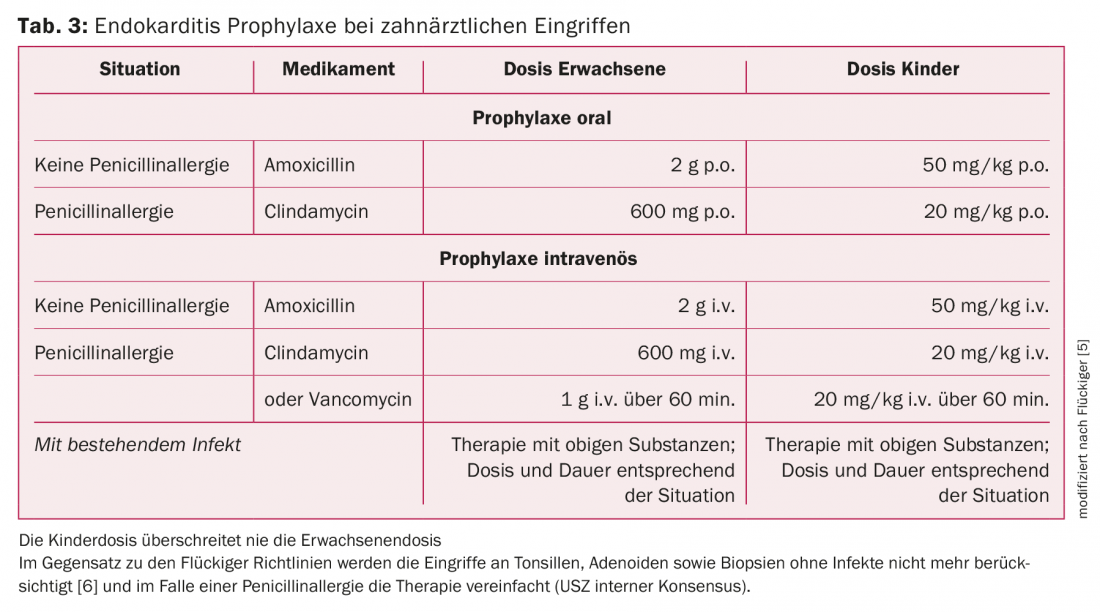
Dientes y/o mandíbulas: El principal requisito para reducir la frecuencia de las EI es una buena higiene bucal, ya que las manipulaciones cotidianas en la cavidad oral, como cepillarse los dientes, pueden provocar bacteriemia. Para los pacientes de riesgo, está indicada una revisión dental dos veces al año. La AP está indicada para manipulaciones dentales que afecten a la encía o a la región periapical de los dientes o perforen la mucosa oral (extracciones, procedimientos quirúrgicos, tratamientos de abscesos, terapia periodontal, biopsias). Los patógenos más comunes de la cavidad oral que pueden causar EI son los estreptococos del grupo viridans y, en consecuencia, la penicilina o la amoxicilina son los antibióticos de primera elección. En el caso de la alergia a la penicilina, las directrices suizas para la elección de antibióticos distinguen entre reacción de tipo tardío (cefuroxima) y reacción de tipo inmediato (clindamicina). Las directrices de la ESC simplifican esto y simplemente tratan cualquier alergia a la penicilina con clindamicina. Para más detalles sobre el AP recomendado, consulte la tabla 3.
Procedimientos no dentales
Vías respiratorias: En las directrices suizas de 2008, la AP se consideraba generalmente indicada. Teniendo en cuenta las directrices de la ESC de 2015, consideramos que una AP para broncoscopia, laringoscopia o intubación ya no está indicada. La AP tampoco está indicada para una amigdalectomía o una adenotomía a menos que exista una infección. Los pacientes de alto riesgo ( tab. 2 ) que se sometan a un procedimiento invasivo para tratar una infección establecida (drenaje de abscesos) deben recibir profilaxis o terapia similar a la que se aplica en los procedimientos dentales (tab. 3).
Tracto gastrointestinal: La mayoría de los procedimientos en el tracto gastrointestinal, como las endoscopias (gastroscopias o colonoscopias con o sin biopsia), no requieren AP. Sin embargo, en el caso de una infección establecida o cuando tiene sentido administrar un antibiótico para prevenir la infección de la herida o la sepsis en pacientes de alto riesgo, está indicado administrar un antibiótico. Además, los procedimientos abdominales electivos (colecistectomía, resección sigmoidea, apendicectomía) son una indicación de AP. En este caso, se recomienda AP parenteral 30 minutos antes de la intervención. La terapia de elección es la amoxicilina/ácido clavulánico, ya que el objetivo en este caso es cubrir los enterococos y los anaerobios. En caso de alergia a la penicilina, está indicada la vancomicina, aunque en este caso deben complementarse las sustancias activas contra las bacterias gramnegativas y anaerobias.
Para las infecciones preexistentes, el AP es la primera dosis de una terapia antibiótica más duradera y necesaria. De nuevo, se recomienda un antibiótico con actividad frente a enterococos, bacterias gramnegativas y anaerobias Para más detalles sobre las recomendaciones de AP en el tracto gastrointestinal, véase la tabla 4.
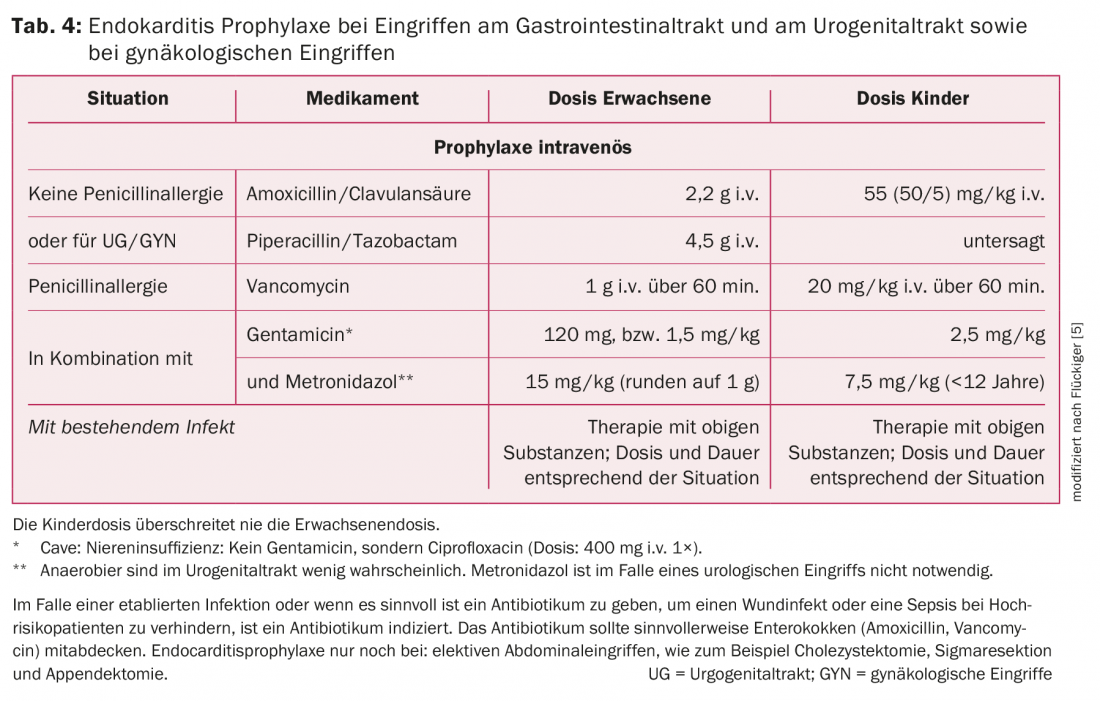
Tracto genitourinario: la cirugía o los procedimientos endoscópicos en presencia de orina estéril o ausencia de infección no requieren AP. Si hay infección, debe elegirse un antibiótico con efecto enterocócico. En determinadas circunstancias, es útil un suplemento con un preparado contra los gérmenes gramnegativos (tab. 5).
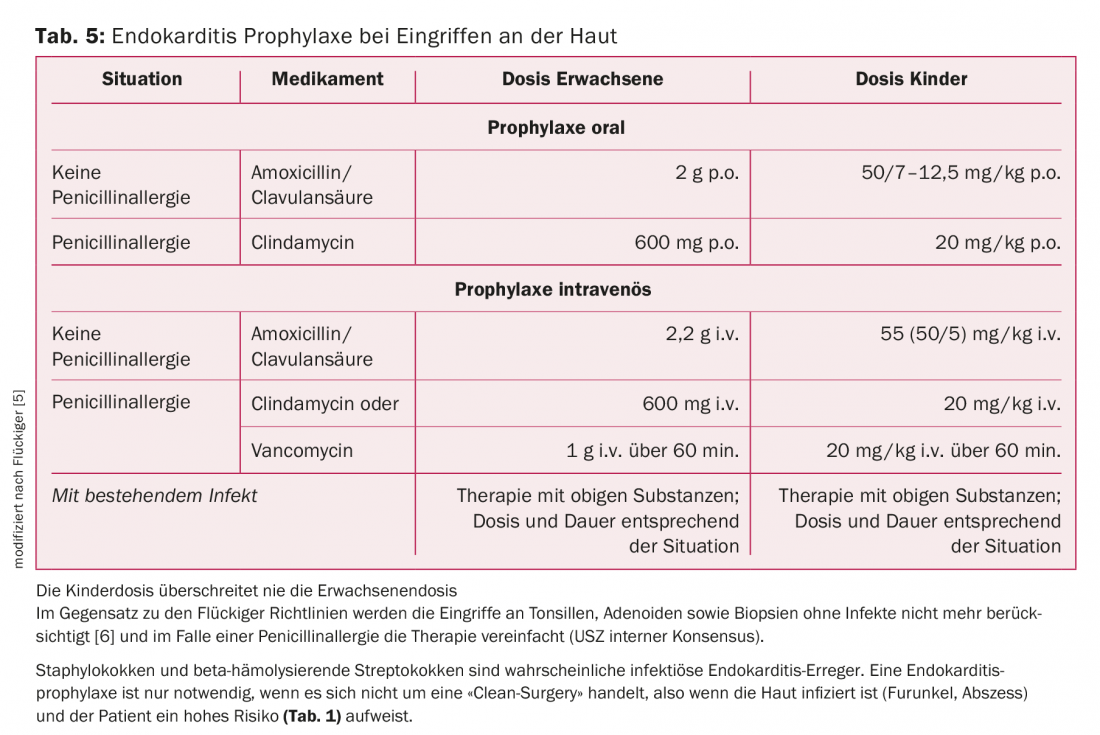
Piel: Los patógenos más comunes en las infecciones cutáneas son los estafilococos y los estreptococos. La AP sólo está indicada si no se trata de una “cirugía limpia”, es decir, si la piel está infectada (forúnculo, absceso) y el paciente presenta un riesgo elevado (tab. 2). La amoxicilina/ácido clavulánico es el tratamiento de elección (tab. 5).
Debate
La endocarditis infecciosa sigue siendo una de las enfermedades infecciosas más mortíferas, por lo que la prevención es la mejor terapia para la EI. Por esta razón, en general recomendamos a la PA que evite la EI a pesar de la falta de datos y de consenso. La cuestión sigue siendo muy controvertida y existen divergencias en el tratamiento dentro de los mismos grupos de trabajo. Proponemos la última directriz de la ESC como referencia principal para la profilaxis de la endocarditis. La exclusión de los pacientes con trasplante de corazón del grupo de pacientes de alto riesgo sigue sin estar clara para nosotros. Para estos pacientes, siempre recomendamos consultar con el cardiólogo tratante antes de un procedimiento de alto riesgo.
En nuestra opinión, el PA de las directrices suizas para las intervenciones dentales puede simplificarse y adaptarse a las directrices de la ESC. El ajuste según el tipo de alergia nos parece bastante engorroso en la vida cotidiana. Lo hemos ajustado en consecuencia en nuestras directrices internas. En las directrices suizas, la PA sin infección activa sólo se recomienda para procedimientos dentales y de determinadas vías respiratorias. Por otro lado, las directrices de la ESC sólo consideran los procedimientos dentales como intervenciones de alto riesgo. En cualquier caso, una dentición propia rehabilitada parece ser una de las medidas profilácticas más importantes.
Más estudios específicos y prospectivos deberían acabar por aclarar esta cuestión tan antigua y proporcionar mejores datos sobre el riesgo de efectos adversos de los antibióticos en la EI. Las nuevas directrices de la AHA están previstas para 2018 y, en su caso, nos permitirán conocer nuevos aspectos y temas de debate renovados.
Mensajes para llevarse a casa
- Al observarse una sorprendente correlación entre los procedimientos dentales, la posterior bacteriemia transitoria y la endocarditis infecciosa, la Asociación Americana del Corazón (AHA) estableció por primera vez en 1955 unas directrices para la profilaxis de la endocarditis.
- Desde la creación de estas directrices, y a falta de datos suficientes, se han revisado y simplificado varias veces.
- Las directrices actuales limitan la profilaxis antibiótica (PA) a los pacientes de alto riesgo y a los procedimientos bucodentales en particular.
- Desgraciadamente, no hay consenso en este punto: las distintas directrices definen de forma diferente a los pacientes de alto riesgo. Siguiendo las directrices publicadas recientemente por la Sociedad Europea de Cardiología (ESC), recomendamos respetar la PA al manipular la encía o la región periapical de los dientes en este grupo de alto riesgo.
Literatura:
- Cahill TJ, Prendergast BD: Endocarditis infecciosa. Lancet 2016; 387(10021): 882-893.
- Achermann Y, et al: Endocarditis de válvula protésica e infección del torrente sanguíneo por Mycobacterium chimaera. J Clin Microbiol 2013; 51(6): 1769-1773.
- Wilson W, et al: Prevention of infective endocarditis: guidelines from the American Heart Association: a guideline from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2007; 116(15): 1736-1754.
- Hoen B, Duval X: Endocarditis infecciosa. N Engl J Med 2013; 369(8): 785.
- Fluckiger U, Troillet N: [New Swiss guidelines for the prevention of infective endocarditis]. Rev Med Suisse 2008; 4(174): 2134-2138.
- Habib G, et al.: 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Avalado por: Asociación Europea de Cirugía Cardio-Torácica (EACTS), la Asociación Europea de Medicina Nuclear (EANM). Eur Heart J 2015; 36(44): 3075-3128.
- Habib G, et al.: Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): the Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Avalado por la Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas (ESCMID) y la Sociedad Internacional de Quimioterapia (ISC) para la Infección y el Cáncer. Eur Heart J 2009; 30(19): 2369-2413.
- Contrepois A: Notas sobre la historia temprana de la endocarditis infecciosa y el desarrollo de un modelo experimental. Clin Infect Dis 1995; 20(2): 461-466.
- Moreillon P: Profilaxis de la endocarditis revisitada: pruebas experimentales de eficacia y nuevas recomendaciones suizas. Grupo de trabajo suizo para la profilaxis de la endocarditis. Schweiz Med Wochenschr 2000; 130(27-28): 1013-1026.
- Naber CK, et al: Nuevas directrices para la endocarditis infecciosa: un llamamiento a la investigación colaborativa. Int J Antimicrob Agents 2007; 29(6): 615-616.
CARDIOVASC 2017; 16(6): 3-8