Los cambios en las directrices y los nuevos enfoques terapéuticos están provocando cambios en los planteamientos del tratamiento del asma grave. En los casos graves y refractarios, los productos biológicos se prefieren ahora claramente a los esteroides.
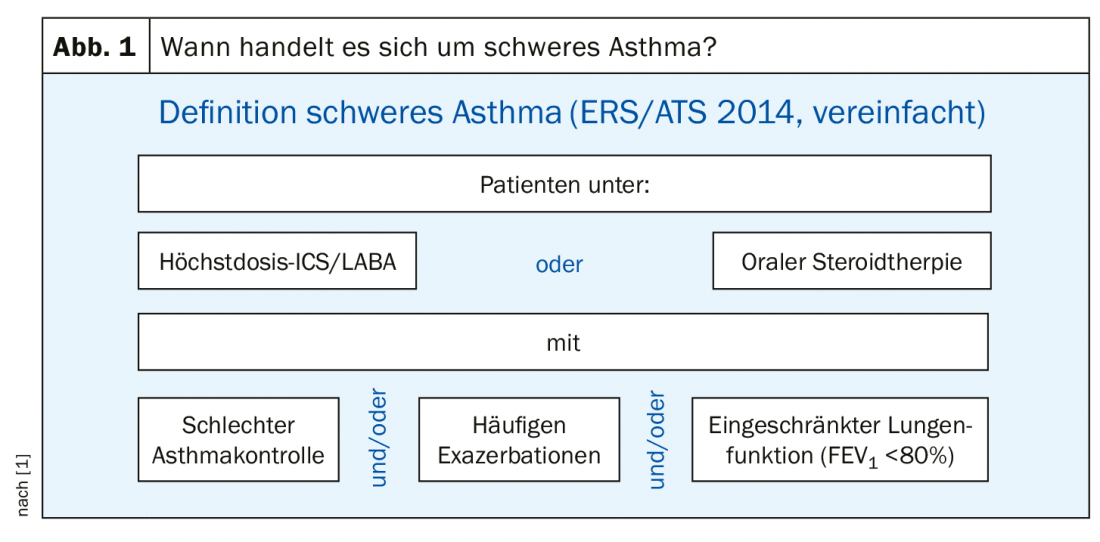
Según las directrices de la Sociedad Respiratoria Europea (ERS) y la Sociedad Torácica Americana (ATS), debe darse la siguiente constelación para ser considerado asmático grave: El paciente recibe terapia con un esteroide inhalado y un betamimético (ICS/LABA) por un lado -y el esteroide en dosis máxima- o terapia con esteroides orales durante al menos seis meses al año. Por otro lado, si a pesar de cualquiera de estas terapias el paciente tiene un mal control del asma y/o exacerbaciones frecuentes y/o una función pulmonar deteriorada (FEV1 <80%), entonces se dice que la afección es asma grave. En otras palabras: Cualquier persona que reciba una terapia máxima o muy alta pero que no esté bien controlada con ella es un asmático grave. En Alemania, esta definición de asma grave se adoptó a partir de las directrices internacionales de la ERS y la ATS en 2014 (Fig. 1).
Niveles de gravedad como esquema de clasificación
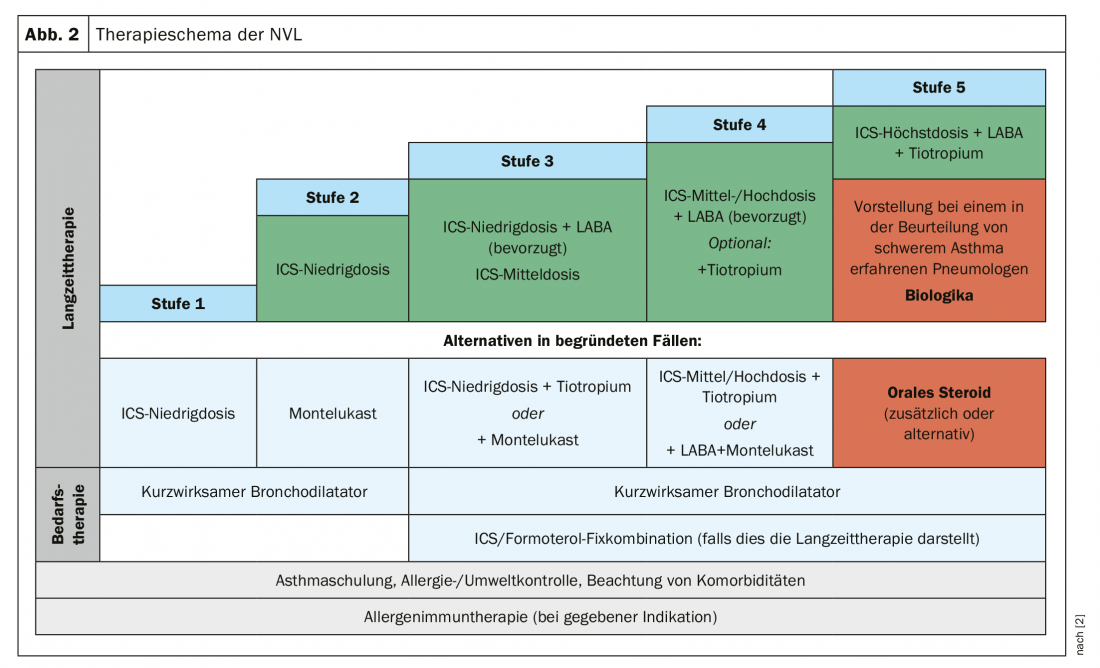
Desde septiembre de 2018, nuestros vecinos disponen de una nueva Guía Nacional de Atención Sanitaria (NVL) que presenta los niveles de gravedad del asma como un esquema de clasificación. En la primera fase, el médico suele prescribir broncodilatadores de acción corta. Esto incluye a los pacientes que padecen una forma muy leve de asma. A partir del nivel 2 estamos tratando con pacientes que necesitan el inhalador de urgencia al menos dos veces por semana. Aquí hay que empezar a pensar en la terapia con CSI como una terapia permanente. “Éste sigue siendo el mejor caballo del establo”, afirma el Prof. Dr. Marek Lommatzsch, del Departamento de Neumología del Hospital Universitario de Rostock. Una alternativa sería el montelukast, por ejemplo en pacientes que temen los esteroides. Sin embargo, es menos eficaz, al menos en adultos.
Si el CSI no es suficiente, no se pasa directamente a la dosis máxima, sino que se combina con un betamimético. Y si esto tampoco es suficiente, puede añadirse un tercer inhalante, el tiotropio, como único anticolinérgico aprobado. Sin embargo, la verdadera pequeña revolución de la actual NVL fue que por primera vez se recomendó la combinación fija ICS/LABA. Hace sólo diez años, se decía que los ICS y los LABA debían administrarse por separado. Antecedentes: “Se ha observado que muchos pacientes reciben ICS y LABA por separado, pero luego sólo toman el LABA”, explica el Prof. Lommatzsch. “¡Y usted sabe que los LABA están prohibidos como monoterapia en el asma!”. Con la combinación fija, esta posibilidad queda excluida.
Por último, en el estadio 5, con los casos de asma grave, debe intentarse instaurar una terapia inhalada máxima al menos temporalmente, durante un periodo de al menos tres meses, si el paciente no está adecuadamente controlado. Es decir: CSI en dosis máxima más LABA más LAMA (tiotropio) (Fig. 2).
Pero, ¿qué efecto tiene el agotamiento de una terapia de dosis máxima sobre los biomarcadores? El Prof. Lommatzsch y su equipo de Rostock iniciaron un ensayo: un grupo de pacientes con asma no controlada y dosis media de CSI fue sometido a una dosis máxima durante tres meses. La terapia tuvo una influencia decisiva sobre los eosinófilos, reduciéndolos en un 50% aproximadamente. Se sabe desde hace tiempo que los eosinófilos se reducen masivamente con los esteroides orales o sistémicos, pero hasta ahora no estaba claro que los CSI también tuvieran un efecto significativo sobre este biomarcador. “Esto significa que, por un lado, tenemos que ver el valor de los Eos en el contexto de la medicación y, por otro, que aún sabemos demasiado poco sobre el efecto sistémico que tienen realmente los CSI a dosis elevadas”.
El médico debe justificar el uso de esteroides
Pero, ¿qué ocurre con los pacientes que realizan la terapia inhalada al máximo, pueden inhalar correctamente, hacen todo lo que el médico quiere, pero siguen siendo refractarios a la terapia? Para estos casos, la actual NVL tiene preparada la próxima pequeña revolución: para estos pacientes, los biológicos deben considerarse ahora como muy tarde. La única alternativa serían los esteroides, pero al utilizarlos, el médico tiene ahora que justificar por qué los prefiere a los biológicos.
Porque, según el Prof. Lommatzsch, los asmáticos suelen tener una relación de amor-odio con los esteroides sistémicos. “A los asmáticos les encanta la prednisolona. Se trata casi de un criterio de diagnóstico: si le pregunta a un asmático qué le parece la prednisolona, suele decir: genial. Un enfermo de EPOC, por su parte, dice: No ayuda en absoluto, sólo tiene efectos secundarios”. Como ejemplo de estas “maravillosas cosas del diablo”, cita a una paciente de 56 años de su clínica que había estado tomando 80 mg de prednisolona por vía oral todos los días desde 1993 y 100 mg por vía i.v. cada dos días, y que en realidad no tenía ningún problema con su asma. “Tenía obesidad, diabetes, hipertensión, osteoporosis, fracturas, trastornos del sueño y depresión, pero quería ver a todos los demás médicos menos a mí porque pensaba que su control del asma era perfecto”.
Para evitar estos casos en el futuro, se necesitan productos biológicos como alternativa. Para encontrar el biológico adecuado para un paciente, es aconsejable realizar primero un fenotipado. El profesor Lommatzsch enumera tres formas de asma que deben identificarse en primer lugar:
- El asma/las sibilancias transitorias aparecen en la infancia y luego desaparecen.
- El asma de aparición temprana comienza en la infancia y persiste durante toda la vida.
- El asma de aparición adulta no comienza hasta la edad adulta.
- Asimismo, los biomarcadores desempeñan un papel esencial en el fenotipado y, en última instancia, en las decisiones de tratamiento:
- Concentración de eosinófilos en sangre (células/µl)
- Concentración total de IgE en suero
- Prick test (alérgenos típicos) Concentración espec. de IgE en suero
- NO exhalado (FeNO) en ppb (servicio IGeL)
Encontrar el biológico adecuado
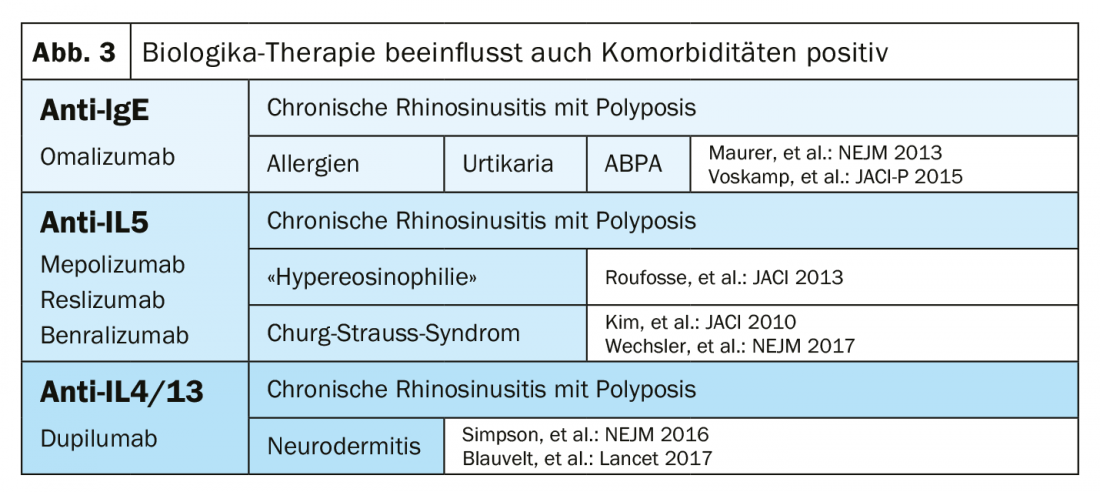
Desde la aprobación del biológico anti-IL 4/13 dupilumab en mayo de 2019, los neumólogos tienen a su disposición un total de cinco biológicos. El omalizumab (anti-IgE) no sólo tiene efectos antialérgicos, sino también antiautoinmunitarios y antivirales. Un paciente típico de omalizumab tiene asma de aparición temprana, alergias y una IgE total elevada. También existen los biológicos anti-IL-5 mepolizumab, reslizumab y benralizumab. El paciente típico con anti-IL-5 tiene asma de inicio en la edad adulta, no padece alergias y presenta una marcada eosinofilia sanguínea. Sin embargo, el solapamiento entre los grupos es bastante elevado. Por este motivo, no sólo los biomarcadores y la historia clínica son importantes a la hora de elegir el biológico adecuado, sino también las comorbilidades (Fig. 3) .
Estos tres factores fenotipo, biomarcadores y comorbilidades, concluye el experto, deben ser siempre considerados y sopesados cuidadosamente por los neumólogos, ya que son cruciales para elegir el biológico adecuado.
Fuente: DGIM 2019, Wiesbaden (D)
Literatura:
- Lommatzsch M, Virchow JC: Asma grave: definición, diagnóstico y tratamiento. Dtsch Arztebl Int 2014; 111: 847-855.
- BÄK, KBV, AWMF: Nationale Versorgungsleitlinie Asthma. Versión larga, 3ª edición. Versión 1, 2018. www.leitlinien.de/mdb/downloads/nvl/asthma/asthma-3aufl-vers1-lang.pdf, consultado por última vez el 11.06.19.
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2019; 1(2): 18-20 (publicado el 27/9/19, antes de impresión).
PRÁCTICA GP 2019; 14(10): 18-19