En la actualidad, el papel del diagnóstico por imagen en el diagnóstico de la EP reside principalmente en la exclusión de causas de parkinsonismo secundario. Sin embargo, en relación con la clínica, también puede aportar argumentos a favor de la presencia de la enfermedad de Parkinson o de síndromes de Parkinson atípicos. Los desarrollos más recientes tienen como objetivo el diagnóstico correcto de pacientes individuales mediante la imagen en un contexto clínico.
La enfermedad de Parkinson es el trastorno neurodegenerativo del movimiento más frecuente y la enfermedad neurodegenerativa más común después de la enfermedad de Alzheimer [1]. Debe su nombre al médico inglés James Parkinson, que publicó la primera descripción detallada del cuadro clínico en 1817 [2].
El diagnóstico de la enfermedad de Parkinson se realiza clínicamente, aunque sólo puede confirmarse de forma definitiva histopatológicamente. Por lo general, se requiere una combinación de síntomas motores (rigidez, temblor, bradicinesia) con aparición asimétrica de los síntomas, una respuesta a la L-dopa, un curso progresivo de más de diez años y la exclusión de otras causas de parkinsonismo [3, 4]. Sin embargo, en las fases tempranas no suelen presentarse todos los síntomas; además, otras entidades pueden causar una sintomatología superpuesta; los estudios post mortem han demostrado que existe una proporción relativamente alta de diagnósticos erróneos de EP (76% de confirmación en la autopsia [5]).
Los métodos de diagnóstico por imagen (tanto morfológicos como funcionales) no pueden ayudar en el diagnóstico de la EP proporcionando signos específicos de la enfermedad, pero pueden identificar o apoyar el diagnóstico de otras causas de EP. Con la ayuda de métodos más novedosos, también se está intentando diagnosticar la propia enfermedad de Parkinson en pacientes individuales.
Imágenes transversales
El correlato anatomopatológico de la enfermedad de Parkinson es la pérdida de células dopaminérgicas en la sustancia negra pars compacta (Fig. 1), que, sin embargo, sólo en raras ocasiones se refleja en un estrechamiento de la misma en la resonancia magnética. En la mayoría de los casos, sólo hay una atrofia inespecífica con expansión de los espacios internos y externos del LCR. En la actualidad, el verdadero valor del diagnóstico por imagen reside en la posibilidad de descartar otras causas de la sintomatología posiblemente tratables.
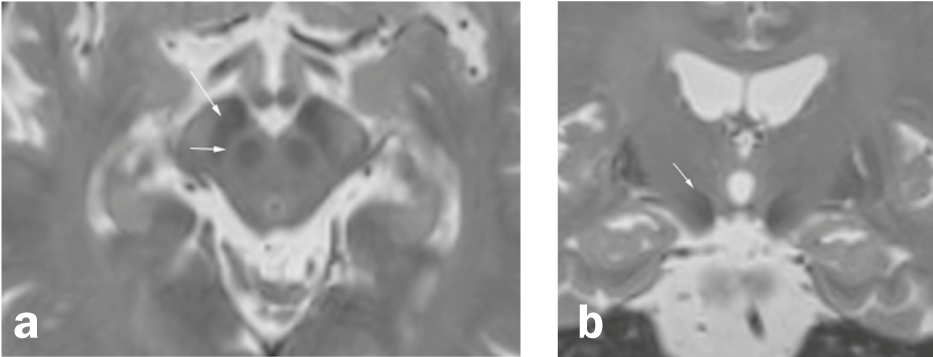
Fig. 1 Sustancia negra y alrededores
Axial (a) y coronaria (b) Reconstrucción de una secuencia 3D ponderada en T2 de alta resolución (IRM). a) La sustancia negra situada entre el núcleo ruber y los haces de fibras de la crus cerebri consta de dos capas, una zona hipointensa en la parte posterior de la crus cerebri (pars reticularis; flecha larga) y una capa relativamente hiperintensa (flecha corta) entre la pars reticularis y el núcleo ruber (por lo que las zonas en ponderación T2 no corresponden exactamente a la localización anatómica). b) El núcleo subtalámico (flecha) es un núcleo medial a la cápsula interna y superolateral al ncl. ruber y una de las zonas objetivo de la estimulación cerebral profunda en la enfermedad de Parkinson.
Exclusión de otras causas de parkinsonismo: Los diagnósticos diferenciales de la EP incluyen el parkinsonismo secundario de etiología tóxica, metabólica o vascular y el pseudoparkinsonismo, por ejemplo debido a una hidrocefalia de presión normal [6] o a un hematoma subdural crónico, algunos de los cuales se detectan fácilmente mediante TC y/o RM (Fig. 2).
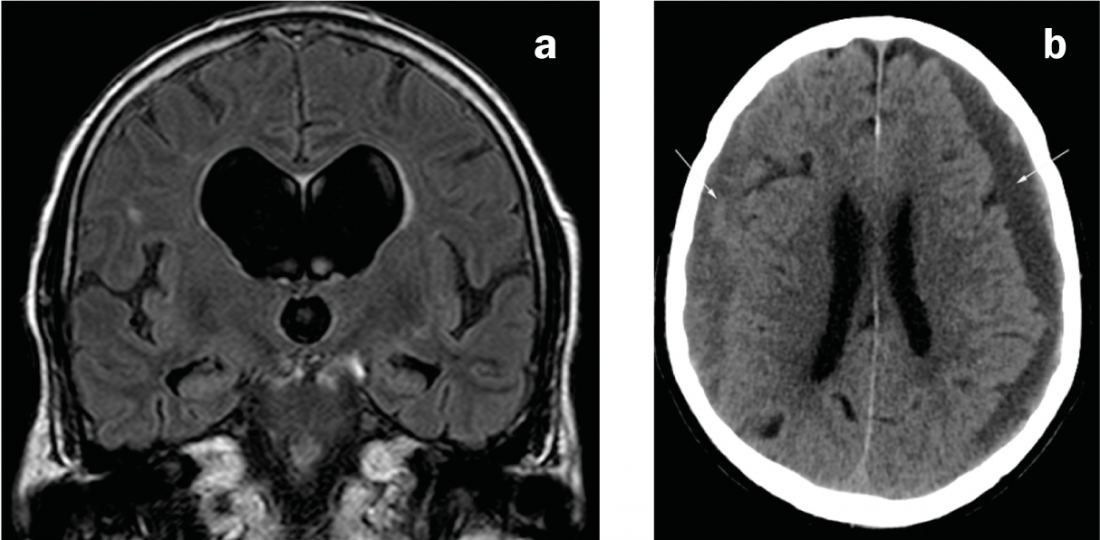
Fig. 2: Causas del parkinsonismo secundario
a) RM coronaria en ponderación FLAIR. Sistema ventricular desproporcionadamente dilatado en comparación con los espacios externos de LCR en la hidrocefalia de presión normal. b) TC axial. Hematoma subdural bilateral de edad mixta: izquierdo predominantemente hipodenso (es decir, crónico), derecho predominantemente isodenso (es decir, subagudo).
Exclusión del síndrome de Parkinson atípico: Los diagnósticos diferenciales clínica y radiológicamente más difíciles incluyen los síndromes de Parkinson atípico MSA (atrofia multisistémica), PSP (parálisis supranuclear progresiva de la mirada) y CBD (degeneración ganglionar corticobasal). A menudo, las manifestaciones por imagen sólo pueden detectarse en fases avanzadas.
Los signos de la AMS-C (tipo cerebeloso) son la atrofia de la protuberancia y el cerebelo (incluido el braquion pontis) y el signo del “bollo caliente en cruz” (hiperintensidad en forma de cruz en la protuberancia en imágenes axiales ponderadas en T2/FLAIR debido a la degeneración de las neuronas pontinas y las conexiones pontocerebelosas). (Fig. 3a y b). El signo típico de la AMS-P (tipo putaminal/parkinsoniano, un diagnóstico diferencial con la enfermedad de Parkinson debido a los síntomas extrapiramidales) es la hipointensidad del putamen dorsolateral en secuencias ponderadas en T2-/T2* con una franja hiperintensa adyacente (“signo de la hendidura putaminal” debido a la pérdida de volumen putaminal). (Fig. 3c). Los hallazgos descritos pueden encontrarse en todos los subtipos de AMS, aunque los hallazgos infratentoriales son más frecuentes en la AMS-C que en la AMS-P (y los hallazgos putaminales, a su vez, se describen con mayor frecuencia en la AMS-P) [7].
En la PSP, hay atrofia del mesencéfalo (incluidos los colículos superiores) y del pedúnculo cerebeloso superior, lo que da lugar al signo del “pingüino” en las imágenes sagitales (se dice que el mesencéfalo plano y la redondez conservada de la protuberancia dan lugar a un parecido con la silueta de un pingüino de cabeza pequeña y vientre redondo). (Fig. 3d y e). El gris periacueductal puede aparecer hiperintenso en T2.
Los hallazgos del CBD son un estrechamiento de la circunvolución pre y postcentral (Fig. 3f), gliosis subcortical con hiperintensidad T2/FLAIR y atrofia parasagital prominente. La atrofia de los ganglios basales puede ser discreta.
Dado que todos estos signos pueden ser muy sutiles y que existe un cierto solapamiento en los hallazgos de todos los cuadros clínicos mencionados, se utilizaron diversas mediciones (por ejemplo, el diámetro y el área del mesencéfalo y la protuberancia o el pedúnculo cerebeloso superior y medio) e índices en un intento de definir signos objetivos para el diagnóstico diferencial de las diversas entidades y realizar así diagnósticos específicos más allá de las diferencias a nivel de grupo. Por ejemplo, el “índice MR-parkinsoniano” [8] permite distinguir una posible o probable PSP de M. Parkinson, MSA y controles normales.
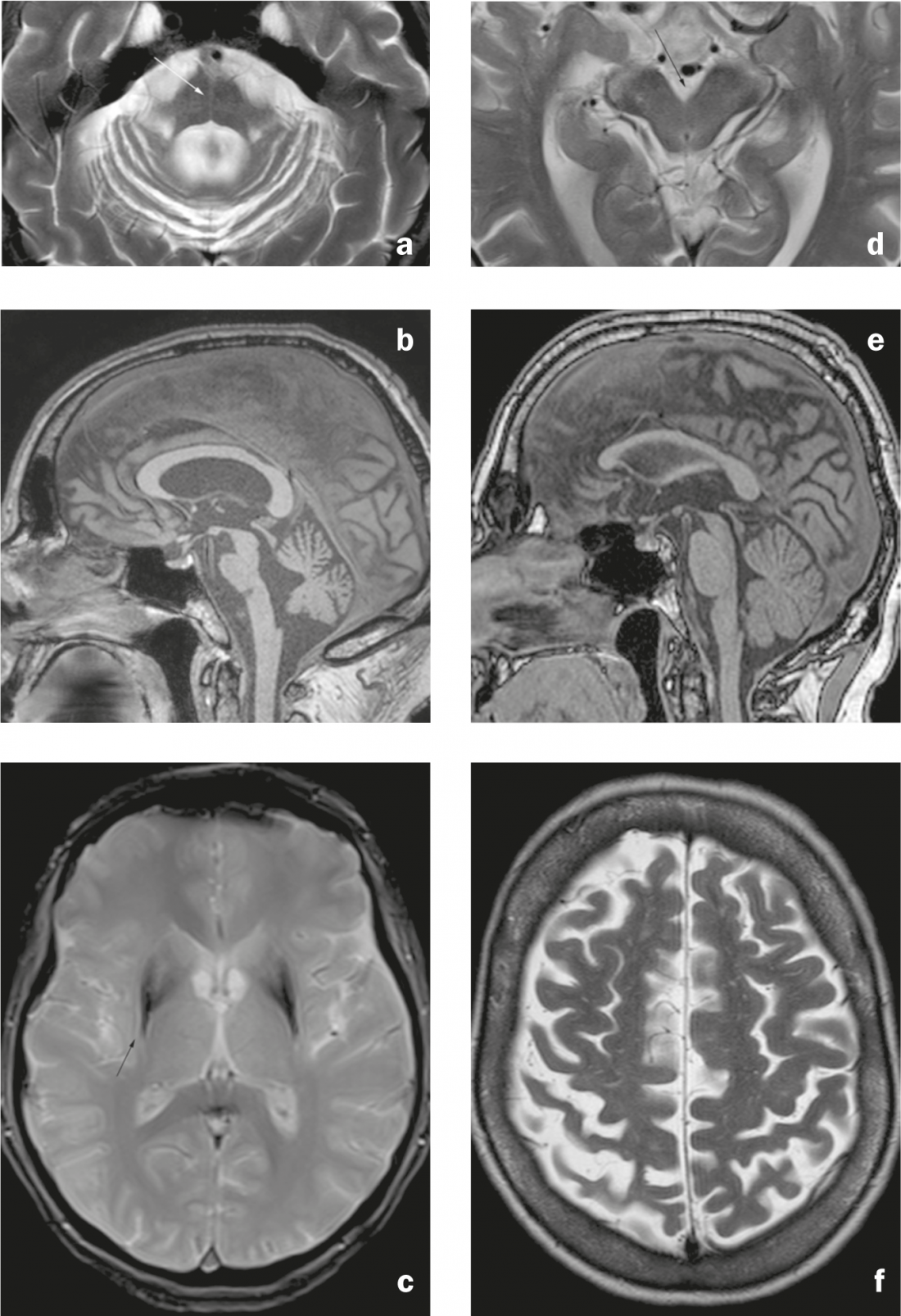
Fig. 3: Síndromes atípicos de Parkinson. MSA-C: a) Imagen axial ponderada en T2. Atrofia pontina y cerebelosa con signo del “hot cross bun” (flecha), dilatación del cuarto ventrículo y estrechamiento del brachium pontis. b) Imagen sagital en ponderación T1. Aplanamiento de la protuberancia. MSA-P: c) Imagen axial ponderada en T2*. Hipointensidad del putamen dorsolateral con hiperintensidad lineal adyacente (flecha). PSP: d) Imagen axial ponderada en T2. Atrofia del mesencéfalo con dilatación de la cisterna interpeduncular. e) Imagen sagital ponderada en T1. Atrofia del mesencéfalo, que aparece estrecho en comparación con el puente de Varolio (signo del “pingüino” o “colibrí”). CBD: f) Imagen axial ponderada en T2. Atrofia del giro precentral y postcentral con ensanchamiento del surco central (énfasis a la derecha).
Nuevos avances en la obtención de imágenes por RM: Además de las imágenes convencionales, también se están investigando técnicas avanzadas de RM como las imágenes ponderadas por difusión (DWI), las imágenes con tensor de difusión (DTI) o las secuencias ponderadas por susceptibilidad como T2* o las imágenes ponderadas por susceptibilidad (SWI) con respecto a la diferenciación de los pacientes con EP y los pacientes con síndromes atípicos [9, 10]. Se utilizarán nuevas secuencias o nuevas variantes de secuencias ya existentes para detectar cambios sutiles en las pequeñísimas estructuras anatómicas afectadas en la enfermedad de Parkinson en fases más tempranas. Por ejemplo, mediante la técnica PADRE (“phase difference enhanced imaging”; realizada en una resonancia magnética de 3T), se ha demostrado una difuminación del límite entre la sustancia negra y los haces de fibras de la crus cerebri en los pacientes de Parkinson [11], que no es detectable en las secuencias de RM convencionales.
Además, se utilizan técnicas avanzadas de análisis estructural de la materia gris (“morfometría basada en vóxeles”, VBM) y blanca (“estadística espacial basada en tractos”, TBSS) [12, 13] para detectar pequeñas diferencias de señal en la IRM que no son evidentes mediante un análisis puramente visual.
Imágenes preoperatorias: Además de para descartar causas de parkinsonismo distintas de la enfermedad de Parkinson, las imágenes transversales son útiles para la orientación preoperatoria (globo pálido y, especialmente, nervio subtalámico) antes de la implantación de electrodos para la estimulación cerebral profunda.
Métodos de medicina nuclear
Los métodos de medicina nuclear permiten detectar una disfunción del sistema dopaminérgico y se utilizan en la rutina clínica como prueba diagnóstica adicional en casos poco claros. Por ejemplo, la disponibilidad de los transportadores presinápticos de dopamina (DaT) o la actividad de la dopa descaroboxilasa pueden investigarse utilizando diferentes ligandos en SPECT o PET. En concreto, el “escáner DaT” (el [123I]FP-CIT-SPECT) se ha generalizado como prueba para detectar síndromes de Parkinson poco claros. La enfermedad de Parkinson muestra una reducción en la unión del ligando(Fig. 4), lo que permite distinguirla del temblor esencial (pero no con certeza de los síndromes de Parkinson atípicos) [14].
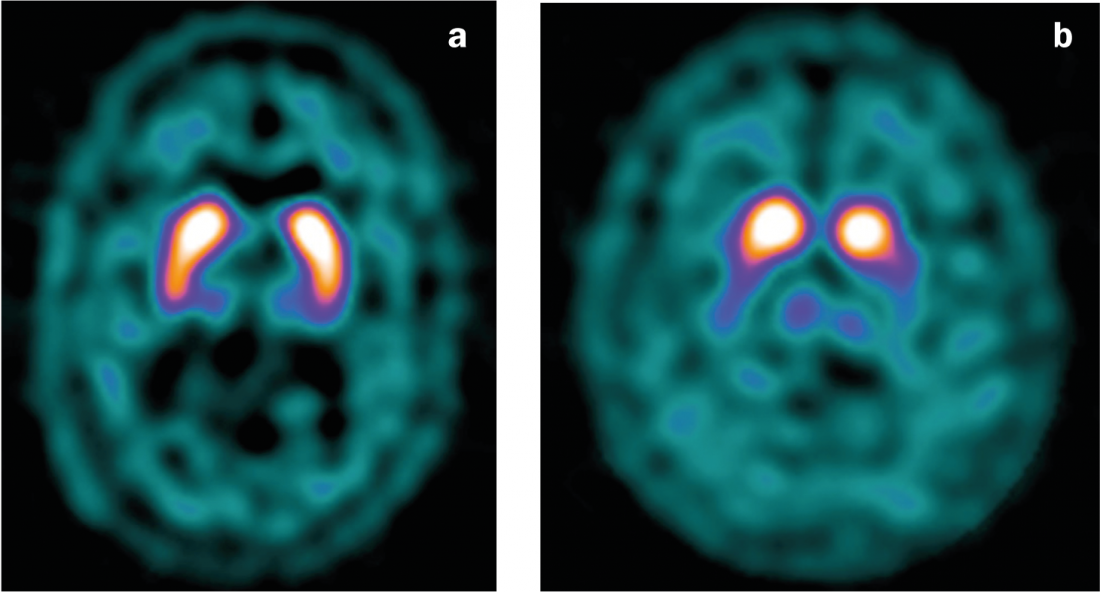
Fig. 4: Escaneo DaT
a) Hallazgos normales con unión simétrica del ligando en el estriado.
b) Reducción de la unión del ligando en la enfermedad de Parkinson, especialmente en el lado izquierdo (con una clínica predominante en el lado derecho).
Métodos de clasificación
Además de los análisis morfológicos descritos anteriormente, cada vez se realizan más análisis de clasificación para mejorar el diagnóstico en pacientes individuales. No se basan, como los estudios de grupo, en la idea de comparar grupos de pacientes con sujetos de control sanos para detectar cambios estructurales relacionados con la enfermedad [15], cuyas diferencias pueden ser significativas a nivel de grupo pero no lo suficientemente pronunciadas a nivel individual como para permitir un diagnóstico en la práctica clínica diaria. Más bien, persiguen el objetivo de identificar o clasificar correctamente a pacientes individuales. Los estudios de clasificación se llevan a cabo mediante análisis de “máquinas de vectores de apoyo” de diversos datos (por ejemplo, secuencias DTI o SWI). Un clasificador “máquina de vectores soporte” es un método de análisis que pretende clasificar los datos en dos o más grupos (por ejemplo, enfermedad de Parkinson/parkinsonismo atípico) basándose en el reconocimiento de patrones. Para ello, en un primer paso, se examinan las imágenes procesadas (es decir, transferidas a un espacio estándar, por ejemplo) en busca de las características más discriminatorias mediante diversos algoritmos. En un segundo paso, se comprueba la sensibilidad, especificidad y precisión del clasificador determinado utilizando un nuevo conjunto de datos [16]. Los resultados preliminares del análisis de los datos de la DTI y la SWI mostraron una gran precisión en la clasificación de los pacientes con EP (frente a los pacientes con síntomas atípicos de EP [12, 13]).
Bibliografía del editor
Dr. Sven Haller
Dra. Isabelle Barnaure











