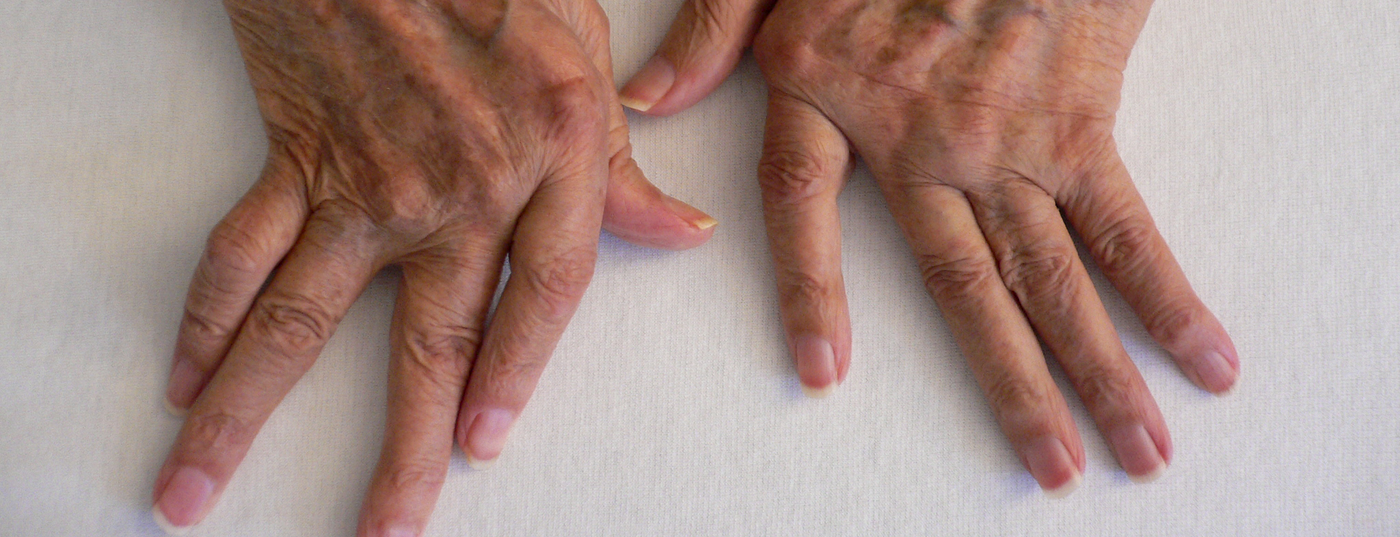
En la artritis reumatoide, el sistema inmunitario ataca la membrana sinovial de la sinovial. Si no se trata, existe el riesgo de una destrucción gradual de la articulación. Por lo tanto, los DMARD se utilizan para los cursos graves. Los análisis ómicos de tipos celulares individuales proporcionan nuevos conocimientos sobre el proceso de la enfermedad. Entre otras cosas, se centra en la investigación de la actividad de las células T y los distintos tipos de macrófagos tisulares como base para nuevas estrategias de tratamiento. Con motivo del congreso anual de la Sociedad Alemana de Reumatología (DGRh), se informó de los hallazgos actuales y los resultados de los estudios.
Para una comprensión diferenciada de la enfermedad y de las opciones de tratamiento que de ella se derivan, la investigación de los complejos acontecimientos moleculares que tienen lugar a nivel celular resulta muy informativa. Los avances en las tecnologías de alto rendimiento (“ómicas”) han hecho posibles las observaciones a nivel genómico, transcriptómico y regulador de diversas moléculas biológicas (recuadro). El desarrollo de enfoques terapéuticos contra la artritis reumatoide se ha beneficiado enormemente de los hallazgos de la investigación básica en las últimas décadas. “Los reumatólogos pueden ahora influir bien en el curso de la enfermedad inyectando o infundiendo diversos anticuerpos biológicos, desde Abatacept hasta Rituximab”, explica el portavoz del grupo de trabajo de la Red de Competencia en Reumatismo, el Dr. Ulf Wagner, del Hospital Universitario de Leipzig [1]. Recientemente, se han añadido fármacos sintéticos como el baricitinib o el tofacitinib, que pueden tomarse en comprimidos. “Los nuevos fármacos hacen que el tratamiento sea más llevadero para muchos pacientes”, afirma el experto.

Seguir desarrollando el principio terapéutico de la modulación de la actividad de las células T
La activación de células T autoreactivas tiene una importancia patogenética central en enfermedades autoinmunes como la artritis reumatoide. Intervienen en la cascada inflamatoria influyendo en otras células inmunitarias y produciendo una serie de citoquinas proinflamatorias. Basándose en estos hallazgos, se han desarrollado varios conceptos para el bloqueo terapéutico de las células T. Su objetivo es eliminar en gran medida las células T del proceso de la enfermedad o influir en su función de tal forma que se ralenticen sus efectos patógenos. El abatacept (Orencia®) es un modulador de la actividad de las células T que se utiliza terapéuticamente desde hace algún tiempo. El mecanismo de acción consiste en bloquear específicamente la vía de señalización CD28-CD80/CD86 [2,3]. CD28 es una de las moléculas costimuladoras más destacadas, expresada por aproximadamente la mitad de las células T. El CD28 tiene dos ligandos, el CD80 y el CD86, que se expresan en la superficie de varias células presentadoras de antígenos de forma dependiente de la activación. Además, el “antígeno 4 asociado a los linfocitos T citotóxicos” (CTLA-4) también se expresa en las células T de forma dependiente de la activación y también se une a CD80 y CD86. Sin embargo, a diferencia del CD28, el CTLA-4 frena la activación de las células T mediante la inhibición de la proliferación y la producción de citocinas, por lo que puede considerarse un antagonista del CD28.
La modulación de las células T dañinas es también el objetivo de una nueva estrategia de tratamiento que se está investigando actualmente. “Actualmente suponemos que al principio de la enfermedad se produce una pérdida de la autotolerancia, que normalmente impide que las células T ataquen a las células del propio organismo en la membrana sinovial”, afirma el Prof. Ulf Wagner, MD [1]. “Las células T empiezan a atacar a las células sinoviales y hacen que las células B produzcan anticuerpos, de los que el factor reumatoide es el ejemplo más conocido”. Según el experto, los estudios ómicos demuestran que el metabolismo de las células T cambia por completo en el curso de la enfermedad. Por ejemplo, el suministro de energía pasa de la glucólisis a la vía de las pentosas fosfato. “Estos procesos metabólicos alterados pueden ofrecer posibilidades completamente nuevas para influir terapéuticamente en las enfermedades autoinmunes inflamatorias crónicas”, explica el Prof. Wagner. “Nuestro objetivo debería ser convertir las células T ‘malas’ en células T ‘buenas’ y detener el proceso de la enfermedad justo al principio”. El futuro mostrará si este enfoque terapéutico se consolida y conduce al lanzamiento al mercado de las sustancias activas correspondientes.
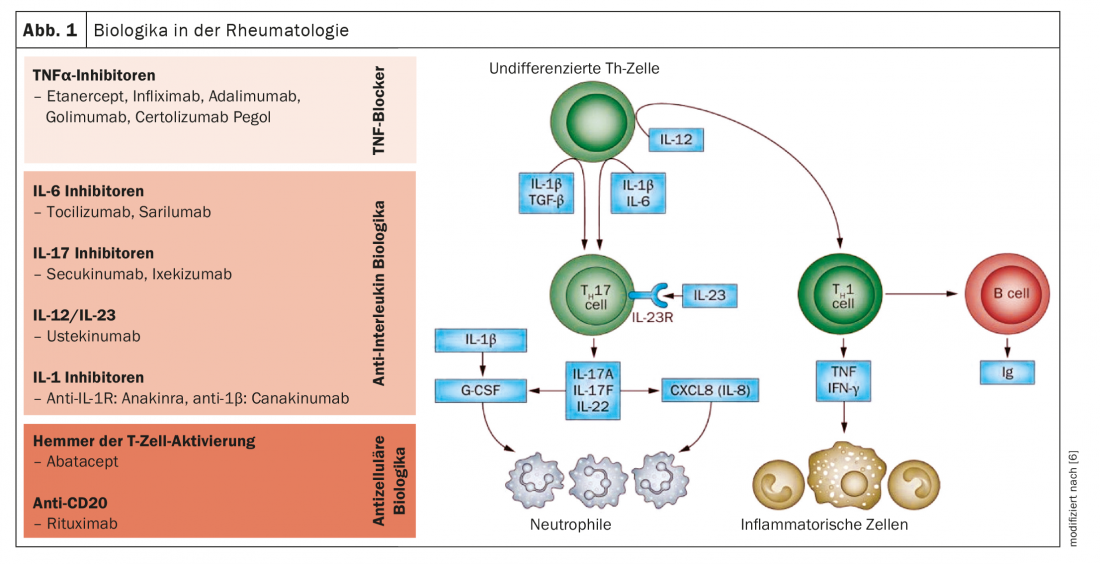
Los macrófagos tisulares como parte de la cascada inflamatoria
Los anticuerpos biológicos y los fármacos sintéticos aprobados hasta la fecha bloquean las citocinas o sus receptores, que son liberados por las células del sistema inmunitario como parte de los procesos inflamatorios (Fig. 1 y 2) . Mientras tanto, la investigación básica se ha centrado en las diferentes células inflamatorias que producen estas citocinas. Los métodos ómicos más recientes, como la secuenciación unicelular del ARN, el perfil ribosómico o la espectrometría de masas, permiten conocer por primera vez las células individuales. “Las investigaciones muestran qué grupos celulares se comportan de forma diferente en los pacientes con reumatismo que en las personas sanas y cuáles están, por tanto, probablemente implicados en el proceso de la enfermedad”, explica el Prof. Wagner [1]. Combinando diferentes tecnologías ómicas, se puede obtener una imagen más completa de la expresión génica, la cantidad de proteínas o diferentes procesos intracelulares. Uno de los actores centrales de la artritis reumatoide son los macrófagos tisulares, que también están presentes en la membrana sinovial de las personas sanas. “La investigación quiere aclarar qué es lo que hace que estas células liberen las citocinas inflamatorias y cómo podría prevenirse”, afirma el experto.
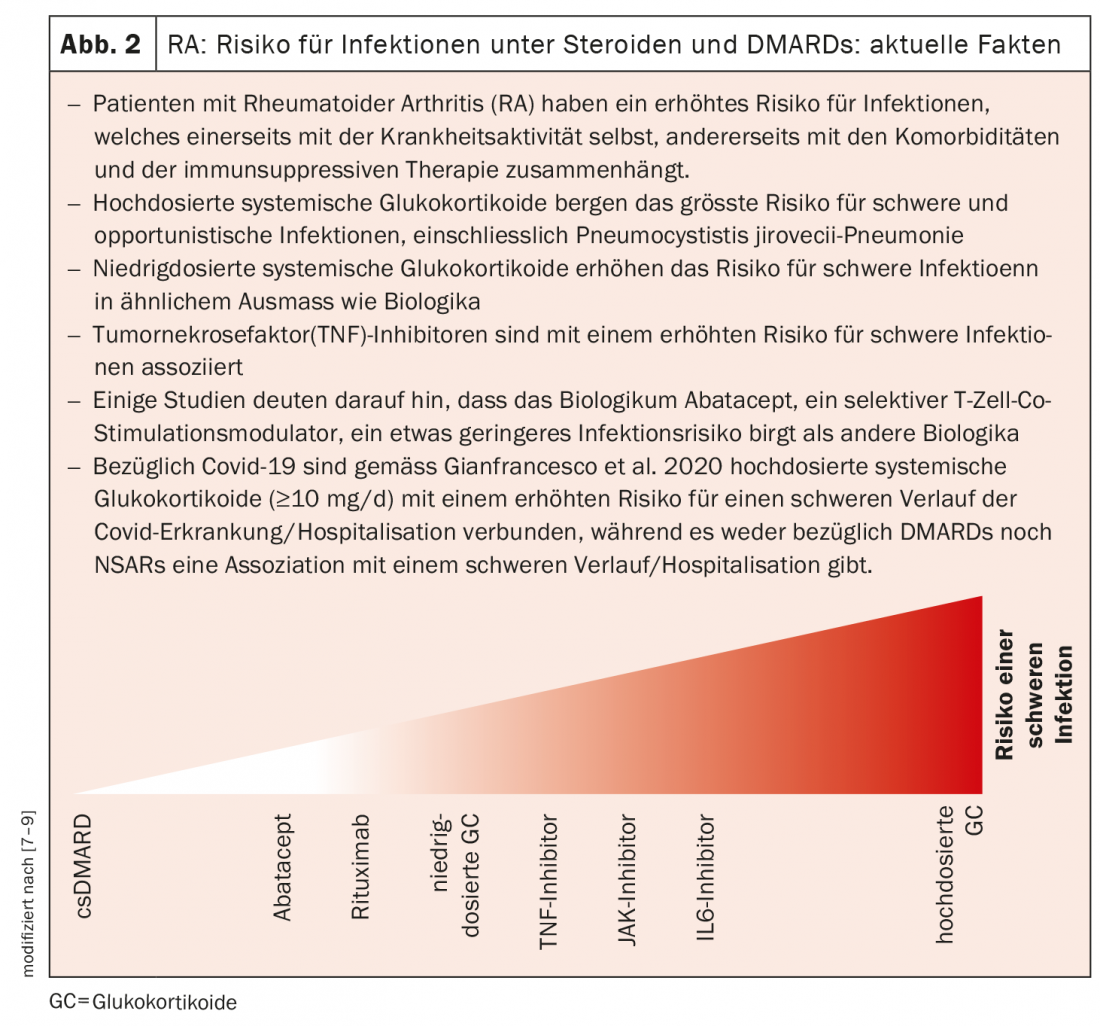
Macrófagos tisulares MerTK-negativos y CD206-negativos como diana
Los investigadores básicos han descubierto, por ejemplo, que existen dos grupos de macrófagos tisulares que se distinguen por los marcadores de superficie MerTK y CD206. Un estudio reciente publicado en Nature Medicine descubrió que los macrófagos tisulares MerTK-negativos y CD206-negativos producen una serie de citoquinas proinflamatorias y alarminas, promoviendo respuestas inflamatorias en la membrana sinovial [4]. Por el contrario, los macrófagos tisulares positivos para MerTK y CD206 parecen inhibir las respuestas inflamatorias. Estas células se encuentran principalmente en pacientes cuya inflamación ha remitido por completo. El Prof. Wagner explica: “La idea para un enfoque terapéutico sería utilizar fármacos para poner a los macrófagos tisulares en un estado de latencia permanente y detener así la enfermedad a largo plazo”.
Congreso: Conferencia anual de la DGRh
Literatura:
- “Artritis reumatoide: el análisis de células individuales permite nuevos conocimientos sobre el proceso de la enfermedad – se esperan nuevos enfoques terapéuticos”, Congreso Alemán de Reumatología, 16.09.2021
- Swissmedicinfo: Orencia®, www.swissmedicinfo.ch (último acceso 18.11.2021)
- Graninger W, Emminger W, Scheinecker C: J Med Drug Rev 2013; 3: 44-60.
- Alivernini S, et al: Nat Med 2020; 26(8): 1295-1306.
- Rosenstiel P, Franke A, Schreiber S: Predicción y tratamiento individual de la inflamación crónica. www.systembiologie.de (última llamada 18.11.2021)
- Mihai C: Taller sobre reumatismo, Carmen-Marina Mihai, MD, 23.09.2021; www.usz.ch/app/uploads/2021/09/CMihai_NW-Biologika_RheumaWorkshop_Sept21.pdf (última consulta: 18.11.2021)
- Tamborrini G: Riesgo de infección con DMARD y esteroides, Semanal 2021, www.rheuma-schweiz.ch (última consulta: 18.11.2021).
- Riley TR, et al: Riesgo de infecciones con glucocorticoides y DMARD en pacientes con artritis reumatoide, RMD Open 2021: en línea.
- Gianfrancesco M, et al: Ann Rheum Dis 2020; 79: 859-866.
InFo DOLOR Y GERIATURA 2021; 3(2): 30-31
PRÁCTICA GP 2021; 16(12): 20-22