La polineuropatía diabética (PND) es la neuropatía más común en los países occidentales. Pero, ¿quién las recibe y cómo reconocerlas? Esta cuestión es especialmente importante porque todavía el 40% de los pacientes cuya PNPD es dolorosa siguen sin recibir tratamiento. Las posibilidades de diagnóstico y terapia fueron el tema del Congreso Alemán del Dolor.
La dPNP somatosensorial casi siempre se desarrolla en paralelo con la retinopatía o la nefropatía. Por lo tanto, siempre hay que vigilar los ojos y los riñones durante el diagnóstico, explicó a modo de introducción el Prof. Dr. Frank Birklein, de la Clínica y Policlínica de Neurología del Hospital Universitario de Maguncia (D). La única excepción es la neuropatía de fibras pequeñas (SFN), que puede preceder a la diabetes. El 50% de los diabéticos desarrollan PNP electrofisiológica, y en el 16% de estos pacientes la PNP es dolorosa. Una cuarta parte de todos los diabéticos padecen clínicamente PNP. El 40% de los dPNP dolorosos no reciben tratamiento.
Fisiopatológicamente, se producen cambios en el metabolismo en la dPNP, especialmente en el metabolismo de la diabetes. Aquí es importante la vía de los polioles y los productos finales de la glicación avanzada (AGE), que se acumulan y dañan las neuronas y especialmente los axones. Además, se producen cambios en los canales iónicos, especialmente en los canales de potasio y sodio, y aparecen defectos mitocondriales que, en última instancia, hacen que las neuronas reciban muy poca energía. No hay que olvidar que también se producen cambios estructurales, especialmente en los vasos. Vascularmente, esto se caracteriza por el hecho de que las venas y las arterias son morfológicamente poco visibles en las neuropatías de control, mientras que en los diabéticos la arteria se reduce de tamaño y se “enrolla”, es decir, hay una arteriolopatía, las venas están parcialmente congestionadas. En última instancia, un nervio diabético tiene muy poco oxígeno y es hipóxico.
Diagnóstico
El primer paso en el diagnóstico debe ser la medición de las velocidades de conducción nerviosa (VCN), ya sea realizada por uno mismo o por un colega neurológico de confianza, como dice el Prof. Birklein: “Siempre creo que los valores normales de una consulta, los patológicos, en cambio, no siempre son correctos, porque el paciente no ha sido calentado adecuadamente, por ejemplo. Las extremidades frías provocan una ralentización de la velocidad de conducción nerviosa”. El programa de medición del NLG incluye dos nervios, motor y sensitivo, en la extremidad superior. El profesor Birklein recomienda al menos el cubital, ya que el mediano suele padecer el síndrome del túnel carpiano (STC) y pueden producirse diagnósticos erróneos si no se es consciente de ello. “Y los pacientes diabéticos tienen con mucha frecuencia STC”. En las extremidades inferiores, deben abordarse con sensibilidad dos nervios motores (tibial, peroneo) y el sural. El experto recordó que la velocidad de conducción nerviosa de un paciente diabético apenas cambia en un periodo de hasta cinco años y suele permanecer en un nivel reducido constante. La situación es diferente para las amplitudes de los potenciales de acción de la suma motora, que pueden estimularse, por ejemplo, al medir el peroneo. aquí cada vez es menor en el transcurso de 2 años. Esto significa que los axones se rompen durante la dPNP. “No se trata de una neuronopatía, sino de una axonopatía de dorso moribundo”, explicó el neurólogo. Las fibras nerviosas más largas se ven afectadas en primer lugar y los axones mueren. Como resultado, la amplitud es cada vez menor.
Si el NLG es normal, el paciente no tiene PNP. Por regla general, los hallazgos neurológicos son entonces también normales, pero la persona afectada sigue teniendo dolor ardiente (sfPNP en la fase inicial). En este caso, basta con determinar los umbrales de frío y calor según el protocolo QST* para diagnosticar la sfPNP. El médico explorará la pérdida de la sensación de frío y calor. El frío corresponde a una función delta, por lo que los nociceptores de conducción rápida son de la misma clase de fibra, y el calor es de la clase C, por lo que son nociceptores de conducción lenta. El umbral de frío de las personas sanas en el pie comienza a los 32°C – un sujeto sano siente una reducción de 4°C, en los pacientes esto sólo ocurre a partir de los 12°C. En el umbral de calor, es decir, medido a partir de los 32°C después de temperaturas más cálidas, las personas sanas necesitan unos 6°C de diferencia en el pie para sentir algo, los pacientes con PNP o diabetes en consecuencia más. Esto también se mantiene constante durante dos años con un ligero aumento.
(* Pruebas Sensoriales Cuantitativas)
Si la medición de los umbrales de calor y frío no ayuda, el estándar en el diagnóstico de la sfPNP es una biopsia de piel, que ofrecen muchos laboratorios de neuropatología.
Prevención
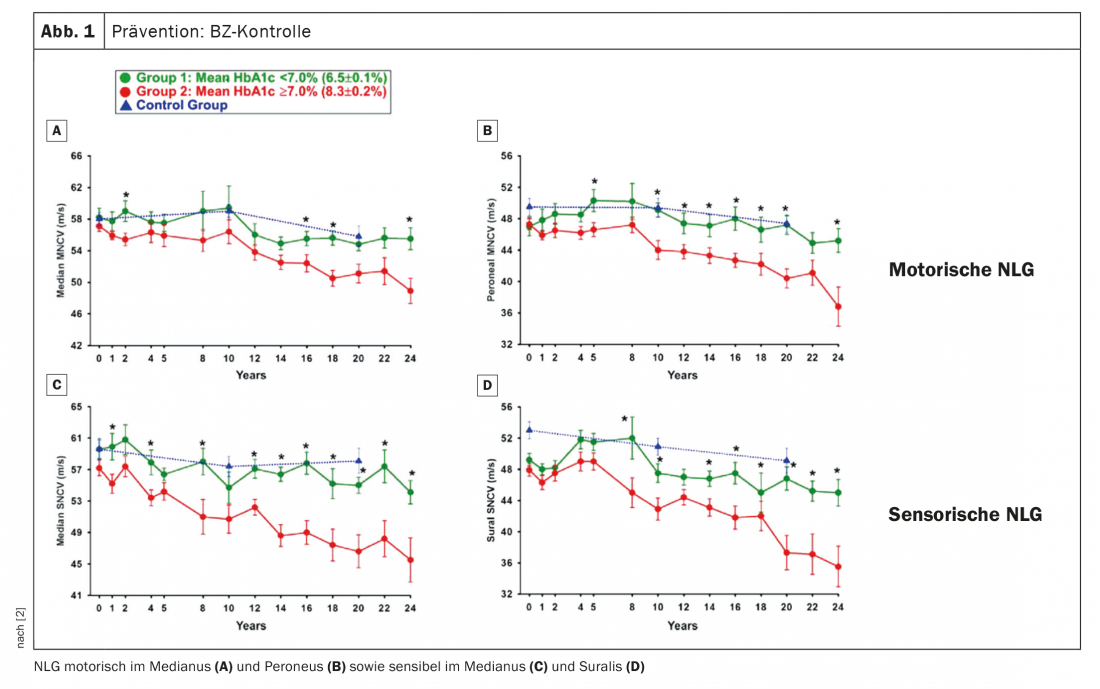
¿Cómo se puede prevenir la aparición o la progresión de la dPNP? En primer lugar, por supuesto, el control de la glucemia (BG) es obvio para ello. El profesor Birklein se refirió a un trabajo en el que se midieron las velocidades de conducción nerviosa durante más de 20 años (Fig. 1). Se puede observar que el NLG de los controles sanos disminuye ligeramente a lo largo de un periodo de dos décadas, pero esto es bastante normal. Se comparó a pacientes con una HbA1c ≥7, es decir, un ajuste convencional de la glucemia, con pacientes con un ajuste intensificado de la glucemia. Lo que se ve es que los pacientes con un control intensificado de la glucemia en la diabetes tipo 1 tienen un curso que también se espera en las personas sanas. “Si la diabetes está bien controlada, no tendrá PNP durante muchos años” fue la conclusión del experto. Por el contrario, si se ajusta peor, se desarrolla PNP. Conclusión: El control de la glucemia es esencial, especialmente para los jóvenes que desarrollan diabetes. También se recomienda intensificar el reclutamiento, sobre todo por esta razón.
Con la diabetes de tipo 2, la situación es algo diferente. En este caso, son sobre todo los factores de riesgo cardiovascular los que hay que tener en cuenta: Hipertensión, tabaquismo, IMC, triglicéridos y, por supuesto, HbA1c. “La gente no piensa en los factores cardiovasculares de la PNP, sino en los cambios vasculares del nervio periférico”, advirtió el profesor Birklein.
El 15% de los pacientes con dPNP tienen dolor
Pero, ¿por qué el 15% de los pacientes con dPNP tienen dolor? En primer lugar, no hay que olvidar una cosa, dice el experto: No todos los pacientes que tienen diabetes y un dPNP deben tener también dolor neuropático. Los pacientes con diabetes y neuropatía avanzada también pueden desarrollar gonartrosis o sinovitis, por ejemplo, responsables del dolor. Estas posibilidades deben tenerse siempre presentes.
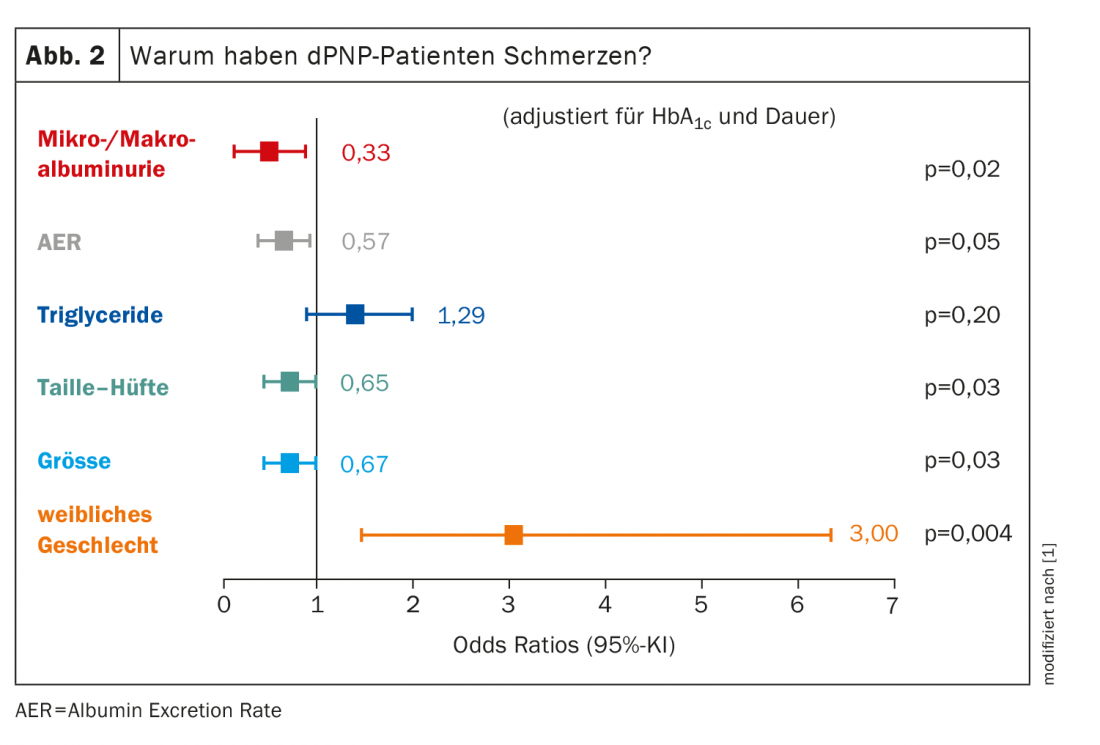
En cuanto al grupo de pacientes con PNPd dolorosa cuya causa es realmente una polineuropatía, son principalmente las mujeres las afectadas: El sexo femenino tiene un cociente de probabilidades de 3,00 para una PNP dolorosa. Todos los demás factores suponen bastante menos (Fig. 2) . El tamaño del cuerpo desempeña un papel, lo que puede parecer sorprendente al principio. Pero: cuanto más largos sean los axones, más probabilidades habrá de que se produzcan daños. “Siempre tenemos que recordar: el metabolismo de todo el axón se lleva a cabo en la neurona – más concretamente en el ganglio de la raíz posterior, por lo que respecta a las fibras del dolor – y tiene que ser transportado hasta las terminaciones nerviosas. Y cuanto más grandes son, más probable es que algo vaya mal por el camino”. Cuantos más axones estén dañados, más dolorosa será la dPNP.
Entonces, ¿de dónde procede el dolor neuropático? Cuando se produce un daño en el axón, la neurona se vuelve inestable eléctricamente y se activa de forma espontánea, explicó el médico especialista en dolor. Esto ocurre a través de los canales de sodio (Na+). Si se bloquean los canales de sodio, una neurona dañada que ha sido axotomizada también vuelve a estar completamente tranquila. La activación de los canales de sodio actúa probablemente a través del metilglioxal. La glucosa se convierte en metilglioxal en el plasma. La glioxalasa – una enzima que es el paso limitante de la tasa aquí – hace entonces que el metilglioxal se convierta en lactato. Si la glioxalasa no funciona bien, el metilglioxal acaba acumulándose. Las mediciones de metilglioxal en plasma han demostrado que los pacientes con diabetes sin dolor tienen una mayor cantidad de metilglioxal, porque naturalmente también tienen más glucosa que las personas sanas. Sin embargo, los pacientes con dolor tienen una cantidad significativamente mayor de metilglioxal en la sangre en comparación con los pacientes sin dolor.
Terapia de dPNP
En cuanto al tratamiento de los pacientes con polineuropatía diabética, el Prof. Birklein enumeró una serie de opciones farmacológicas que se consideran agentes de primera elección:
- Anticonvulsivos (bloqueantes de los canales del Ca – gabapentina, pregabalina)
- Antidepresivos tricíclicos
- Inhibidores de la recaptación de serotonina-norepinefrina (ISRSN) (duloxetina)
- Parche de capsaicina
- Parche de lidocaína
Según la actual directriz S2, la carbamazepina, la oxcarbazepina, la lamotrigina, la venlafaxina y los cannabinoides también pueden considerarse en casos individuales. El Prof. Birklein no está muy convencido de las opciones con escayola, “habría que escayolar más de media pierna de algunos pacientes, y eso no es muy agradable”. Como alternativa, recordó a la gente las opciones no farmacológicas – sabiendo muy bien que muchos enfermos prefieren en última instancia tomar pastillas antes que hacer ejercicio. Si ni la medicación ni el ejercicio aportan el éxito deseado, también existe la electroestimulación de la médula espinal (EME), que ha funcionado bien en estudios con pacientes con PNP aquejados de dolor.
– Congreso Alemán del Dolor 2020, Mannheim (D) y en línea
Fuentes:
- Polineuropatía diabética: del banco a la cabecera. Nuevos datos sobre fisiopatología, diagnóstico y terapia. Congreso Alemán del Dolor Mannheim, 22.10.2020
- Ziegler D, et al: BMJ Open 2015; 5: e006559; doi: 10.1136/bmjopen-2014-006559
InFo PAIN & GERIATURE 2020; 2(2): 24-25 (publicado el 9.12.20, antes de impresión).