El uso de oncológicos dirigidos e inmunoterapéuticos ha revolucionado el tratamiento del cáncer de piel negra en los últimos años. Sin embargo, la secuencia terapéutica óptima sigue sin estar clara aún hoy en día. El análisis de un estudio ha abordado ahora la cuestión de si el estado de la mutación BRAF V600E/K influye en el éxito de la inmunoterapia en el melanoma maligno avanzado.
Alrededor del 40% de todos los melanomas metastásicos presentan una mutación BRAF, siendo la mutación activadora BRAF V600E/K la más común con diferencia [1]. Esta alteración genética puede tener un beneficio terapéutico y servir de diana para diversos tratamientos dirigidos. Por ejemplo, el vemurafenib y el encorafenib son inhibidores de BRAF específicos de mutación muy valorados en la terapia del melanoma. La combinación con inhibidores de MEK como el trametinib puede aumentar aún más la eficacia de estas sustancias y dar lugar a una menor resistencia secundaria. Al igual que BRAF, MEK es un componente de la vía de señalización MAPK, que es importante en la patogénesis y cuya activación incontrolada conduce a un crecimiento celular excesivo en el melanoma con mutación BRAF [2]. Además de los agentes dirigidos para la inhibición de BRAF y MEK, también se utilizan inmunoterapéuticos en el tratamiento del cáncer de piel negro metastásico [3]. Ante la multitud de opciones, también se plantea la cuestión de la secuencia terapéutica óptima para maximizar la eficacia y la tolerabilidad. Los datos disponibles hasta la fecha sugieren que la respuesta a la terapia de primera línea es mejor que a todos los tratamientos posteriores, independientemente de si se utilizan principalmente inhibidores del punto de control o inhibidores de BRAF/MEK [4].
Evaluación de la inmunoterapia tras la terapia dirigida
Un estudio publicado recientemente en JAMA Oncology aporta más pruebas sobre la posible interacción de las terapias dirigidas y los inhibidores de los puntos de control en el tratamiento del melanoma maligno. Los autores investigaron la influencia del estado de mutación de BRAF y el tratamiento previo de inhibición de BRAF/MEK en la inmunoterapia con el inhibidor de PD-1 pembrolizumab. Para ello, analizaron los datos de los tres ensayos clínicos aleatorizados KEYNOTE-001, KEYNOTE-002 y KEYNOTE-006. El análisis incluyó a 1558 pacientes adultos con melanoma avanzado cuyo estado de mutación BRAFV600E/K era conocido y que recibieron pembrolizumab. 1124 pacientes tenían un BRAF de tipo salvaje (WT) y 434 pacientes tenían una mutación de BRAF, que se había dirigido en 271 casos. Los criterios de valoración primarios del análisis retrospectivo fueron la tasa de respuesta objetiva (TRO) al pembrolizumab, así como las tasas de SLP y SG tras cuatro años de inmunoterapia. (Tab.1). Por un lado, se compararon los resultados en pacientes con estado BRAF WT y BRAF mutado y, por otro, los autores también evaluaron los efectos del tratamiento con inhibidores de BRAF con o sin inhibición adicional de MEK dentro del subgrupo de pacientes cuyo tumor presentaba una mutación de BRAF.
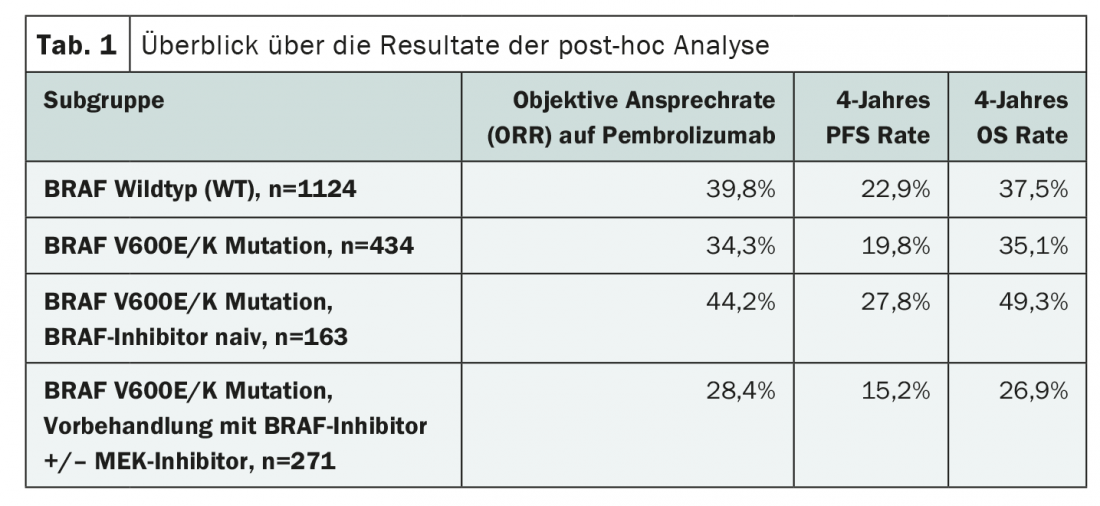
Al comparar los tumores BRAF WT y BRAF mutados, se observaron resultados ligeramente mejores en los que no presentaban la mutación (Tab. 1). Sin embargo, la mayoría de los pacientes con mutación BRAF habían recibido terapia previa con inhibidores de BRAF/MEK. Además, tenían una edad media más avanzada y con mayor frecuencia ya se habían sometido a tratamiento con ipilimumab.
La comparación de los subgrupos con y sin tratamiento con inhibidores de BRAF sugirió que un pretratamiento correspondiente era un mal prerrequisito para la inmunoterapia (Tab. 1). Sin embargo, en la investigación más detallada, resultó que los pacientes que habían sido pretratados con una terapia dirigida presentaban en general peores condiciones. Por ejemplo, entre ellos había un mayor número de tumores PD-L1 negativos y de metástasis cerebrales. No obstante, se mantuvo cierto efecto en varios análisis de subgrupos, lo que, según los autores, podría deberse a deficiencias en la selección de pacientes del estudio.
Con respecto a la seguridad, ni el estado de la mutación ni el pretratamiento con inhibidores de BRAF parecieron desempeñar un papel. Las reacciones adversas a los fármacos se distribuyeron uniformemente entre todos los pacientes. Los autores concluyen que el uso de pembrolizumab puede proporcionar un beneficio clínico en todos los subgrupos estudiados y que la seguridad está garantizada incluso con el pretratamiento. Para confirmar estas afirmaciones, para demostrar posiblemente un efecto significativo de la terapia con inhibidores de BRAF sobre las líneas de tratamiento posteriores, o incluso para poder recomendar una secuencia terapéutica, probablemente aún sea necesaria mucha investigación, también en el marco de estudios prospectivos. Aunque ya se ha hecho mucho con el desarrollo de varias sustancias nuevas que ya han mejorado de forma sostenible el pronóstico del melanoma maligno, podrían lograrse más hitos en el tratamiento del cáncer de piel negro con su uso óptimo y el tratamiento específico de subgrupos.
Fuente: Puzanov, et al: Association of BRAF V600E/K Mutation Status and Prior BRAF/MEK Inhibition With Pembrolizumab Outcomes in Advanced Melanoma: Pooled Analysis of 3 Clinical Trials. JAMA Oncol 2020; 6(8): 1256-1264.
Literatura:
- Long GV, et al: Asociaciones pronósticas y clinicopatológicas del BRAF oncogénico en el melanoma metastásico. J Clin Oncol 2011; 29(10): 1239-1246.
- Knispel S, et al: Melanoma maligno: opciones para pacientes en estadio avanzado. Dtsch Arztebl Internacional 2018; 115(20-21): 4-9.
- Red Nacional Integral del Cáncer: Guías de práctica clínica de la NCCN: melanoma cutáneo (versión 4.2020). www.nccn.org/professionals/physician_gls/pdf/cutaneous_melanoma.pdf.
- Johnson DB, et al: Secuenciación del tratamiento en el melanoma mutante BRAFV600: Anti-PD-1 antes y después de la inhibición de BRAF. J Immunother 2017; 40(1): 31-35.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2020; 8(6): 30