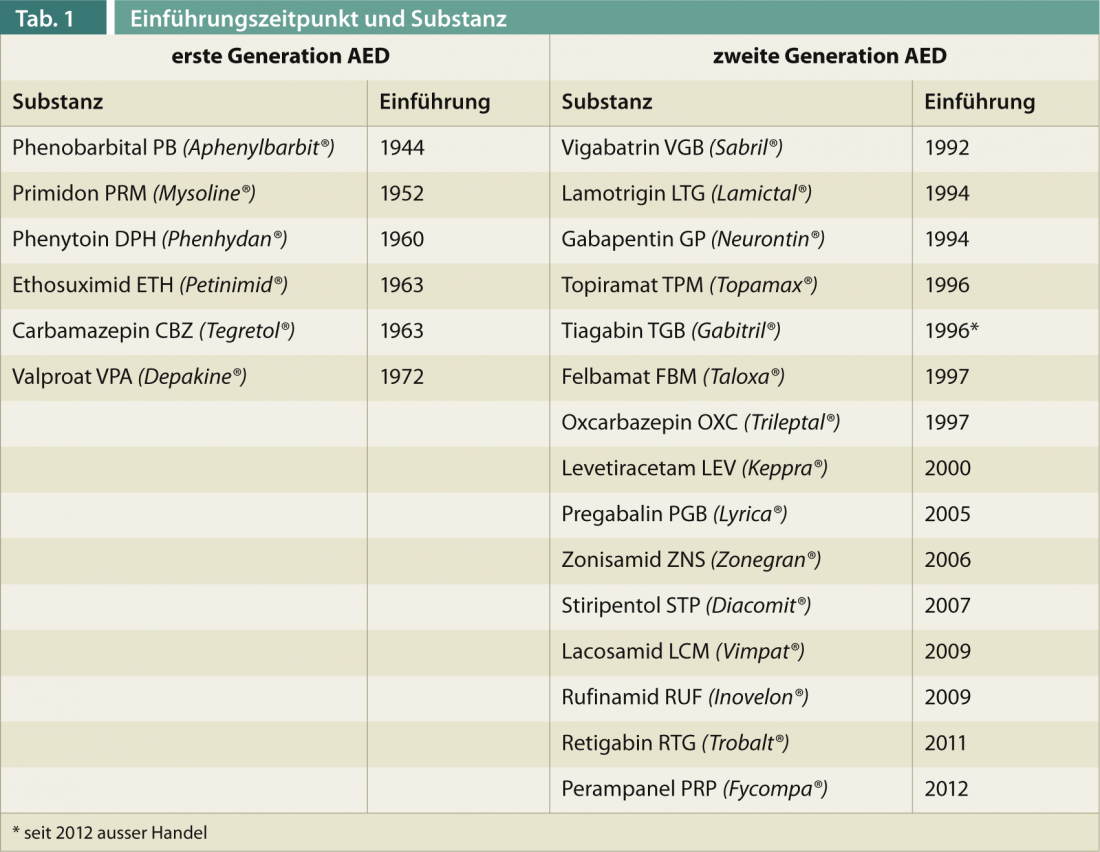
Los fármacos antiepilépticos (FAE) de primera generación (Tab. 1) – el valproato se autorizó por última vez en Suiza en 1972 – se caracterizan por una farmacocinética compleja. En particular, la inducción e inhibición de enzimas hepáticas, especialmente del tipo citocromo P, da lugar a interacciones farmacológicas potencialmente relevantes con riesgo de pérdida de eficacia y sobredosis indeseables en caso de cambios de medicación. Además, el espectro de efectos secundarios, especialmente en lo que se refiere a los efectos crónicos (osteoporosis, polineuropatía, atrofia cerebelosa, etc.), es a veces grave. Los FAE de segunda generación se utilizan en la farmacoterapia de la epilepsia desde la década de 1990. Se diferencian de los anteriores principalmente por tener menos efectos secundarios y una mejor farmacocinética, pero no por una eficacia significativamente mejor. En contra de las esperanzas iniciales, al igual que los antiguos FAE, carecen de efecto antiepileptógeno, es decir, no tienen ningún efecto demostrado sobre la epilepsia como enfermedad y siguen actuando sólo sintomáticamente para prevenir las crisis.
Los medicamentos aprobados en los últimos cinco a diez años se caracterizan en particular por su efecto específico sobre síndromes epilépticos especiales en el sentido de medicamentos huérfanos (RUF y FBM actúan sobre el síndrome de Lennox-Gastaut, STP sobre el síndrome de Dravet). Sin embargo, en opinión de los autores, no deben clasificarse como fármacos de tercera generación porque, según los resultados obtenidos hasta la fecha, no difieren de forma relevante de los fármacos de segunda generación ni en su espectro de acción, ni en sus efectos secundarios, ni en sus interacciones. Su uso en epilepsias resistentes a la terapia, tras el fracaso de otros medicamentos complementarios, puede ser útil, ya que en algunos casos existen otros mecanismos de acción.
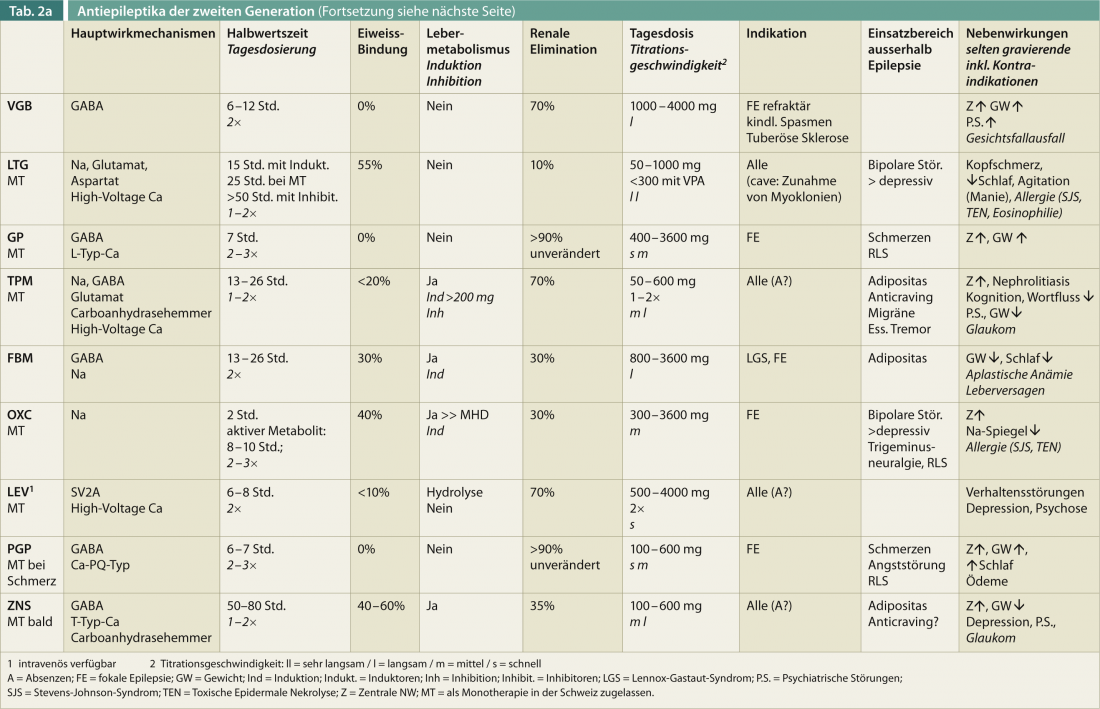
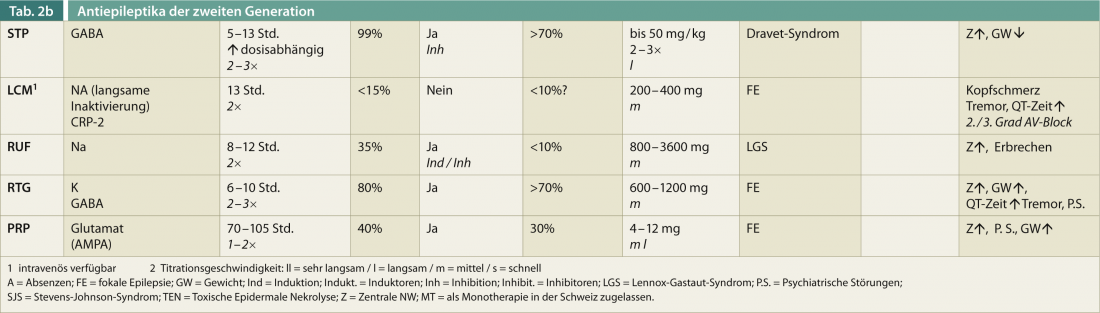
Una visión general de las características relevantes para la terapia de los FAE de segunda generación (sin pretender ser completa) debería ayudar a orientarse rápidamente (Tab. 2). La edad, el sexo, la comedicación y el efecto positivo sobre otras enfermedades son factores esenciales para la elección óptima de un fármaco antiepiléptico.
En el siguiente artículo no se habla de las benzodiacepinas que atacan al receptor GABA-A, como el clonazepam (Rivotril®), el clobazam (Urbanyl®), el lorazepam (Temesta®) y el midazolam (fuera de indicación en Suiza, por ejemplo como aerosol nasal). Aparte de la sedación -sobre todo al principio- muestran más a menudo desarrollo de tolerancia, a veces también pérdida de efecto. Están indicados principalmente como medicación de emergencia y para episodios convulsivos predecibles (infección, menstruación, etc.), así como cuando se cambia o introduce un FAE.
Viejos y nuevos mecanismos de acción de los anticonvulsivos
Los mecanismos de acción típicos conocidos de los fármacos antiepilépticos son el bloqueo de los canales de sodio rápidos dependientes de voltaje y de varios canales de calcio, la potenciación del efecto inhibidor del GABA mediante la inhibición de la degradación y la recaptación o mediante un ataque directo a los receptores de gaba, y la reducción de la acción sináptica del glutamato. El efecto de los FAE de segunda generación se basa en parte en los mismos objetivos farmacodinámicos, pero también existen diferencias. Así, la PRP reduce la liberación del neurotransmisor activador glutamato; a diferencia de los fármacos más antiguos, aquí se describe un nuevo lugar de acción con una farmacodinámica no competitiva en los receptores. La LCM modula los canales de Na celulares, pero un subtipo específico que muestra tiempos de apertura del canal más largos. Los nuevos mecanismos de acción, por ejemplo en LEV, son la modulación de una proteína vesicular (SV2) o CRP2 en LCM. En general, es favorable combinar FAE con diferentes mecanismos de acción. Las combinaciones de FAE con el mismo mecanismo de acción, especialmente los bloqueantes de los canales de sodio, pueden provocar un aumento de las intoxicaciones. En las epilepsias generalizadas, hay que recordar que los tipos específicos de crisis pueden aumentar e incluso producirse con efectos sobre el GABA y en el canal del sodio. Una terapia combinada farmacodinámicamente sinérgica y eficaz es la de VPA y LTG, aunque en este caso deben tenerse en cuenta consideraciones farmacocinéticas (véase más adelante).
Dado que las crisis epilépticas se entienden cada vez más como una “disfunción de la red”, en el futuro habrá que reevaluar los objetivos y modos de acción de los FAE.
La farmacocinética suele ser menos problemática
En principio, los FAE de segunda generación muestran una menor interacción con los sistemas enzimáticos y los fármacos concomitantes. Así, la unión a proteínas suele ser menor y la fracción libre, no unida a proteínas, del FAE puede desempeñar un papel, especialmente con sustancias más antiguas como el DPH; si es necesario, debe determinarse en casos individuales. Debe tenerse en cuenta que los FAE con una débil inducción enzimática como el OXC, RUF, FBM y TPM (sólo a partir de una dosis superior a 200 mg) también pueden debilitar el efecto de los anticonceptivos hormonales. Además, los niveles de lamotrigina pueden descender significativamente, es decir, en más de un 50%, bajo anticoncepción hormonal con estrógenos, así como durante el embarazo. Las comprobaciones en el espejo son esenciales en este caso.
Los efectos inhibidores de la medicación concomitante con VPA también deben tenerse en cuenta con los nuevos FAE, por lo que los niveles de LTG también pueden aumentar significativamente, además del conocido aumento del epóxido de carbamazepina (metabolito de la CBZ). También son posibles ligeros aumentos para LEV, PRP, RUF, RTG y FBM. Para otros fármacos como el TPM y el CNS, el impacto no está claro. Debe tenerse en cuenta que también pueden producirse intoxicaciones y una disminución del efecto antiepiléptico con los FAE de segunda generación si se cambia una medicación concomitante inhibidora o inductora de enzimas. Especialmente en el caso de los inductores enzimáticos, los efectos pueden seguir produciéndose con latencias de varias semanas. Además, debe tenerse en cuenta que el estado estacionario suele alcanzarse tras cinco semividas en el caso de cambios de dosis.
Casi todos los FAE tienen un mecanismo de absorción lineal, es decir, el aumento de la dosis del fármaco hace que su concentración en el suero sanguíneo aumente en un factor igual a la cantidad de la dosis. Las excepciones son el aumento exponencial del DPH, la reducción no lineal de la absorción del VPA a dosis más altas y la absorción saturable del GP y el SNC a dosis más altas. El PRP se absorbe con un ligero retraso con la ingesta de alimentos, es decir, la relación temporal entre la ingesta de alimentos y la de fármacos debería ser siempre la misma.
Los FAE suelen tomarse 2×/día; el GP, el RTG y el OXC no retardado suelen tener que dividirse en tres dosis diarias. Las monoterapias CNS, PRP y en parte de dosis bajas con LTG y TPM son posibles como dosis únicas. En cuanto a las dosis diarias, debe recordarse que la dosis total (especialmente para la LTG) y el número de dosis deben determinarse en función de la combinación con inhibidores enzimáticos o inductores enzimáticos.
Los efectos secundarios suelen ser menos graves
Más del 20% de los pacientes interrumpen la terapia antiepiléptica debido a los efectos secundarios, que suelen ser de naturaleza central (fatiga, ataxia de la marcha, visión doble). La titulación más rápida suele ser ligeramente mejor con LEV que con VPA. Aproximadamente un tercio de los pacientes siguen siendo refractarios a la terapia debido a los efectos secundarios repetidos del FAE. En resumen, casi el 90% experimenta algún tipo de efecto secundario, que puede ser más o menos grave. En la tabla 2, se presentan los efectos secundarios relevantes de los FAE de segunda generación sin pretender ser completa.
Los nuevos FAE parecen tener un riesgo de teratogenicidad relativamente bajo (sólo hasta las 12 semanas de embarazo). Sin embargo, el número total de casos a este respecto es bastante bajo; la mayor parte de los datos están disponibles para el LEV -el mejor perfil a este respecto- y el LTG. El VPA y las politerapias presentan la mayor teratogenicidad. El valproato también puede tender a tener un efecto negativo en el desarrollo cognitivo de los hijos de madres que toman valproato.
DEA y edad
Para la terapia de la epilepsia en ancianos, debe considerarse que el levetiracetam es el más adecuado debido a su perfil farmacológico y a sus escasas interacciones, también por los relativamente bajos efectos secundarios centrales y el deterioro cognitivo. Además, el uso de gabapentina y lamotrigina es útil, sobre todo si existen trastornos del comportamiento potencialmente acentuados o comorbilidades psiquiátricas debidas al VLE. Con la LTG, debe tenerse en cuenta el tiempo de inicio lento, por lo que puede ser útil añadir una benzodiacepina (por ejemplo, clobazam).
Indicaciones del DEA
Las indicaciones de los FAE se definen en función de los estudios disponibles para las epilepsias focales y generalizadas, así como para los síndromes especiales, y son otorgadas por las autoridades competentes. Debe tenerse en cuenta que ciertos medicamentos que actúan principalmente para las crisis focales – como el VGB, GP, PGB, LCM – pueden teóricamente empeorar las epilepsias generalizadas. La acentuación de la mioclonía en las epilepsias generalizadas es posible bajo LTG.
Según diversas directrices, el VPA, seguido del TPM y el LTG, son la primera elección para las epilepsias generalizadas idiopáticas. En parte, también se hacen buenas experiencias con LEV y CNS. El uso del VPA -a pesar de ser el agente más potente en las epilepsias generalizadas idiopáticas con crisis tónico-clónicas generalizadas, ausencias (comparables a la HTA) y crisis mioclónicas- debe cuestionarse siempre de forma crítica en las mujeres en edad fértil (véase más adelante).
Para las crisis focales, incluso con generalización secundaria, no existen diferencias tan significativas en la eficacia entre los FAE.Se recomienda la LTG o la LEV como agente de primera línea para las epilepsias focales. También es posible utilizar OXC, TPM, VPA, GP, PGB y CNS. En lugar de reintroducir la CBZ – en Suiza, se recomienda la prueba genética HLA-B*15:02 debido a la potencia alergénica (positivo en aprox. 10-15% en asiáticos; <2% en población blanca) – también debería utilizarse OXC para una incidencia ligeramente superior de hiponatremia.
El gran número de FAE también se ha investigado sistemáticamente con respecto a su efecto sobre las enfermedades concomitantes. Estas comorbilidades deben tenerse siempre en cuenta a la hora de seleccionar el FAE (Tabla 2) y contribuyen significativamente a la decisión de tratamiento.
Ajuste individual de la medicación de forma centralizada
Con más de 20 FAE disponibles, debe tenerse en cuenta que la elección individual de la medicación óptima se ha vuelto aún más importante. Así pues, siempre hay que tener en cuenta la edad, la situación médica y social, así como las comorbilidades de nuestros pacientes, además del tipo de epilepsia . El conocimiento de los efectos secundarios en términos negativos y de los efectos concomitantes en términos positivos debe complementar las consideraciones farmacocinéticas. Los pacientes con una elevada frecuencia de crisis al inicio de la epilepsia y una etiología sintomática tienen un mayor riesgo de no poder ser controlados con medicación. En casos de resistencia a la terapia, debe considerarse la cirugía de la epilepsia tras dos años de terapia infructuosa con dos fármacos antiepilépticos. Sin embargo, en general, casi dos tercios de los pacientes (el 50% con el primer FAE y el 9% con el segundo) quedan libres de convulsiones y suelen tener pocos efectos secundarios agudos y a largo plazo.
Dr. med. Klaus Meyer
Dr. Martinus Hauf
Literatura:
- Brodie MJ, Barry SJ, et al: Western Infirmary, Glasgow. Comentario en Neurología 2012 15 de mayo; 78(20): 1542-1543.
- Glauser T, Ben-Menachem E, et al: Revisión actualizada de la evidencia de la ILAE sobre la eficacia y efectividad de los fármacos antiepilépticos como monoterapia inicial para crisis y síndromes epilépticos. Epilepsia 2013; 54(3): 551-563.
- Marson AG, Al-Kharusi AM, et al: El estudio SANAD sobre la eficacia de la carbamazepina, la gabapentina, la lamotrigina, la oxcarbazepina o el topiramato para el tratamiento de la epilepsia parcial: un ensayo controlado aleatorio no cegado. Lancet 2007; 369(9566): 1000-1015.
- Marson AG, Al-Kharusi AM, et al: The SANAD study of effectiveness of valproate, lamotrigine, or topiramate for generalized and unclassifiable epilepsy: an unblinded randomized controlled trial. Lancet 2007; 369(9566): 1016-1026.
- Costa J, Fareleira F, et al: Comparabilidad clínica de los nuevos fármacos antiepilépticos en la epilepsia parcial refractaria: Una revisión sistemática y metaanálisis. Epilepsia 2011; 52(7): 1280-1291.
- Perucca E, Tomson T: El tratamiento farmacológico de la epilepsia en adultos. Lancet Neurol 2011; 10: 446-456.