El cáncer de pulmón es el cáncer mortal más frecuente en todo el mundo y su incidencia sigue aumentando en los tiempos modernos. A pesar de los avances en el diagnóstico y la terapia, la letalidad del cáncer de pulmón es líder en ambos sexos en comparación con el resto de cánceres. Básicamente, los carcinomas pulmonares de células pequeñas se distinguen de los carcinomas pulmonares de células no pequeñas, lo que tiene una importancia fundamental para el régimen terapéutico y el pronóstico. Mientras que el cáncer de pulmón microcítico es el dominio de la quimioterapia y la radioterapia, el cáncer de pulmón no microcítico (CPNM) se opera en la fase localizada y se puede conseguir la curación. En este artículo de revisión sólo se analiza el seguimiento y el pronóstico de los CPNM operados con intención curativa.
Dado que el cáncer de pulmón sólo suele diagnosticarse en un estadio avanzado y a menudo ya metastatizado, sólo alrededor del 25-30% de todos los “cánceres de pulmón no microcíticos” (CPNM) pueden tratarse con cirugía [1]. El requisito previo para un concepto de terapia quirúrgica es la posibilidad de una resección radical, siempre que el paciente sea operable [2]. Por regla general, en los estadios I a IIIA debe aspirarse a una intervención quirúrgica, en caso necesario con quimioterapia (neo)adyuvante. La tasa de supervivencia a 5 años correspondiente a los estadios tumorales se sitúa entre el 24 y el 73% en este grupo de pacientes (Fig. 1 ) [2].

Recurrencia y carcinoma metacrónico
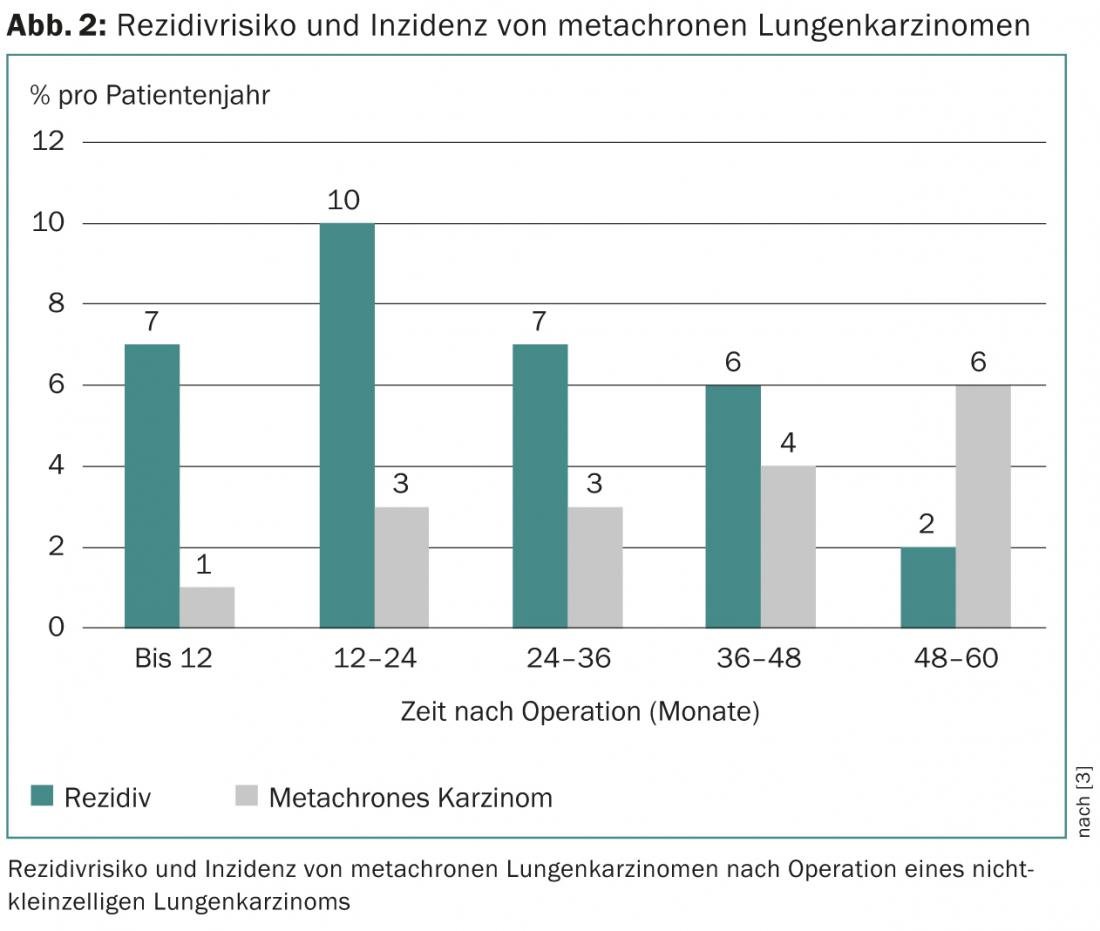
La probabilidad de supervivencia del paciente depende del estadio del tumor y del correspondiente riesgo de recidiva. Esta última aumenta hasta un máximo del 10% anual en los dos primeros años tras la cirugía y después vuelve a disminuir lentamente [3]. Acumulativamente, entre el 5 y el 71% de todos los pacientes -dependiendo del estadio inicial del tumor- sufren una recidiva, que en la mitad de los casos se produce en los dos primeros años del postoperatorio [4–7]. La recidiva de un carcinoma metacrónico (“segundo carcinoma primario”), cuyo riesgo aumenta de forma constante con el tiempo tras la operación, también debe distinguirse de la recidiva (Fig. 2).
Pros y contras del seguimiento postoperatorio
Teniendo en cuenta la tasa de recidiva y el riesgo de carcinoma metacrónico, parece razonable que estas neoplasias puedan detectarse precozmente, es decir, en una fase asintomática, mediante una vigilancia estructurada posterior a la terapia, siempre que una nueva intervención terapéutica mejore las posibilidades de supervivencia y la calidad de vida.
Por desgracia, los datos relativos al valor del seguimiento postoperatorio tras la cirugía del cáncer de pulmón son más bien escasos y a veces incluso contradictorios. Dado que la tasa de cirugía de las recidivas locorregionales es relativamente baja, del 1 al 4%, no se pueden hacer afirmaciones fiables sobre el beneficio del seguimiento del tumor [7]. Se carece por completo de ensayos controlados aleatorios que hayan abordado esta cuestión. En un estudio prospectivo, no aleatorizado, se demostró que la mediana del tiempo de supervivencia de las recidivas asintomáticas es significativamente mayor que la de las sintomáticas [6]. Por el contrario, otros autores no pudieron encontrar ninguna influencia del seguimiento estructurado en el tiempo de supervivencia ni en la calidad de vida [8–10]. Sin embargo, en un metaanálisis reciente, a pesar de la heterogeneidad de los programas de seguimiento utilizados en los estudios incluidos, el seguimiento estructurado demostró que las recidivas tenían más probabilidades de ser diagnosticadas en un estudio asintomático, lo que mejoraba significativamente la probabilidad de supervivencia (cociente de riesgos 0,61; intervalo de confianza del 95%: 0,50-0,74; p<0,01) [11]. Sin embargo, debe tenerse en cuenta la relación coste-eficacia de los seguimientos postoperatorios regulares, de aproximadamente 90.000 francos suizos por paciente y año [12, 13].
Por desgracia, ni el estadio inicial del tumor ni la resecabilidad de una recidiva locorregional se tuvieron en cuenta en los estudios anteriores que abordaron esta cuestión. Por este motivo, diversas partes reclaman un programa de seguimiento “individualizado”, es decir, adaptado al estadio del tumor y al estado de salud [7].
Métodos de seguimiento postoperatorio
En principio, pueden utilizarse varias modalidades en el seguimiento postoperatorio, individualmente o en combinación (radiografía, tomografía computerizada, tomografía por emisión de positrones [PET], broncoscopia, laboratorio y examen clínico).
Sin embargo, la heterogeneidad de los programas de seguimiento dificulta una evaluación concluyente de sus beneficios y rentabilidad. Como ya se ha mencionado, faltan ensayos aleatorios que hayan comparado las distintas estrategias en pacientes con CPNM sometidos a cirugía. Actualmente no está claro qué método de seguimiento debe utilizarse y a qué intervalos. A este respecto, las recomendaciones y las opiniones de los expertos de las distintas sociedades profesionales tampoco son coherentes. Por otro lado, hay acuerdo en que los exámenes de seguimiento periódicos son útiles (Tab. 1). En cuanto al método, la tomografía computarizada parece ser el método de elección debido a su rentabilidad, exposición a la radiación relativamente baja y sensibilidad relativamente buena (62-100%), aunque la PET/TC es superior en términos de sensibilidad (97-100%) [7].
Otra cuestión sin resolver: ¿quién debe realizar los controles de seguimiento postoperatorio? No obstante, en un estudio retrospectivo de 245 pacientes, existen pruebas de que no hay diferencias significativas en la mortalidad cuando el seguimiento lo realiza el equipo quirúrgico tratante o un médico general [14]. Incluso parece razonable, según un estudio británico, que las enfermeras con formación específica puedan realizar un seguimiento comparable al de los médicos en términos de satisfacción del paciente y costes [15]. Sin embargo, en este estudio no se tuvo en cuenta la influencia en las tasas de mortalidad.

Conclusión
Aunque faltan datos claros sobre el beneficio de un seguimiento postoperatorio estructurado en el CPNM, parece recomendable un programa de seguimiento si se puede ofrecer un enfoque terapéutico curativo. Dado que la frecuencia de recidivas es significativamente mayor en los dos primeros años postoperatorios que en los siguientes, los controles de seguimiento deben realizarse de forma más estrecha (por ejemplo, cada 3-6 meses), especialmente durante este periodo. Al mismo tiempo, sin embargo, hay que señalar que hay que tener en cuenta el número de tomografías computerizadas, especialmente en pacientes jóvenes, debido a la exposición a la radiación. No obstante, la tomografía computarizada parece ser el método de elección en el seguimiento de tumores debido a su alta sensibilidad y a la relativamente baja exposición a la radiación.
Conclusión para la práctica
- El riesgo de recurrencia tras un cáncer de pulmón de células no pequeñas operado de forma curativa es mayor en los dos primeros años postoperatorios (7-10%/año).
- Si una recidiva se detecta precozmente en un estadio asintomático, probablemente pueda reducirse la mortalidad, siempre que pueda ofrecerse un enfoque terapéutico curativo. Sin embargo, la situación de los datos a este respecto es insuficiente.
- No existen estudios aleatorizados que hayan comparado diferentes programas de seguimiento (modalidad, calendario e intervalo) en cuanto a sus beneficios y rentabilidad. Por lo tanto, las recomendaciones de las distintas sociedades profesionales son heterogéneas en este sentido.
- Debido a su alta sensibilidad y a la relativamente baja exposición a la radiación, la TC es actualmente el método de elección para detectar las recidivas tempranas.
Dr. Daniel Franzen
Literatura:
- Eur Respir Rev 2013; 22: 382-404.
- Tórax 2009; 136: 260-271.
- J Thorac Cardiovasc Surg 2013; 145: 75-81; discusión 81-72.
- Cancer Res 1995; 55: 51-56.
- Ann Thorac Surg 1984; 38: 331-338.
- Ann Thorac Surg 2000; 70: 1185-1190.
- Ann Thorac Surg 2013; 95: 1112-1121.
- Tórax 1999; 115: 1494-1499.
- J Thorac Cardiovasc Surg 1996; 112: 356-363.
- Ann Surg 1995; 222: 700-710.
- J Thorac Oncol 2011; 6: 1993-2004.
- Ann Thorac Surg 1995; 60: 1563-1570; discusión 1570-1562.
- Eur Respir J 2002; 19: 464-468.
- Ann Thorac Surg 2000; 69: 1696-1700.
- BMJ 2002; 325: 1145.
- J Clin Oncol 2004; 22: 330-353.
- Ann Oncol 2010; 21 Suppl 5: v103-115.
- Tórax 2007; 132: 355S-367S.
- Radiology 2000; 215 Suppl: 1363-1372.
- Directrices en oncología de la National Comprehensive Cancer Network (NCCN): Carcinoma de células no pequeñas. Disponible en: www.nccn.org/professionals/physician_gls/PDF/nscl.pdf
InFo Oncología y Hematología 2013; 1(1): 22-24