Es necesario mejorar la información y la educación del público sobre esta enfermedad. En los países industrializados, la tasa de casos no diagnosticados se estima en torno al 50%. En cuanto a la terapia, es importante una buena cooperación entre el oftalmólogo tratante y el médico general.
El glaucoma es una enfermedad ocular crónica que puede conducir potencialmente a la ceguera y que se conoce desde hace mucho tiempo. Interesante y no conocido por todos es el trasfondo histórico de la nomenclatura: Ya los antiguos griegos observaron que ciertos pacientes cegados mostraban un color llamativo en el reflejo pupilar. La traducción de la palabra griega “glaukos” es “gris-azulado-verdoso”. La anatomía exacta del ojo y la fisiopatología aún no se conocían. En el siglo VIII d.C. se acuñó el término “catarata” para designar las opacidades del cristalino, pero aún no estaba claro el mecanismo exacto de la ceguera. No fue hasta la invención del oftalmoscopio y la consiguiente posibilidad de evaluar el fondo del ojo y el nervio óptico cuando se pudieron separar las entidades catarata y glaucoma.
En cambio, el término “glaucoma” utilizado en lengua alemana no se acuñó hasta el siglo XVIII. En aquella época se pensaba que los “jugos” del ojo podían cambiar de color y adquirían un tono verdoso en el glaucoma. Sin embargo, se desconoce el origen exacto del término. La enfermedad puede manifestarse a cualquier edad, pero su incidencia aumenta significativamente con la edad. Se supone que el 2,5% de todas las personas mayores de 40 años en Suiza padecen glaucoma, siendo destacable que más de la mitad de los pacientes afectados desconocen su enfermedad [1].
En 2004, el glaucoma fue la causa más común de ceguera irreversible [2] y la catarata fue la causa más común de ceguera reversible. La degeneración macular senil también conduce a la ceguera irreversible. En los últimos años, el número de pacientes que se quedan ciegos por degeneración macular ha aumentado bruscamente debido al incremento de la esperanza de vida y ha pasado a ocupar la primera posición de las causas de ceguera en ciertos países.
Fisiopatología
En términos sencillos, el globo ocular es una estructura esférica rodeada por una cáscara sólida. En consecuencia, existe una presión interna variable para cada ojo, que es importante para la homeostasis. Esta presión interna está controlada por la relación entre la producción de humor acuoso y su salida. En el glaucoma, existe un desajuste de estos dos componentes, y muy a menudo el flujo de salida en el ángulo camerular está deteriorado. Si la presión intraocular aumenta por encima de la presión tolerable para el ojo afectado, se producen daños progresivos en la parte más débil, el nervio óptico. El daño creciente del nervio óptico conduce a un deterioro progresivo del campo visual. Es importante subrayar que la presión interna óptima tolerable es diferente para cada ojo; el glaucoma progresivo puede desarrollarse incluso con una presión interna normal-baja. Por ello, las definiciones actuales de glaucoma omiten la presión interna como factor principal del daño del nervio óptico y la equiparan a los demás factores de riesgo [3]. Estos factores de riesgo se describen con más detalle en la sección sobre diagnósticos.
División
Los glaucomas pueden clasificarse según su estructura o su etiología. Estructuralmente, distinguimos entre las siguientes formas:
- Los glaucomas de ángulo abierto (aproximadamente el 90%) muestran un ángulo camerular abierto en toda su extensión. La obstrucción del flujo de salida del humor acuoso se localiza principalmente a nivel de la malla trabecular y en la transición a las venas epiesclerales y provoca un aumento más o menos pronunciado de la presión intraocular. Un subgrupo son los pacientes con el llamado glaucoma de presión normal, en el que la presión intraocular se encuentra siempre dentro del rango normal, pero el nervio óptico muestra signos de daño creciente.
- Los glaucomas de ángulo cerrado (aproximadamente el 5%) muestran un ángulo de cámara más o menos cerrado. Los pacientes con una situación denominada de ángulo estrecho deben ser informados de los hallazgos, ya que en determinadas condiciones puede producirse un rápido aumento de la presión ocular. Este rápido aumento de la presión ocular es una situación de emergencia oftalmológica: el ataque agudo de glaucoma es muy doloroso y, además de los síntomas oculares, también provoca un pronunciado deterioro del estado general.
En una clasificación según la etiología, distinguimos dos formas:
- En el glaucoma primario (alrededor del 95%), el glaucoma es la principal enfermedad del ojo.
- En el glaucoma secundario (alrededor del 5%), existe otra enfermedad ocular y el glaucoma es una enfermedad secundaria.
Los glaucomas congénitos constituyen un subgrupo y la mayoría son glaucomas primarios.
Diagnóstico
El oftalmólogo realiza un historial médico para determinar el perfil de riesgo. Distinguimos los siguientes grupos como factores de riesgo [4]:
- Factores de riesgo familiares, especialmente glaucoma en los parientes más cercanos (padres, hermanos y abuelos)
- Factores de riesgo personales: La edad, la etnia y el sexo son factores dados. Los factores de riesgo vascular pueden influir parcialmente, por lo que debe registrarse la hipotensión sistémica (especialmente la nocturna). Cabe destacar las fuertes fluctuaciones de la tensión arterial, que pueden registrarse en el transcurso de una medición de la tensión arterial de 24 horas. Los pacientes con el llamado glaucoma de tensión normal muestran a menudo signos de desregulación vascular con acra fría, síntomas de Raynaud, migraña y a veces hipotensión sistémica. La influencia de la hipertensión sistémica y la diabetes mellitus sigue siendo controvertida. El historial de medicación es importante: los anticolinérgicos pueden provocar un ataque agudo de glaucoma en pacientes con una situación de ángulo estrecho. Los preparados que contienen cortisona (también en forma de pomadas o inyecciones) provocan un aumento de la presión intraocular en un tercio de los pacientes. El mecanismo se basa en un aumento de la resistencia al flujo de salida en el ángulo camerular, para lo que se discuten varias teorías y se presume la presencia de un defecto genético (“respondedor a esteroides”) [5].
- Factores de riesgo ocular: El factor de riesgo más importante es el aumento de la presión intraocular, aunque como ya se ha mencionado, cada ojo tiene su presión intraocular máxima tolerable. Otros factores de riesgo son las anomalías refractivas superiores (hipermetropía y miopía), una córnea fina (norma: 500-600 micras), hemorragias intraoculares (sobre todo alrededor del disco óptico) y depósitos en el ojo como la dispersión pigmentaria y la pseudoexfoliación, que pueden bloquear el flujo de salida en el ángulo camerular.
Durante el examen, se determinan la refracción y la agudeza visual de los ojos para obtener indicaciones sobre el rendimiento visual. La morfología de los ojos se evalúa utilizando una lámpara de hendidura con un aumento de aproximadamente 10-16 veces para identificar cualquier factor de riesgo. La presión ocular suele medirse mediante la tonometría de aplanación de Goldmann (TAG), que sigue siendo el patrón oro [6].
La presión intraocular óptima oscila entre 8-21 mm Hg. Se trata de un valor estadístico, basado en un valor medio de 15 mm Hg y la desviación típica habitual.
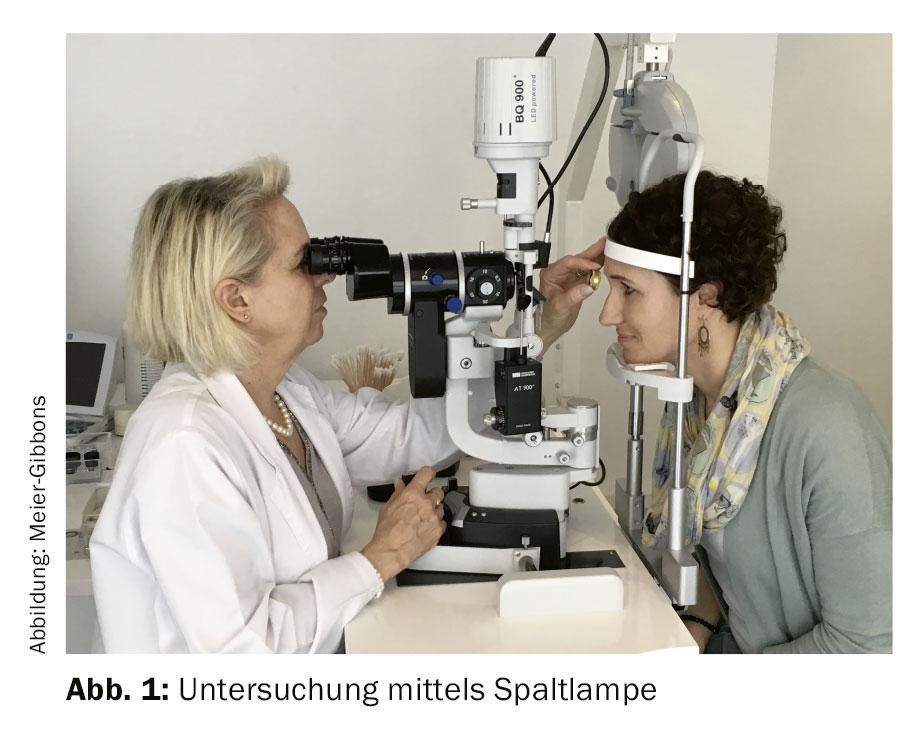
Si se sospecha glaucoma, se solicitan exámenes adicionales (Fig. 1):
- La determinación del campo visual
- La representación morfológica del nervio óptico
- La representación del ángulo de la cámara mediante un cristal de contacto
- Medición de la presión ocular mediante diversos dispositivos de medición y determinación del grosor de la córnea.
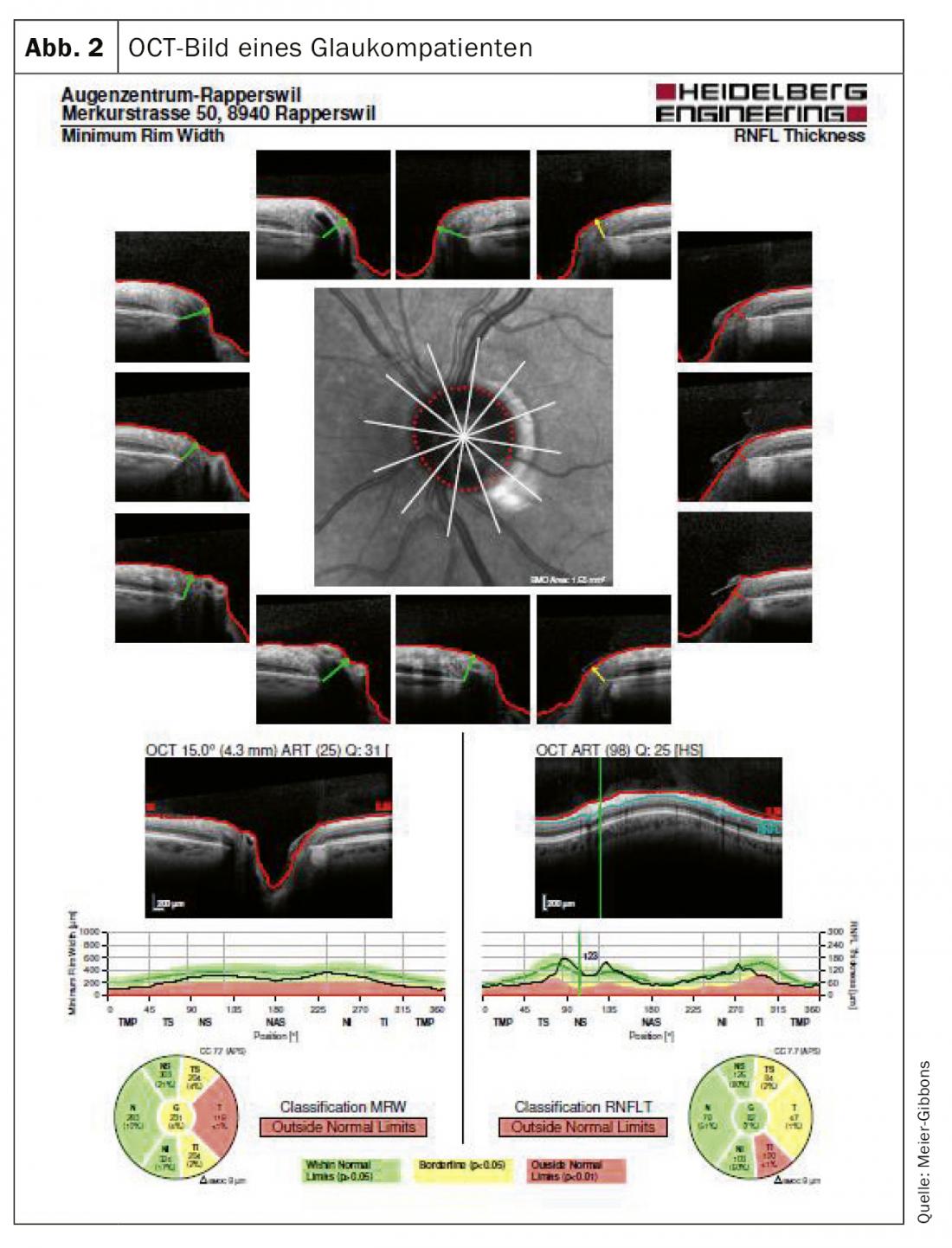
El campo visual se determina mediante perimetría automática. En este examen, se presentan al paciente estímulos luminosos monoculares de diversos tamaños e intensidades dentro del campo de visión normal. El nervio óptico debe medirse tridimensionalmente, para lo que hoy en día se utiliza sobre todo la tomografía de coherencia ocular (OCT) guiada por láser (Fig. 2). Con este examen, las capas de tejido nervioso pueden representarse con precisión y compararse con una base de datos normalizada. A menudo se siguen tomando fotografías en color, ya que éstas pueden utilizarse para la comparación incluso después de muchos años, lo que desgraciadamente no suele ser posible con los dispositivos OCT que cambian con frecuencia (Fig. 3).

Es importante examinar el ángulo de la cámara utilizando un cristal de contacto. La morfología del ángulo camerular proporciona información sobre el tipo de glaucoma presente y es importante para determinar la terapia. El examen con el cristal de contacto no es invasivo e indoloro para el paciente.
En los últimos años, se han desarrollado varios dispositivos de medición de la presión ocular más novedosos, ya que los estudios habían demostrado que la medición según el TAG no revelaba la verdadera presión interna en determinados pacientes (especialmente con córneas muy finas, en presencia de cambios corneales patológicos o tras un tratamiento correctivo con láser). Tanto estos dispositivos de medición como la determinación del grosor de la córnea se utilizan como complemento de la medición según la GAT.
Todos los exámenes mencionados son indispensables para hacer un diagnóstico. Distinguimos entre hallazgos normales, hallazgos sospechosos de glaucoma y hallazgos claramente patológicos.
Es importante informar al paciente con exactitud: Si los hallazgos oculares son normales, se recomienda una revisión y se informa al paciente de que el ojo puede cambiar a lo largo de la vida y que ciertas enfermedades pueden aparecer sólo a una edad avanzada. Es imprescindible proporcionar al paciente ciertas pautas para la distancia de control. Depende de la edad, los antecedentes médicos, los hallazgos locales y los factores de riesgo.
En caso de un hallazgo sospechoso de glaucoma, es imperativo informar al paciente: un hallazgo dudoso en ese momento puede convertirse en glaucoma en poco tiempo. Un paciente con sospecha de glaucoma presenta, por definición (Academia Americana de Oftalmología y Sociedad Europea de Glaucoma), uno o más de los siguientes hallazgos:
- El disco óptico es sospechoso de glaucoma
- El campo visual es sospechoso de glaucoma
- La presión ocular es superior a 21 mm Hg (por lo que es importante medir la presión ocular a diferentes horas del día para poder determinar los valores más altos).
Observación general: Cualquier examen anormal debe repetirse primero para mayor seguridad. Si la recidiva muestra realmente patología, puede haber una transición a la enfermedad glaucomatosa.
Terapia
Debemos ser conscientes de que el paciente apenas se da cuenta de la enfermedad del glaucoma, al menos al principio, y de que toda terapia tiene un efecto y a menudo efectos secundarios.
Las directrices de la Sociedad Europea de Glaucoma establecen que cualquier terapia debe cumplir los tres puntos principales siguientes: debe ser a la vez eficaz y barata, y debe causar el menor número posible de efectos secundarios [3].
Por el momento, bajar la presión intraocular es la única terapia que puede reducir la progresión de la enfermedad. Por supuesto, los demás factores de riesgo mencionados anteriormente deben comprobarse y reducirse si es posible. Sería interesante conocer la influencia y la protección del propio nervio óptico, la llamada neuroprotección. Desgraciadamente, los ensayos previos con fármacos no han sido muy prometedores.
¿Qué opciones tenemos para reducir la presión intraocular? En realidad sólo hay dos opciones:
- Reducción de la producción de humor acuoso
- Mejora del flujo de salida del humor acuoso
Reducción de la producción de humor acuoso: El humor acuoso se produce en el cuerpo ciliar, circula por las cámaras posterior y anterior del ojo y sale del ojo a través del ángulo camerular hacia la circulación vascular. La producción de humor acuoso puede reducirse con betabloqueantes (BB), agonistas alfa (AA) e inhibidores de la anhidrasa carbónica (IAC). El betabloqueante timolol se utiliza en la terapia del glaucoma desde 1978 y reduce la presión intraocular en un 20-25%. Localmente, los BB se toleran bien, pero a menudo provocan efectos secundarios sistémicos como la disminución de la presión arterial y el pulso. En nuestra opinión, los pacientes con una terapia de BB planificada deben consultarlo con su médico de cabecera para evitar interferencias con otros medicamentos.
Los agonistas alfa se han utilizado durante muchos años, aunque los AA disponibles anteriormente a menudo provocaban efectos secundarios locales y sistémicos muy pronunciados, por lo que ya no se utilizan. En la actualidad, el fármaco más utilizado es la brimonidina, que reduce la presión intraocular en un 20-25%, pero también puede provocar efectos secundarios locales (hiperemia) y sistémicos (vasculares y cerebrales).
Los inhibidores de la carboanhidrasa se han utilizado en forma sistémica en la terapia del glaucoma desde principios de la década de 1950 y también se utilizan localmente desde 1994. A veces provocan efectos secundarios sistémicos graves, especialmente en presencia de hipersensibilidad a las sulfonamidas. Tanto los alfa agonistas como los inhibidores de la anhidrasa carbónica se utilizan a veces en combinación con los betabloqueantes para lograr una mejor reducción de la presión ocular.
Mejorar la salida del humor acuoso: El humor acuoso sale del ojo por dos vías: El flujo de salida convencional o trabecular y, con mucha menor frecuencia, el flujo de salida no convencional o uveoescleral. Esta última corresponde a una proporción del 25-55% entre los niños y disminuye progresivamente con la edad. Una disminución del flujo de salida del humor acuoso provoca un remanso en el ojo y, posteriormente, un aumento creciente de la presión intraocular. Estudios recientes han demostrado que la mayor parte del aumento decisivo de la resistencia al flujo de salida se encuentra en la zona de la malla trabecular iuxtacanalicular y en la zona de la pared interna del canal de Schlemm.
Los fármacos más importantes utilizados para mejorar el flujo de salida del humor acuoso son los agonistas locales de las prostaglandinas. Se utilizaron por primera vez en la terapia del glaucoma a mediados de la década de 1990 y rápidamente se hicieron con el liderazgo de los fármacos antiglaucomatosos. El primer producto fue el latanoprost, seguido de varios fármacos similares. El efecto (una reducción aproximada del 25% de la presión ocular) dura 24 horas, por lo que la adherencia del paciente es mejor. Los agonistas de la prostaglandina prácticamente no presentan efectos secundarios sistémicos, pero los efectos secundarios locales podrían ser considerables: Crecimiento de las pestañas, aumento de la pigmentación del iris, hiperemia de la conjuntiva, pero también decoloración más oscura de la piel periorbitaria y atrofia del tejido graso orbitario.
En algunos países (todavía no en Europa), se han aprobado dos nuevos grupos de sustancias para la terapia del glaucoma: Inhibidores de la roquinasa y latanoprost bunod. Ambos medicamentos mejoran el flujo de salida del humor acuoso y además sólo deben utilizarse una vez al día.
Es importante que abordemos brevemente la cuestión del uso cada vez más común de medicamentos genéricos. Por definición, el contenido de los genéricos debe ser idéntico al de los originales. Sin embargo, los colirios difieren de los medicamentos de aplicación sistémica en aspectos importantes:
- Podemos determinar la concentración de la sustancia activa en el colirio, pero no se puede medir la biodisponibilidad de la sustancia en el propio ojo.
- Sólo la sustancia activa de los genéricos debe ser idéntica al preparado original, todos los productos auxiliares pueden variar. Dado que la sustancia activa del latanoprost, por ejemplo, es sólo del 0,005%, la mayor parte de la gota puede cambiarse en un medicamento genérico.
- Muchos estudios mostraron diferencias entre los medicamentos originarios y los genéricos en cuanto al tamaño y la viscosidad de la gota, la naturaleza del frasco de la gota, la apertura del frasco de la gota y el conservante [7].
Por lo tanto, en nuestra opinión, cambiar a un medicamento genérico equivale a utilizar un medicamento nuevo y requiere controles más frecuentes al principio.
El frecuente cambio a medicamentos genéricos cada vez más baratos por parte de las farmacias es problemático, lo que puede llevar a que ni el paciente ni el médico sepan qué medicamento están utilizando en ese momento. Merece la pena hablar con el paciente para señalarle las diferencias entre los preparados originales y los genéricos.
No es fácil encontrar una terapia antiglaucomatosa que reduzca la progresión de la enfermedad, tenga pocos efectos secundarios y se utilice con regularidad. La adherencia y la persistencia no son muy buenas en el glaucoma, como en otras enfermedades crónicas. Muchos estudios han demostrado que el cumplimiento de la terapia prescrita es del 30-70% y que al cabo de un año sólo el 10% de los pacientes vuelven a pedir los colirios prescritos [8].
Las razones de la escasa adherencia son muchas, pero debemos ser conscientes de que estamos prescribiendo una terapia que debe utilizarse de forma extremadamente fiable y regular, pero que también tiene efectos secundarios frecuentes. Esto es especialmente problemático para los pacientes en las primeras fases del glaucoma, ya que apenas notan nada de la enfermedad en sí. En un estudio, Newman Casey resumió las razones más comunes de la falta de adherencia: Dificultad con la aplicación de las gotas, dificultad para integrar la aplicación de las gotas en la rutina diaria y efectos secundarios de las gotas [9]. No deben subestimarse los efectos secundarios. Los estudios han demostrado que dos tercios de los pacientes con glaucoma sufren los efectos secundarios de su terapia [10]. Son tanto los efectos secundarios locales de la medicación como los efectos tardíos en el ojo y especialmente en la superficie ocular los que molestan al paciente. Si un paciente muestra efectos secundarios de su terapia, merece la pena cambiar de terapia, posiblemente también de un derivado de la prostaglandina a otro derivado. Para los pacientes más jóvenes, los que toman varios medicamentos y los que padecen trastornos preexistentes de la superficie ocular (“síndrome de sicca”), merece la pena probar con colirios sin conservantes. Los conservantes, especialmente el cloruro de benzalconio, pueden provocar un aumento de los problemas de superficie ocular. Sin embargo, dado que las gotas oftálmicas sin conservantes suelen envasarse en dosis únicas, los pacientes con mala agudeza visual o alteraciones reumáticas en las manos pueden tener dificultades para aplicarlas [11].
Además de la medicación antiglaucomatosa, la presión ocular puede reducirse mediante medidas quirúrgicas. La primera intervención quirúrgica para el glaucoma se realizó en 1856 (iridectomía de Von Graefe), y recientemente el espectro quirúrgico se ha ampliado considerablemente con la introducción de la cirugía microinvasiva del glaucoma (MIGS). Menos invasivas son diversas técnicas láser que pueden tanto reducir la producción de humor acuoso como mejorar su salida.
La cirugía se considera especialmente en pacientes jóvenes con glaucoma avanzado o pacientes con intolerancia a la terapia local (sobre todo problemas de superficie ocular).
Perspectivas de futuro
El hecho de que muchos pacientes sigan quedándose ciegos a causa del glaucoma es aterrador, porque la enfermedad, si se detecta a tiempo y se trata adecuadamente, puede influir claramente en su progresión. ¿En qué tenemos que trabajar?
Todavía hay al menos un 50% de pacientes que no saben que padecen esta enfermedad. Por lo tanto, es imperativo educar a la población para identificar a las personas con glaucoma de desarrollo rápido mediante la evaluación de los pacientes y sus factores de riesgo.
Si un paciente con glaucoma inicia una terapia, debe discutirse con él el aspecto de la adherencia: ¡Un medicamento aplicado en forma de gota sólo funciona si se aplica la gota!
Es obligatorio realizar controles regulares del nervio óptico y de su funcionamiento; debe comprobarse la presión ocular y ajustar la terapia en consecuencia. Un paciente diagnosticado de glaucoma suele ser revisado por un oftalmólogo 2-3 veces al año. Medicamentos más nuevos con menos efectos secundarios y posiblemente un modo de administración diferente (por ejemplo, tapones de punción con una forma de liberación lenta o mediante inyección en el propio ojo) pueden conducir a una mejor adherencia y, por tanto, a un mejor tratamiento del glaucoma.
Las alternativas a la terapia farmacológica son importantes: la terapia láser puede utilizarse para mejorar la salida del humor acuoso; además, la terapia quirúrgica está mostrando muchos nuevos enfoques, y cada vez se realizan más procedimientos denominados “microinvasivos”, en los que a veces se insertan endoprótesis.
El propio paciente es y seguirá siendo importante: debe estar informado con precisión sobre la enfermedad e implicado en la terapia de su enfermedad.
Mensajes para llevarse a casa
- A pesar de la mejora de las medidas diagnósticas y terapéuticas, el glaucoma sigue provocando una reducción de la calidad de vida y, en ocasiones, ceguera en muchos pacientes. El número de pacientes que desconocen su enfermedad es del 50%, incluso en los países industrializados, y es necesario aumentar la información pública sobre esta enfermedad.
- El médico debe realizar un historial detallado de todos los adultos para evaluar los factores de riesgo de desarrollar glaucoma (familiar, sistémico y ocular). A partir de los 40 años, es necesario un examen preventivo realizado por un oftalmólogo; los llamados “exámenes preventivos” que a veces realizan los ópticos no son en absoluto suficientes.
- La única terapia para el glaucoma hasta ahora es el tratamiento del factor de riesgo más importante, el aumento de la presión ocular. Esta terapia se lleva a cabo sobre todo con medicamentos locales que reducen la presión ocular; con el aumento de las opciones quirúrgicas, es probable que en el futuro se recurra con más frecuencia a la terapia quirúrgica directa.
- Una buena cooperación entre el oftalmólogo tratante y el médico generalista es importante para todas las medidas terapéuticas.
Literatura:
- Quigley HA, West SK, Rodríguez J, et al: La prevalencia del glaucoma en un estudio poblacional de sujetos hispanos: Proyecto VER. Arch Ophthalmol 2001; 119: 1819-1826.
- Boletín de la Organización Mundial de la Salud, Nov 2004; 82 (11).
- Directrices EGS Edición 2014.
- Leske CM et al. Para el Grupo de Ensayo de Glaucoma Manifiesto Precoz. Arch Ophthalmol. 2003;121(1): 48-56.
- Kersey JP, Broadway DC: Glaucoma inducido por corticosteroides: revisión de la literatura. Eye 2006; 20: 407-416.
- Goldmann H, Schmidt T: Sobre la tonometría de aplanación. Ophthalmologica 1957; 134: 221-242.
- Genazzani AA, Pattarino F: Dificultades en la producción de un medicamento idéntico desde el punto de vista de la tecnología farmacéutica. Drogas RD 2008; 9(2): 65-72.
- Friedman DS, Quigley HA et al. Utilización de datos de reclamaciones farmacéuticas para estudiar la adherencia a la medicación para el glaucoma: metodología y conclusiones del Estudio de Adherencia y Persistencia del Glaucoma (GAPS). Invest Ophthalmol Vis Sci. 2007 Nov; 48(11): 5052-5057.
- Newman-Casey PA, Killeen OJ, Renner M, et al: Access to and experiences with e-health technology among glaucoma patients and their relationship with medication adherence. Telemed J E Health 2018; DOI: 10.1089/tmj.2017.0324
- Zimmerman JB, Hahn SR, Gelb L, et al: El impacto de los efectos adversos oculares en pacientes tratados con análogos tópicos de las prostaglandinas: cambios en los patrones de prescripción y persistencia de los pacientes. J Ocul Pharmacol Ther: 1308-1316.
- Dietlein TS, Jordan JF, Lüke C, et al: Autoaplicación de envases de gotas oculares de un solo uso en una población anciana: comparaciones con el envase de gotas oculares estándar y con pacientes más jóvenes. Acta Ophthalmol. 2008; 86: 856-859.
PRÁCTICA GP 2019; 14(11): 6-10